Original
Descelularización de ovario de rata: comparación de diferentes protocolos de generación de andamios para aplicaciones en bioingeniería
Decellularization of the rat ovary: comparison of different scaffold generation protocols for future applications in bioengineering
Actual Med.2024;109(818):10-19 DOI: 10.15568/am.2024.818.org1
Recibido: 10/01/2024
Revisado: 14/01/2024
Aceptado: 20/02/2024
Resumen
La insuficiencia ovárica, los trastornos hormonales y los efectos secundarios de tratamientos contra el cáncer son algunas de las causas subyacentes que pueden afectar a la capacidad de una mujer para concebir. Ante esta preocupación, surgen diferentes opciones preventivas para preservar la fertilidad como la criopreservación de embriones, ovocitos y tejido ovárico; sin embargo, estas presentan limitaciones significativas. Actualmente, la bioingeniería permite adoptar diferentes estrategias frente a los trastornos reproductivos y es por ello que en este estudio se evalúa el primer paso para fabricar bioandamios ováricos descelularizados in vitro basados en la MEC específica de tejido ovárico. Con este fin, se han utilizado ovarios completos de ratas que fueron sometidos a cuatro protocolos de descelularización que combinan diferentes tratamientos mecánico-químico-enzimáticos con el fin de eliminar los núcleos celulares, pero preservando la macro y micro estructura del tejido nativo. Los resultados del presente estudio, de carácter histológico e histoquímico, no han revelado datos significativos en cuanto a la eliminación de núcleos celulares. Sin embargo, se identificó un protocolo novedoso que ha sido capaz de eliminar generosamente parte del material celular a la vez que ha mantenido una buena estructura de la MEC. Todo esto respalda la idea de la importancia en la selección de los agentes descelularizantes y sus respectivas concentraciones; haciendo un énfasis especial en la concentración de los detergentes iónicos más fuertes como el SDS y el efecto que este provoca sobre las muestras. Además, se ha confirmado lo ya revelado en estudios recientes, y es que los andamios ováricos generados con SDC han sido capaces de conservar mejor la composición extracelular, lo cual, podría ser beneficioso para la recelularización y otras aplicaciones. Estos bioandamios generados conforman una base prometedora para futuros experimentos donde el objetivo debe de ser el de optimizar los protocolos y realizar estudios adicionales.
Palabras clave: Descelularización; Ovario completo; Histología; Rata; Bioandamio.
Abstract
Ovarian failure, hormonal disorders, and side effects of cancer treatments are some underlying causes that can affect a woman’s ability to conceive. Given this concern, different preventive options arise to preserve fertility such as cryopreservation of embryos, oocytes, and ovarian tissue; however, they have significant limitations. Currently, bioengineering allows the adoption of different strategies against reproductive disorders and that is why this study evaluates the first step to manufacture in vitro decellularized ovarian bioscaffolds based on the specific ECM of ovarian tissue. To this end, complete rat ovaries have been used that have been subjected to four decellularization protocols that combine different mechanical-chemical-enzymatic treatments in order to eliminate cell nuclei, while maintaining the macro and microstructure of the native tissue. The results of this study, of a histological and histochemical nature, have not revealed significant data regarding the elimination of cell nuclei. However, a novel protocol was identified that has generously removed some of the cellular material while preserving a good ECM structure. All this supports the idea of the importance of the selection of decellularizing agents and their respective concentrations; with special emphasis on the concentration of the strongest ionic detergents such as SDS and the effect it causes on the samples. In addition, what has already been revealed in recent studies has been confirmed, which is that the ovarian scaffolds generated with SDC have been able to better preserve the extracellular composition, which could be beneficial for recellularization and other applications. These generated bioscaffolds form a promising basis for future experiments where the objective should be to optimize the protocols and conduct additional studies.
Keywords: Decellularization; Complete ovary; Histology; Rat; Bioscaffold.
Leer Artículo Completo
INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) establece que de un 2-14% de las parejas son estériles estando en edad reproductiva, y en un 38% de los casos se atribuye a causas femeninas (1). Es por ello que la infertilidad es una cuestión creciente en el ámbito de la salud reproductiva y comprender las causas subyacentes es fundamental para lograr el diagnóstico y tratamiento clínico adecuado (2). Diferentes etiologías de salud estrechamente relacionadas con la pérdida de la función del tejido ovárico son las que pueden afectar a la capacidad de una mujer para concebir y llevar a término un embarazo con éxito (3,4); entre las que se destacan trastornos hormonales, disfunción o insuficiencia ovárica (POF) y/o efectos secundarios de los tratamientos aplicados contra el cáncer como la quimioterapia o la radioterapia (5,6,7).
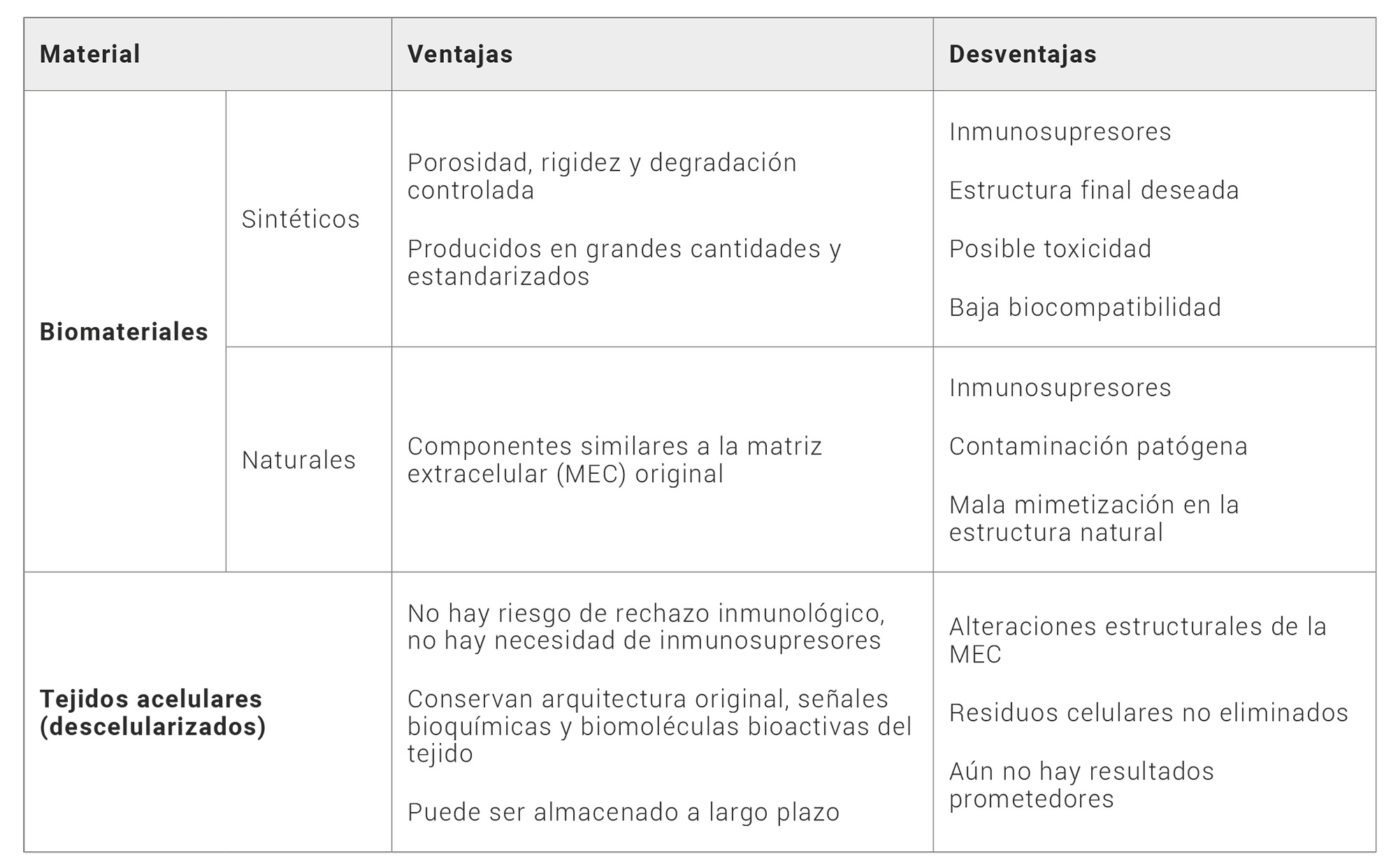
Actualmente, existen opciones establecidas comunes para preservar la fertilidad como lo son la criopreservación de embriones, ovocitos o tejido ovárico (7, 8). Sin embargo, presentan limitaciones significativas como por ejemplo tratarse de procedimientos no adecuados para mujeres prepuberales que padezcan de cáncer entre otros (8). Es por ello que las investigaciones biotecnológicas actuales sobre el tejido reproductivo femenino junto con la medicina regenerativa ofrecen una nueva esperanza para las mujeres que padecen este tipo de enfermedades (9). Esta ciencia se enmarca en dos grandes categorías: por un lado, la terapia celular, que utiliza células para reparar o regenerar tejidos dañados, y, por otro lado, la ingeniería de tejidos (IT), que combina principios de la ciencia de los materiales, la biología y la medicina para construir estructuras tridimensionales destinadas a funcionar como tejidos y órganos funcionales in vitro, lo que en este caso permitiría la creación de estructuras de soporte para el desarrollo de óvulos y tejidos ováricos (10, 11). Una estrategia interesante en este campo es el uso de andamios como soporte para el crecimiento de esas células y tejidos; que pueden ser fabricados con biomateriales de origen sintético, con materiales biocompatibles naturales imitando de manera más precisa el entorno natural del ovario o a partir de tejidos de las propias pacientes mediante procesos de descelularización (Tabla 1). Para poder lograr sustituir y mantener la función normal de los órganos, los sustitutos biológicos han de atender a las necesidades de biocompatibilidad, cinética de degradación, formación de bioproductos, similitud de las propiedades mecánicas y estructurales, y biomimetismo funcional y de composición (12,13,14).
Tabla 1. Ventajas y desventajas de la utilización de biomaterials sintéticos y naturales vs tejidos acelulares en la fabricación de bioandamios. Fuente: Elaboración propia
En lo que a este artículo concierne, los andamios biológicos que se basan en el uso de tejidos acelulares de origen biológico ofrecen un gran abanico de ventajas frente al resto de alternativas ya que la descelularización implica la eliminación de las células de un tejido de forma gradual, pero con la ventaja de mantener una matriz extracelular (MEC) compuesta principalmente de proteínas y estructuras tridimensionales nativas. Como consecuencia, se reduce el riesgo de rechazo inmunológico y se evita la necesidad de buscar donantes externos ya que estos andamios pueden ser obtenidos a partir de la propia paciente, como ovarios o tejido ovárico; lo que lo hace especialmente útil para las pacientes sometidas a tratamientos contra el cáncer o como posible tratamiento contra la POF (5-7). Además, la MEC descelularizada puede ser almacenada a largo plazo (15); es capaz de conservar la arquitectura y las señales bioquímicas esenciales del tejido original, lo que puede favorecer la diferenciación y el desarrollo de células madre o células progenitoras en células ováricas funcionales; y puede promover la interacción entre las células del andamio pre-sembradas y las células del huésped, lo que facilita la integración y vascularización del tejido implantado (16) pudiendo desencadenar respuestas biológicas beneficiosas, como la liberación de factores de crecimiento y la regulación de la función hormonal, aspectos que son cruciales para el desarrollo y funcionamiento óptimo del tejido ovárico (15).
Fue en el año 2015 donde Laronda et al fabricaron por primera vez ovarios artificiales a partir de tejidos descelularizados específicos de ovario capaces de producir estradiol y con desarrollo folicular in vivo (17). Desde entonces, se han llevado a cabo descelularizaciones ováricas en numerosas especies entre las que se incluye el humano (18,19,20,21,22) y en diferentes órganos (23,24,25,26,27,28,29,30,31), incluso demostrándose la capacidad de regeneración en algunos de ellos (13). Sin embargo, y a pesar de los grandes avances en el campo de la descelularización de tejido ovárico, aún no se han logrado resultados prometedores, y es por ello que este artículo pretende evaluar y optimizar por primera vez un protocolo de descelularización de ovario completo en ratas con el objetivo de ser un cimiento para estudios futuros.
MATERIAL Y MÉTODOS
1. Animales donantes para la generación de bioandamios y pretratamiento del tejido ovárico
La ooforectomía se realizó en 7 ratas Lewis hembras de 12 semanas edad y dio como resultado un total de 14 ovarios que se usaron en los análisis con un peso de entre 200-250 g al inicio del estudio. Fueron adquiridas a JANVIER LABS (Le Genest-Saint- Isle, Francia, número de autorización D53-103-02) y mantenidas en la Unidad Experimental del Instituto de Investigación Biosanitaria, ibs.GRANADA, Granada, España. Los ovarios se aislaron del tejido circundante, se colocaron en suero fetal bovino al 10% de dimetilsulfóxido (DMSO) y se almacenaron a -80ºC grados hasta su uso.
2. Generación de bioandamios ováricos por descelularización
Antes del comienzo de los procedimientos de descelularización, todos los ovarios se limpiaron correctamente de los restos no ováricos que pudo dejar la ooforectomía.
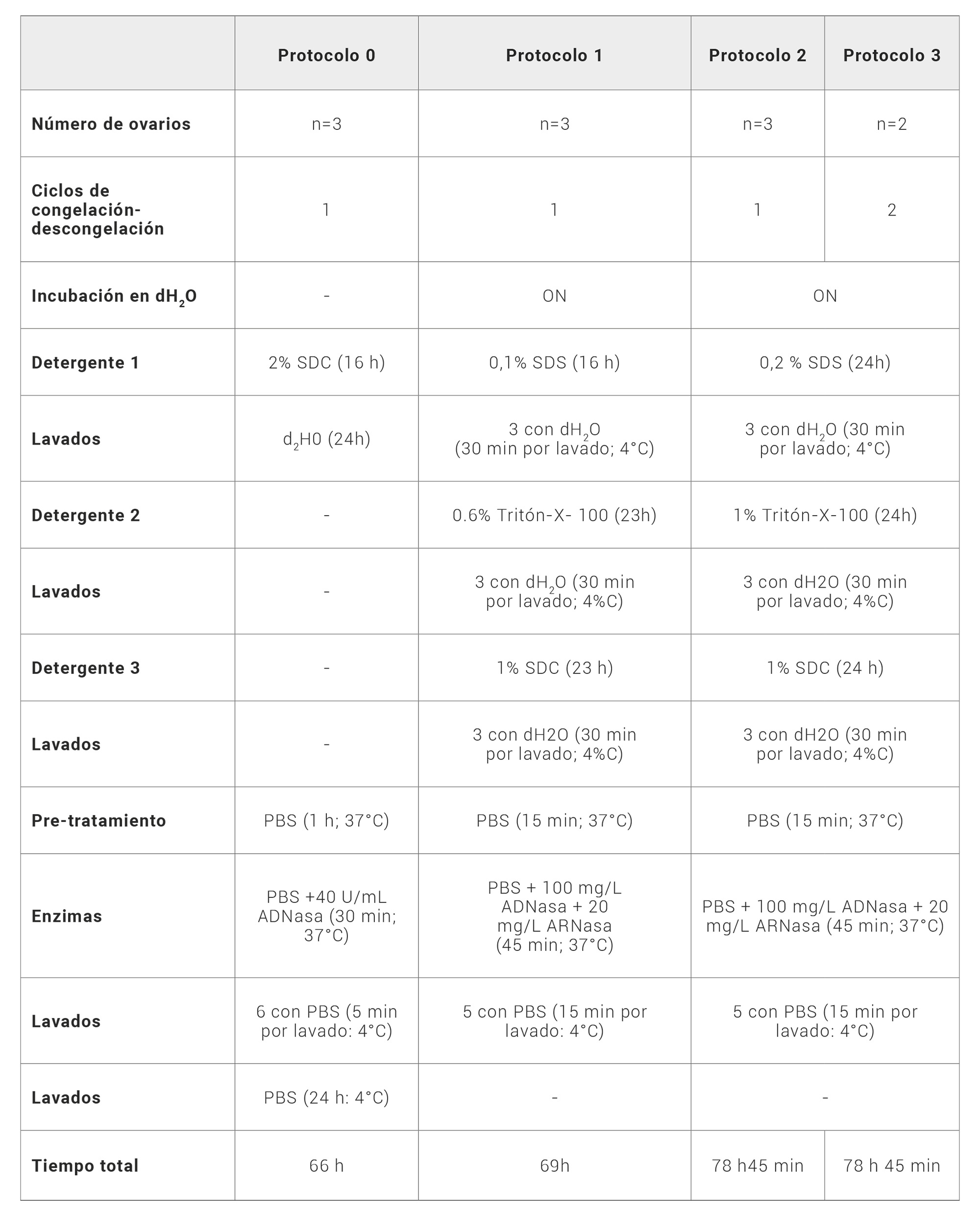
Para llevar a cabo los experimentos de descelularización, los ovarios se descongelaron y se dividieron aleatoriamente en cuatro grupos, tres de ellos con n=3 (P0, protocolo 0; P1, protocolo 1 y P2, protocolo 2) y un cuarto grupo (P3, protocolo 3) con n=2. Cada uno de estos grupos se expuso a uno de los diferentes protocolos de descelularización (Tabla 2), que optan por un procedimiento de descelularización directo mediante la sumersión de los ovarios en el reactivo de descelularización y en continua agitación a temperatura ambiente, ya que no se corroboró beneficio alguno en comparación con la perfusión vascular a baja presión a través de la arteria ovárica (22). Además, un quinto grupo de n=3 ovarios se reservó como grupo control, el cual se fijó directamente en formaldehído al 3.7% (p/v) para posteriormente procesarlo.
Tabla 2. Resumen comparativo de los cuatro protocolos finales de descelularización. Abreviaciones: SDS dodecil sulfato de sodio (Thermo Scientific, Waltham, MA, EE. UU.), SDC deoxicolato de sodio (Thermo Scientific, Waltham, MA, EE. UU.), Tritón-X-100 2-[4-(2,4,4-trimethilpentan-2-il)fenoxi]etanol (Merck/Sigma-Aldrich, EE. UU.), ADNasa desoxirribonucleasa (Merck/Sigma-Aldrich, EE. UU.), ARNasa ribonucleasa (Merck/Sigma-Aldrich, EE. UU.), dH2O agua destilada, ON durante la noche, PBS solución salina con fosfato, h horas, min minutos. (Merck/Sigma-Aldrich). Fuente: Elaboración propia
Tras la búsqueda bibliográfica, se escogió un protocolo de referencia en la literatura desarrollado por Baker-Alshaikh et al (22) para evaluar el control de la descelularización, al cual llamaremos P0 y que utiliza deoxicolato de sodio (SDC) (Thermo Scientific, Waltham, MA, EE. UU.) al 2% además de desoxirribonucleasas (ADNasas) (Merck/Sigma-Aldrich, EE. UU). Para el primer protocolo ensayado, P1, se tomó como referencia el protocolo de descelularización de aloinjertos de nervios periféricos diseñado y publicado por García-García et al (32) al que se le aplicaron unas modificaciones en lo que al tiempo concierne y que utiliza una combinación de tres detergentes diferentes: 0.1% dodecil sulfato de sodio (SDS) (Thermo Scientific, Waltham, MA, EE. UU.), 0.2% 2-[4-(2,4,4-trimethilpentan-2-il)fenoxi]etanol (Tritón-X-100) (Merck/Sigma-Aldrich, EE. UU) y 1% SDC (Thermo Scientific, Waltham, MA, EE.UU.); junto con ADNasas y ribonucleasas (ARNasas) (Merck/Sigma-Aldrich, EE. UU). Debido a los buenos resultados aparentemente obtenidos al aplicar el P1, se valoró su optimización y de esta forma surgen los otros dos protocolos restantes P2 y P3. La diferencia entre estos respecto al P1 reside en dos factores: por un lado, el aumento de la concentración de los detergenetes utilizados (el SDS pasó de 0.1% a un 0.2% y el Tritón-X-100 de 0.6% a un 1%); y por otro lado, el diferente número de ciclos de congelación-descongelación (un ciclo para el P2, dos ciclos para el P3) para poder comprobar el impacto real del método físico además del químico (detergentes) y del enzimático (nucleasas). Una vez llevado a cabo cada protocolo, las muestras se almacenaron a 4ºC en formaldehído al 3.7% (p/v) durante 72 horas hasta su procesamiento.
3. Histología
Para el análisis histológico, las muestras se prepararon para su inclusión en parafina y finalmente se seccionaron en cortes de 5 μm. Finalmente, se desparafinaron las secciones durante 20 minutos, se rehidrataron y se le aplicaron los siguientes protocolos de tinción estándar: hematoxilina y eosina (HE) para visualizar la estructura general (núcleos, citoplasma y MEC), azul alcián (AB) para teñir polisacáridos ácidos como los glicosaminoglicanos (GAGs), tricrómico de Masson (MT) para el colágeno y finalmente Verhoeff van Gieson (VVG) para divisar las fibras elásticas, aunque también es capaz de teñir colágeno. Además, se tiñeron secciones con el agente intercalante 4’,6-diamidino-2-fenilindol (DAPI) para marcar con fluorescencia los restos potenciales de ADN remanente en el tejido.
Las imágenes a nivel histológico mostradas en este artículo han sido tomadas principalmente con el escáner Pannoramic Desk II DW (3DHistech, Budapest, Hungría) y con el microscopio Eclipse 90i (Nikon, Tokio, Japón).
4. Cuantificación y análisis estadístico
Los componentes de la MEC fueron cuantificados a partir de las muestras teñidas anteriormente mediante el software ImageJ Fiji versión 1.53f51 (National Institutes of Health, EE. UU.). Se seleccionó de forma arbitraria la misma sección de cuantificación (28 cm2) respectiva a cada tratamiento de descelularización y tinción analizada, analizando un total de tres secciones aleatorias de 28 cm2 por ovario. Las imágenes fueron obtenidas bajo las mismas condiciones de intensidad, brillo y contraste de imagen entre tinciones. Todas las gráficas obtenidas en este artículo, así como los análisis estadísticos se realizaron mediante el software Prism 9 (GraphPad, CA, EE. UU.).
En lo referido al análisis estadístico, primeramente, se calcularon los valores medios de intensidad y la desviación estándar (DE) correspondiente a cada protocolo para normalizar los valores respecto a los resultados del grupo control. Posteriormente se realizó la prueba de normalidad de Shapiro-Wilk y se confirmó una distribución asimétrica de los datos, por lo que se realizaron pruebas no paramétricas. Se llevó a cabo la comparación de grupos múltiples de Kruskal-Wallis y Dunn para evaluar los niveles de diferencia significativa (las diferencias de p ≤ 0,05 se consideraron significativas y se indican con diferentes superíndices: * y **). Finalmente, los datos se presentan como la media ± DE.
RESULTADOS
1. Análisis histológico, histoquímica y cuantificación de los componentes de la MEC
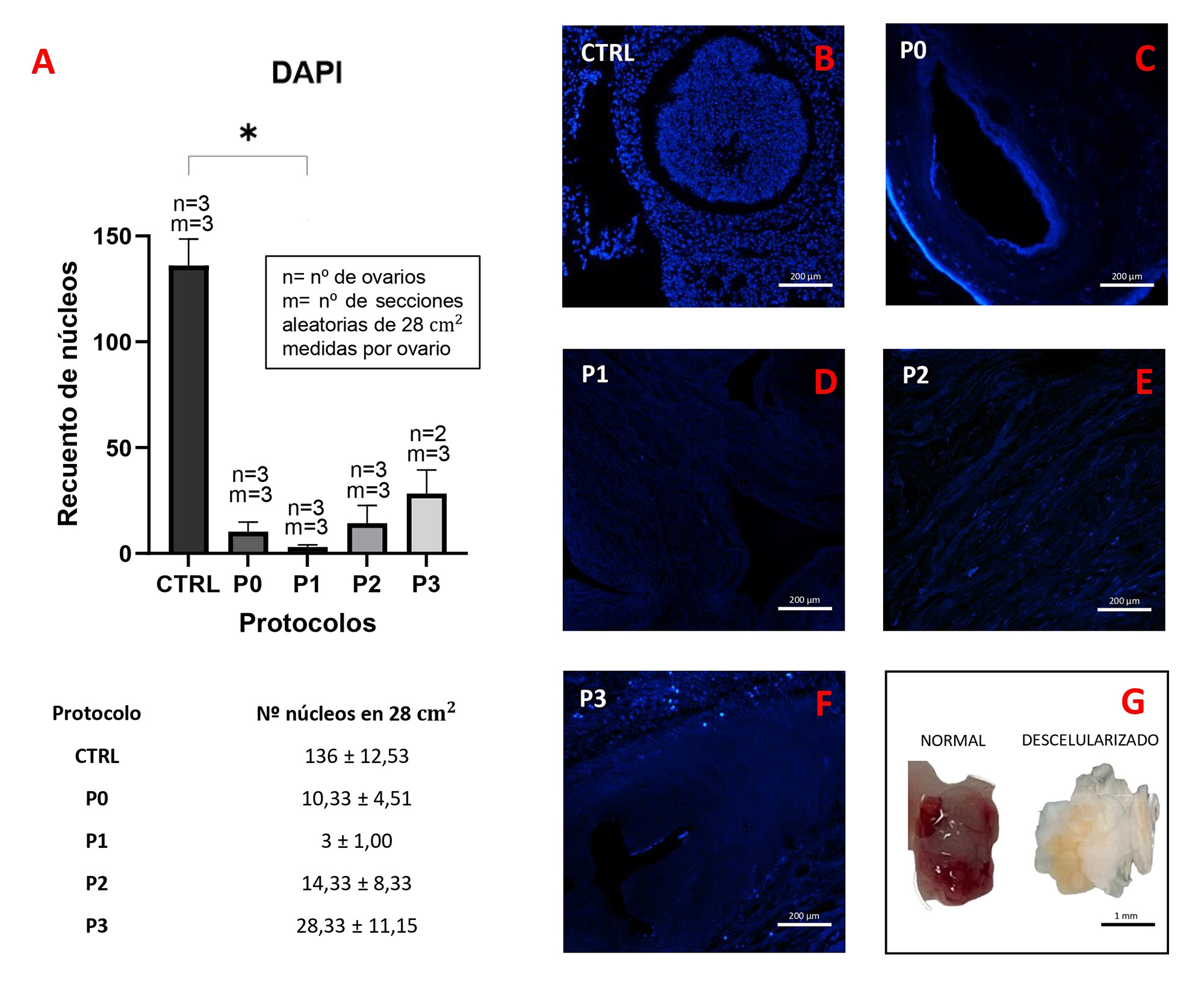
De forma macroscópica se puede observar una variación en el tamaño y en la estructura de los ovarios tras la descelularización, mediante la cual, se hicieron más pequeños y adquirieron una estructura menos densa respecto al control (Figura 1. G).
Figura 1. Resumen de los núcleos remanentes tras los protocolos de descelularización y estructura general de los ovarios. DAPI para histoquímica (a) e histología (b-f), macroestructura del ovario pre y post descelularización (g). Abreviaturas: DAPI 4’,6-diamidino-2-fenilindol, CTRL control, P0 protocolo 0, P1 protocolo 1, P2 protocolo 2 y P3 protocolo 3. Imágenes DAPI tomadas con el microscopio Eclipse 90i (Nikon, Tokio, Japón). Cuantificación mediante el software ImageJ Fiji versión 1.53f51 (National Institutes of Health, EE. UU.). Gráficas y análisis estadísticos mediante el software Prism 9 (GraphPad, CA, EE. UU.). Fuente: Elaboración Propia
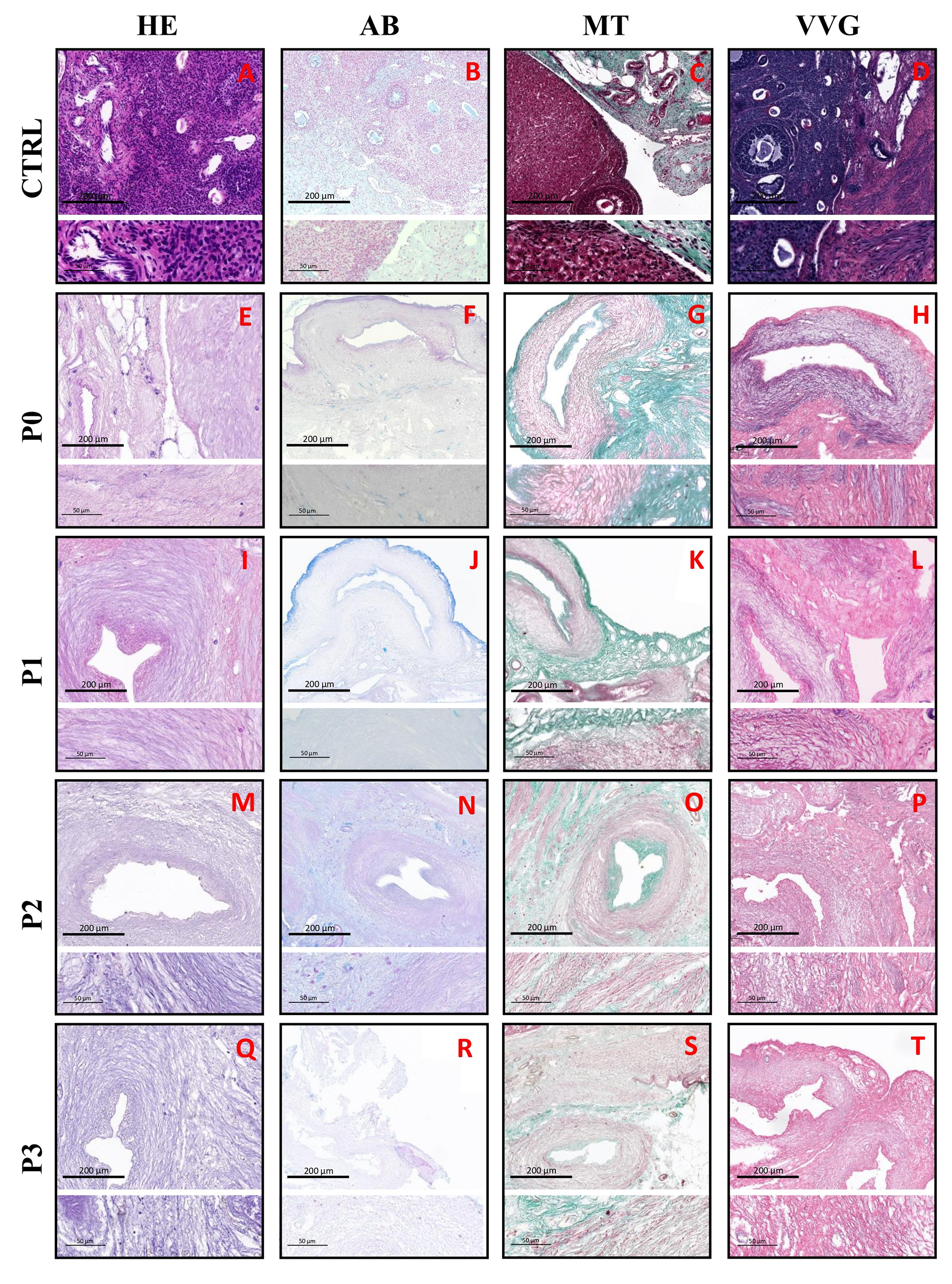
En primer lugar, se evaluó la estructura histológica general a través de la tinción HE (Figura 2. A, E, I, N, Q), la cual reveló que los bioandamios generados a partir de los diferentes protocolos de descelularización aplicados fueron capaces de mantener macroscópicamente estructuras similares a las presentadas en el patrón histológico típico de la MEC de ovario de rata sin cambiar considerablemente su apariencia morfológica. Se mostró la presencia de materiales tanto basófilos (núcleos celulares) como eosinofílicos (citoplasma celular y MEC) en tejidos nativos y descelularizados. Esta tinción y especialmente la tinción DAPI (Figura 1. B-F), revelaron presencia visible de núcleos celulares remanentes tras el proceso de descelularización en todos los protocolos, aunque el P1 ha sido el que ha mostrado una reacción positiva más débil en comparación con el resto de protocolos (Figura 1. A).
Figura 2. Resumen comparativo de las tinciones aplicadas. Secciones de tejido teñidas con HE (a, e, i, n, q), AB (b, f, j, l, r), MT (c, g, k, o, s) y VVG (d, h, m, p, t). Abreviaturas: HE hematoxilina-eosina, AB azul alcián, MT tricrómico de Masson, VVG Verhoeff van Gieson modificado, CTRL control, P0 protocolo 0, P1 protocolo 1, P2 protocolo 2 y P3 protocolo 3. Imágenes tomadas principalmente con el escáner Pannoramic Desk II DW (3DHistech, Budapest, Hungría) y con el microscopio Eclipse 90i (Nikon, Tokio, Japón). Fuente: Elaboración Propia
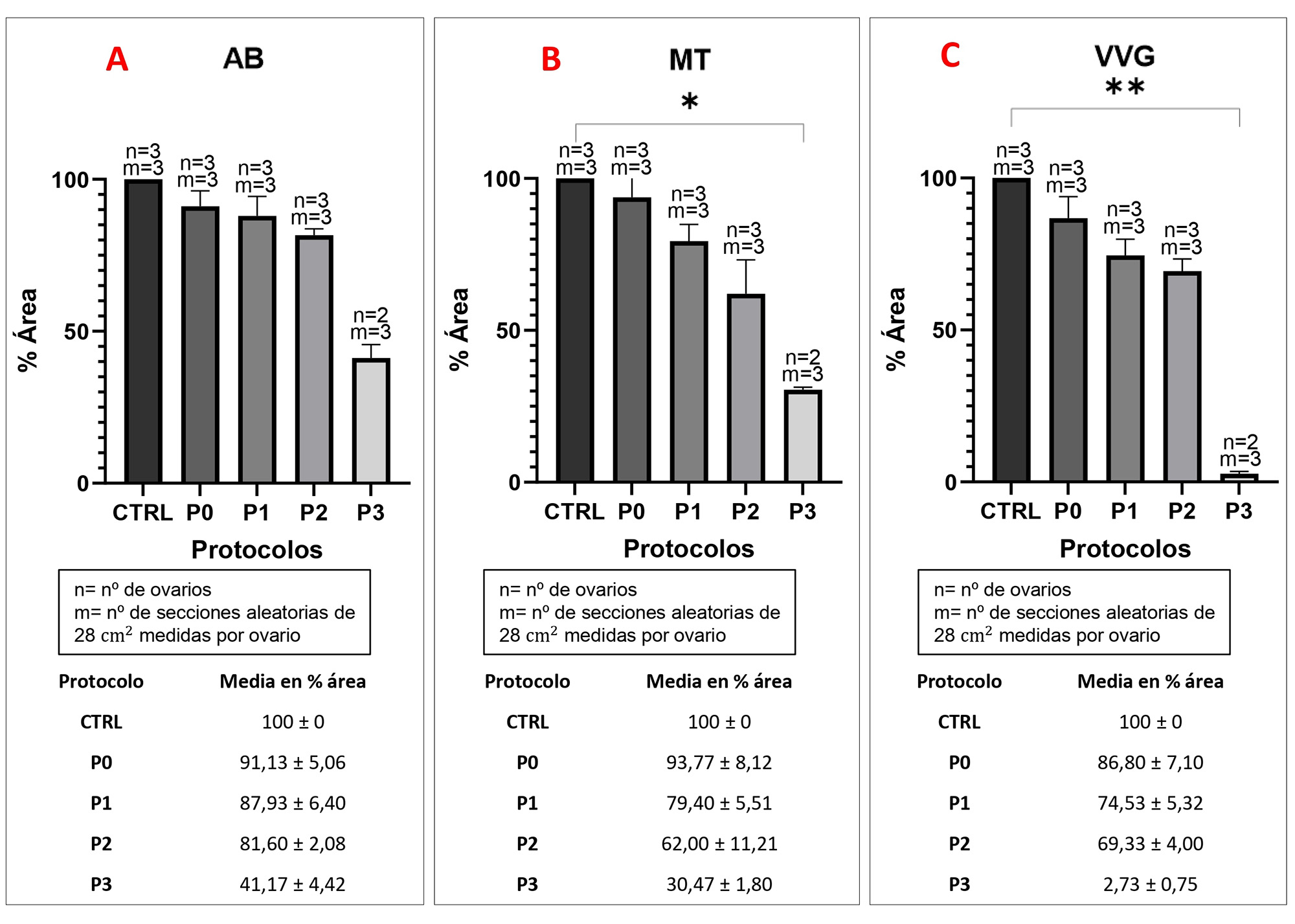
De forma general, los resultados de la cuantificación histoquímica (Figura 3) muestran una reducción en la intensidad de señal en el porcentaje de área para GAGs, colágeno y fibras elásticas respecto al 100% de intensidad de área de las muestras control. Por un lado; la tinción AB (Figura 2. B, F, J, L, R), usada para teñir GAGs, mostró una reducción de la intensidad de señal para todos los protocolos aplicados (P0 = 91.13 ± 5.06 %, P1 = 87.93 ± 6.40 %, P2 = 81.60 ± 2.08 % y P3 = 41.17 ± 4.42 %) siendo significativa en el P3 ya que se reduce cuantiosamente el contenido de GAGs a menos de la mitad respecto al grupo control. En contraposición; P0, P1, y P2 han sido capaces de conservar mejor los GAGs, teniendo estos dos últimos protocolos un contenido muy similar entre sí y siendo el P0 el que ha tenido mayor éxito de los tres tratamientos (Figura 3. A). Por otra parte; en cuanto al contenido en colágeno, medido con la tinción MT (Figura 2. C, G, K, O, S), se mostró preservado para todos los bioandamios ováricos en paralelismo con el control nativo, aunque la cantidad se ve reducida conforme la MEC pierde integridad por los protocolos más agresivos (Figura 3. B). Cantidades potencialmente más altas de colágeno preservado fueron vistas en los ovarios tratados con P0 (93.77 ± 8.12 %) y P1 (79.40 ± 5.51 %) en contraste con los otros dos protocolos que contenían SDS y Tritón-X-100 a una mayor concentración (P2 (62.00 ± 11.21 %) y P3 (62.00 ± 11.21).
Figura 3. Proporción de componentes remanentes de la MEC tras la aplicación de los protocolos de descelularización. Histoquímica en AB para GAGs (a), MT para colágeno (b), y VVG para fibras elásticas (c). (*, ** P<0.05) Abreviaciones: CTRL control, P0 protocolo 0, P1 protocolo 1, P2 protocolo 2, P3 protocolo 3, MT tricrómico de Masson, AB azul alcián y VVG Verhoeff van Gieson. Cuantificación mediante el software ImageJ Fiji versión 1.53f51 (National Institutes of Health, EE. UU.). Gráficas y análisis estadísticos mediante el software Prism 9 (GraphPad, CA, EE. UU.). Fuente: Elaboración Propia
Por último, la tinción VVG (Figura 2. D, H, M, P, T) ha sido utilizada para visualizar las fibras elásticas, aunque también es capaz de teñir colágeno. Esta tinción sugirió una disminución casi completa del contenido de fibras elásticas en el P3 (2.73 ±0.75 %) en contraposición con el control nativo de ovario (Figura 3. C). Sin embargo, los tratamientos P0 (86.80 ± 7.10 %), P1 (74.53 ± 5.32 %) y P2 (69.33 ± 4.00 %) fueron capaces de mantener fibras elásticas visibles, aunque en menor medida respecto al control.
DISCUSIÓN
Actualmente, la descelularización exitosa de tejido ovárico y la subsiguiente recuperación de su funcionalidad sigue siendo un desafío. Como consecuencia, son numerosos los estudios publicados hasta la fecha sobre generación de ovarios bioartificiales con el objetivo de generar un protocolo de biofabricación estándar. Sin embargo, debido a la complejidad estructural y molecular de estos órganos, aún sigue siendo un objetivo por cumplir. Los estudios publicados hasta la fecha se enfrentan a dos aspectos importantes a la hora de fabricar ovarios bioartificiales: lograr una eliminación celular eficiente y una conservación adecuada de la composición de la MEC resultante (GAGs, colágeno y fibras elásticas) (33,34,35). Es por ello que la gran mayoría de los autores han optado por la combinación de diferentes agentes descelularizantes (18-22), donde la concentración y el tiempo de exposición de estos agentes cobran una gran importancia ya que deben de ajustarse a la histología del tejido (36, 37).
De acuerdo con esta hipótesis, en este artículo se presentan datos novedosos sobre la descelularización de ovario completo de rata comparando cuatro estrategias diferentes. Para llegar a este fin se han evaluado distintas metodologías combinadas de descelularización: ciclos de congelación-descongelación en los tres protocolos nuevos (P1, P2 y P3) junto con concentraciones diferentes de detergentes no iónicos (Tritón-X100) e iónicos (SDS y/o SDC) combinados entre sí con el objetivo de conseguir la lisis de la membrana celular y la solubilización de los elementos celulares, seguido de un tratamiento enzimático (ADNasa y/o ARNasa) para eliminar el contenido de ADN responsable de la respuesta inmunológica in vivo (38). Además, estos tres nuevos protocolos fueron comparados con un método bien descrito en la bibliografía (P0) (22). Finalmente, la efectividad de estos métodos se confirmó mediante ensayos histológicos e histoquímicos.
La eficacia de la descelularización relacionada con la solubilización de elementos celulares de los tres protocolos nuevos (P1, P2 y P3) no fue satisfactoria en términos generales según los resultados de las pruebas histológicas e histoquímicas. Se evaluó la presencia de núcleos celulares remanentes mediante la tinción DAPI, y en ninguno de los casos se consiguió su eliminación completa. Sin embargo, el P1, con una menor concentración de los detergentes empleados y un menor tiempo de exposición por parte del SDS y del Tritón-X-100 en comparación con el P2 y P3, ha sido más efectivo en cuanto a la eliminación de material celular y lo ha logrado en un menor tiempo. Este dato resulta intuitivamente contradictorio ya que cabría esperar que se hubiera eliminado más contenido del que se resulta en el P2 y P3 por las elevadas concentraciones de los detergentes empleados; lo cual podría explicarse, ya que a concentraciones muy altas de detergentes, estos pueden formar micelas o agregados excesivamente grandes, lo que puede interferir con la acción de los propios agentes descelularizantes y limitar su capacidad para penetrar y eliminar células de manera efectiva (39).
Otro de los objetivos principales de la descelularización es el de mantener la MEC específica del tejido a descelularizar, la cual está muy relacionada con la eficacia de la recelularización. La evaluación histológica e histoquímica de los GAGs, del colágeno y de las fibras elásticas nos permitió observar un patrón de resultados muy similares, donde el P0 fue el que mejor conservó este conjunto de proteínas seguido de P1, P2 y P3 respectivamente. Los análisis relacionados con los GAGs confirmaron una disminución de estos después de la descelularización para todos los protocolos, especialmente para el P3. Sorprendentemente, para los grupos P1 y P2 que utilizaron concentraciones diferentes de los mismos agentes descelularizantes, se obtuvieron resultados similares en cuanto su preservación, lo que indica que el aumento de la concentración de estos no es significativamente influyente en la preservación de los GAGs. Por otro lado, la gran disminución que se produce en el P3 podría estar relacionado con la elevada concentración de SDS y Tritón-X-100 combinada dos ciclos de congelación-descongelación; aunque este dato es difícil de contrastar debido a que no hay registro bibliográfico de estudios que sometan los ovarios a dos ciclos de congelación-descongelación previo al uso de los detergentes. A pesar de todo, es el P0 el protocolo que mejor conserva los GAGs, protocolo que utiliza exclusivamente SDC como agente descelularizante y que se está utilizando en los últimos estudios publicados como alternativa al agresivo SDS (31). En cuanto a la red de colágeno, la histoquímica confirmó su conservación en el P0, P1 y P2 y una reducción de su contenido a más de la mitad para el P3, lo cual, podría deberse a lo comentado con anterioridad. En tercer lugar, y con respecto a las fibras elásticas, la tinción VVG ha demostrado que la conservación de estas es la que más comprometida se ve tras la aplicación de los tratamientos. En este caso, el P3 es el más afectado, llegándose a perder aproximadamente un 97% del contenido. En este sentido, y en base a estos resultados, se recomienda evitar el uso de más de un ciclo de congelación-descongelación si se pretende mantener una buena integridad de los componentes estructurales de la MEC nativa.
En conclusión, el P1 basado en SDS, Tritón-X-100 y SDC a bajas concentraciones ha conservado una buena estructura de la MEC tras los procedimientos de descelularización en comparación con el P2 y P3, incluso muy similar al protocolo control P0. Además, ha sido el protocolo de entre los cuatro testados que menor núcleos remanentes ha revelado tras el tratamiento, aunque no ha logrado eliminar por completo el contenido en ADN, lo cual podría no ser beneficioso a la hora de evadir una respuesta inmune potencialmente perjudicial post-injerto. Por lo tanto, el P1 se presenta como un protocolo candidato interesante a optimizar para ensayos futuros en bioingeniería ovárica utilizando el modelo de rata con el objetivo de enfocarlo hacia un ámbito clínico y así llevar a cabo la recelularización de este tejido como alternativa regenerativa a la pérdida de la función ovárica.
AGRADECIMIENTOS
A todos los miembros del Departamento de Histología de la Facultad de Medicina de la Universidad de Granada, incluyendo al personal técnico, y con un énfasis especial a Miguel Ángel Martín Piedra.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Organización Mundial de la Salud [Internet]. [cited 2023 Jun 27]. Available from: https://www.who.int/es
- ↑Definición de ovario – Diccionario de cáncer del NCI – NCI [Internet]. [cited 2023 Jun 27]. Available from: https://www.cancer.gov/espanol/publicaciones/diccionarios/diccionario-cancer/def/ovario
- ↑Amjadi F, Beheshti R, Nasimi FS, Hassani A, Shirazi R, Tamadon A, et al. Decellularized bovine ovarian niche restored the function of cumulus and endothelial cells. BMC Res Notes. 2022;15(1). DOI: 10.1186/s13104-022-06233-7
- ↑Ghahremani-Nasab M, Ghanbari E, Jahanbani Y, Mehdizadeh A, Yousefi M. Premature ovarian failure and tissue engineering. J Cell Physiol. 2020;235(5):4217–26. DOI: 10.1002/jcp.29376
- ↑Hewlett M, Mahalingaiah S. Update on primary ovarian insufficiency. Curr Opin Endocrinol Diabetes Obes. 2015;22(6):483–9. DOI: 10.1097/MED.0000000000000206
- ↑Qin Y, Jiao X, Simpson JL, Chen ZJ. Genetics of primary ovarian insufficiency: new developments and opportunities. Hum Reprod Update. 2015;21(6):787–808. DOI: 10.1093/humupd/dmv036
- ↑Donnez J, Dolmans MM, Pellicer A, Diaz-Garcia C, Sanchez Serrano M, Schmidt KT, et al. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertil Steril. 2013;99(6):1503–13. DOI: 10.1016/j.fertnstert.2013.03.030
- ↑Anderson RA, Wallace WHB. Fertility preservation in girls and young women. Clin Endocrinol (Oxf). 2011;75(4):409–19. DOI: 10.1111/j.1365-2265.2011.04.100.x
- ↑Campo H, Baptista PM, López-Pérez N, Faus A, Cervelló I, Simón C. De- and recellularization of the pig uterus: a bioengineering pilot study. Biol Reprod. 2017;96(1):34–45. doi: 10.1095/biolreprod.116.143396
- ↑Amjadi F, Beheshti R, Nasimi FS, Hassani A, Shirazi R, Tamadon A, et al. Decellularized bovine ovarian niche restored the function of cumulus and endothelial cells. BMC Res Notes. 2022;15(1). DOI: 10.1186/s13104-022-06233-7
- ↑Gandolfi F, Ghiringhelli M, Brevini TAL. Bioengineering the ovary to preserve and reestablish female fertility. Anim Reprod. 2020;16(1):45–51. DOI: 10.21451/1984-3143-AR2018-0099
- ↑Olalekan SA, Burdette JE, Getsios S, Woodruff TK, Julie Kim J. Development of a novel human recellularized endometrium that responds to a 28-day hormone treatment. Biol Reprod. 2017;96(5):971–81. DOI: 10.1093/biolre/iox039
- ↑Tamadon A, Park KH, Kim YY, Kang BC, Ku SY. Efficient biomaterials for tissue engineering of female reproductive organs. Tissue Eng Regen Med. 2016;13(5):447–54. DOI: 10.1007/s13770-016-9107-0
- ↑Murphy S V., Atala A. 3D bioprinting of tissues and organs. Nat Biotechnol. 2014;32(8):773–85. DOI: 10.1038/nbt.2958
- ↑Pennarossa G, Ghiringhelli M, Gandolfi F, Brevini TAL. Whole-ovary decellularization generates an effective 3D bioscaffold for ovarian bioengineering. J Assist Reprod Genet. 2020;37(6):1329–39. DOI: 10.1007/s10815-020-01784-9
- ↑Pennarossa G, De Iorio T, Gandolfi F, Brevini TAL. Ovarian Decellularized Bioscaffolds Provide an Optimal Microenvironment for Cell Growth and Differentiation In Vitro. Cells. 2021;10(8). DOI: 10.3390/celdas10082126
- ↑Wu T, Gao YY, Tang XN, Zhang JJ, Wang SX. Construction of Artificial Ovaries with Decellularized Porcine Scaffold and Its Elicited Immune Response after Xenotransplantation in Mice. J Funct Biomater. 2022;13(4). DOI: 10.3390/jfb13040165
- ↑Eivazkhani F, Abtahi NS, Tavana S, Mirzaeian L, Abedi F, Ebrahimi B, et al. Evaluating two ovarian decellularization methods in three species. Mater Sci Eng C Mater Biol Appl. 2019; 102:670–82. DOI: 10.1016/j.msec.2019.04.092
- ↑Alshaikh AB, Padma AM, Dehlin M, Akouri R, Song MJ, Brännström M, et al. Decellularization and recellularization of the ovary for bioengineering applications; studies in the mouse. Reprod Biol Endocrinol. 2020;18(1). DOI: 10.1186/s12958-020-00630-y
- ↑Sistani MN, Zavareh S, Valujerdi MR, Salehnia M. Characteristics of a decellularized human ovarian tissue created by combined protocols and its interaction with human endometrial mesenchymal cells. Prog Biomater. 2021;10(3):195–206. DOI: 10.1007/s40204-021-00163-6
- ↑Hassanpour A, Talaei-Khozani T, Kargar-Abarghouei E, Razban V, Vojdani Z. Decellularized human ovarian scaffold based on a sodium lauryl ester sulfate (SLES)-treated protocol, as a natural three-dimensional scaffold for construction of bioengineered ovaries. Stem Cell Res Ther. 2018;9(1):252. DOI: 10.1186/s13287-018-0971-5
- ↑Alshaikh AB, Padma AM, Dehlin M, Akouri R, Song MJ, Brännström M, et al. Decellularization of the mouse ovary: comparison of different scaffold generation protocols for future ovarian bioengineering. J Ovarian Res. 2019;12(1). DOI: 10.1186/s13048-019-0531-3
- ↑Rajabi-Zeleti S, Jalili-Firoozinezhad S, Azarnia M, Khayyatan F, Vahdat S, Nikeghbalian S, et al. The behavior of cardiac progenitor cells on macroporous pericardium-derived scaffolds. Biomaterials. 2014;35(3):970–82. DOI: 10.1016/j.biomaterials.2013.10.045
- ↑Lecht S, Stabler CT, Rylander AL, Chiaverelli R, Schulman ES, Marcinkiewicz C, et al. Enhanced reseeding of decellularized rodent lungs with mouse embryonic stem cells. Biomaterials. 2014;35(10):3252–62. DOI: 10.1016/j.biomaterials.2013.12.093
- ↑Lee H, Han W, Kim H, Ha DH, Jang J, Kim BS, et al. Development of Liver Decellularized Extracellular Matrix Bioink for Three-Dimensional Cell Printing-Based Liver Tissue Engineering. Biomacromolecules. 2017;18(4):1229–37. DOI: 10.1021/acs.biomac.6b01908
- ↑Yu YL, Shao YK, Ding YQ, Lin KZ, Chen B, Zhang HZ, et al. Decellularized kidney scaffold-mediated renal regeneration. Biomaterials. 2014;35(25):6822–8. DOI: 10.1016/j.biomaterials.2014.04.074
- ↑Aulino P, Costa A, Chiaravalloti E, Perniconi B, Adamo S, Coletti D, et al. Muscle extracellular matrix scaffold is a multipotent environment. Int J Med Sci. 2015;12(4):336–40. DOI: 10.7150/ijms.10761
- ↑Baiguera S, Del Gaudio C, Kuevda E, Gonfiotti A, Bianco A, Macchiarini P. Dynamic decellularization and cross-linking of rat tracheal matrix. Biomaterials. 2014;35(24):6344–50. DOI: 10.1016/j.biomaterials.2014.04.070
- ↑Singh A, Bivalacqua TJ, Sopko N. Urinary Tissue Engineering: Challenges and Opportunities. Sex Med Rev. 2018;6(1):35–44. DOI: 10.1016/j.sxmr.2017.08.004
- ↑Kajbafzadeh AM, Khorramirouz R, Kameli SM, Hashemi J, Bagheri A. Decellularization of Human Internal Mammary Artery: Biomechanical Properties and Histopathological Evaluation. Biores Open Access. 2017;6(1):74–84. DOI: 10.1089/biores.2016.0040
- ↑Zhang JK, Du RX, Zhang L, Li YN, Zhang M Le, Zhao S, et al. A new material for tissue engineered vagina reconstruction: Acellular porcine vagina matrix. J Biomed Mater Res A. 2017;105(7):1949–59. DOI: 10.1002/jbm.a.36066
- ↑García-García ÓD, El Soury M, Campos F, Sánchez-Porras D, Geuna S, Alaminos M, et al. Comprehensive ex vivo and in vivo preclinical evaluation of novel chemo enzymatic decellularized peripheral nerve allografts. Front Bioeng Biotechnol. 2023;11. DOI: 10.3389/fbioe.2023.1162684
- ↑Hillebrandt KH, Everwien H, Haep N, Keshi E, Pratschke J, Sauer IM. Strategies based on organ decellularization and recellularization. Transpl Int. 2019;32(6):571–85. DOI: 10.1111/tri.1346
- ↑Gupta SK, Mishra NC, Dhasmana A. Decellularization Methods for Scaffold Fabrication. Methods Mol Biol. 2018; 1577:1–10. DOI: 10.1007/7651_2017_34
- ↑Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011;32(12):3233–43. DOI: 10.1016/j.biomaterials.2011.01.057
- ↑Peng G, Liu H, Fan Y. Biomaterial Scaffolds for Reproductive Tissue Engineering. Ann Biomed Eng. 2017;45(7):1592–607. DOI: 10.1007/s10439-016-1779-z
- ↑Young RC, Goloman G. Allo- and xeno-reassembly of human and rat myometrium from cells and scaffolds. Tissue Eng Part A. 2013;19(19–20):2112–9. DOI: 10.1089/diez.TEA.2012.0549
- ↑Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials. 2006;27(19):3675–83. DOI: 10.1016/j.biomaterials.2006.02.014
- ↑Ortiz A. Obtención y caracterización de andamios porosos nanoreforzados, para su posible uso en la regeneración de tejido óseo. Centro de Investigación Científica de Yucatán. 2014. Available from: https://cicy.repositorioinstitucional.mx/jspui/bitstream/1003/689/1/PMP_D_Tesis_2011_Alejandro_Ortiz_Fernandez.pdf
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Rosa María Zumaquero Pérez. Av. de la Investigación, 11 · 18016 Granada. E-mail: rosazumaquero@gmail.com