Revisión
Perforaciones timpánicas e ingeniería tisular en modelos in vivo: una revisión sistemática
Eardrum perforations and tissue engineering in in vivo models: a systematic review
Actual Med.2024;109(819):100-112 DOI: 10.15568/am.2024.819.rev01
Recibido: 14/07/2024
Revisado: 23/07/2024
Aceptado: 01/08/2024
Resumen
La membrana timpánica actúa como límite entre el oído medio y externo, desempañando un papel fundamental en el proceso de audición. Su estructura se compone de varias capas que permiten entre otras funciones la transmisión de las ondas sonoras. No obstante, esta membrana es vulnerable a lesiones, siendo las perforaciones las que cuentan con una mayor prevalencia.
El tratamiento de estas perforaciones puede ir desde la observación hasta procedimientos quirúrgicos como la timpanoplastia, aunque a menudo se enfrentan a problemas como recidivas y complicaciones en la cicatrización. En este contexto, la ingeniera tisular y las terapias avanzadas se presentan como opciones prometedoras, ya que permiten el empleo de biomateriales y/o células para facilitar la regeneración del tejido afectado. seen este sentido, se ha realizado una revisión de la literatura científica reciente, de forma sistemática, para evaluar el estado actual de estas terapias en el tratamiento de perforaciones timpánicas en modelos in vivo.
Palabras clave: Perforación timpánica; Ingeniería tisular; Terapias avanzadas.
ABSTRACT
The tympanic membrane stands as a border between the middle and the outer ear, playing a leading role in hearing. It consists of several layers that among other functions allow sound waves to properly go through. However, this membrane is vulnerable to injury. In this matter tympanic perforations stand out as the disease with a higher prevalence due to eardrum damage.
Treatment for these perforations can go from observation to surgical procedures such as tympanoplasty. However, these procedures often cope up with issues such as recurrences as well as hardships in healing. On the other hand, tissue engineering and advanced therapies are rising as promising options, as they allow the use of biomaterials and/or cells to improve the regeneration of damaged tissue. In this sense, it has been carried out a systematic review of the recent scientific literature regarding the status of these therapies in the treatment of tympanic perforations in in vivo models.
Keywords: Tympanic perforation; Tissue engineering; Advanced therapies.
Leer Artículo Completo
INTRODUCCIÓN
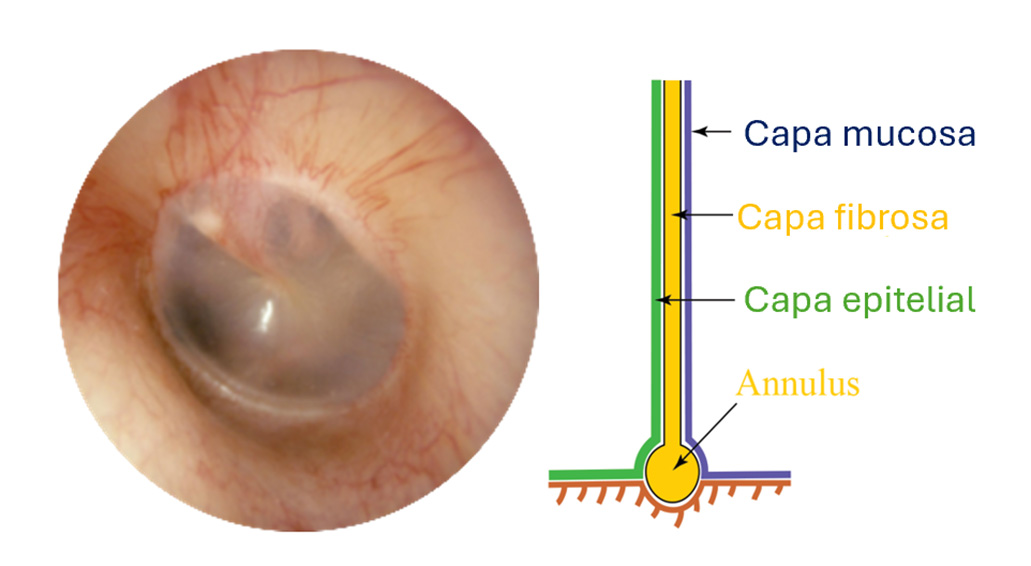
El tímpano es una estructura anatómica que actúa como límite entre el oído medio y externo y que desempeña un papel crucial en el complejo proceso que supone la audición. Esta delgada membrana tiene una composición histológica única, formada por tres tejidos: la epidermis o capa externa, la capa fibrosa central y la capa mucosa interna (1) (Figura 1). Cada uno de estos tejidos cumple funciones específicas que contribuyen a la transmisión de las ondas sonoras desde el exterior al oído interno, permitiendo así la percepción del sonido por parte del individuo (2).
Figura 1. Membrana timpánica normal junto con representación de su composición histológica (Adaptado de https://www.enteducationswansea.org/normal-ear-anatomy).
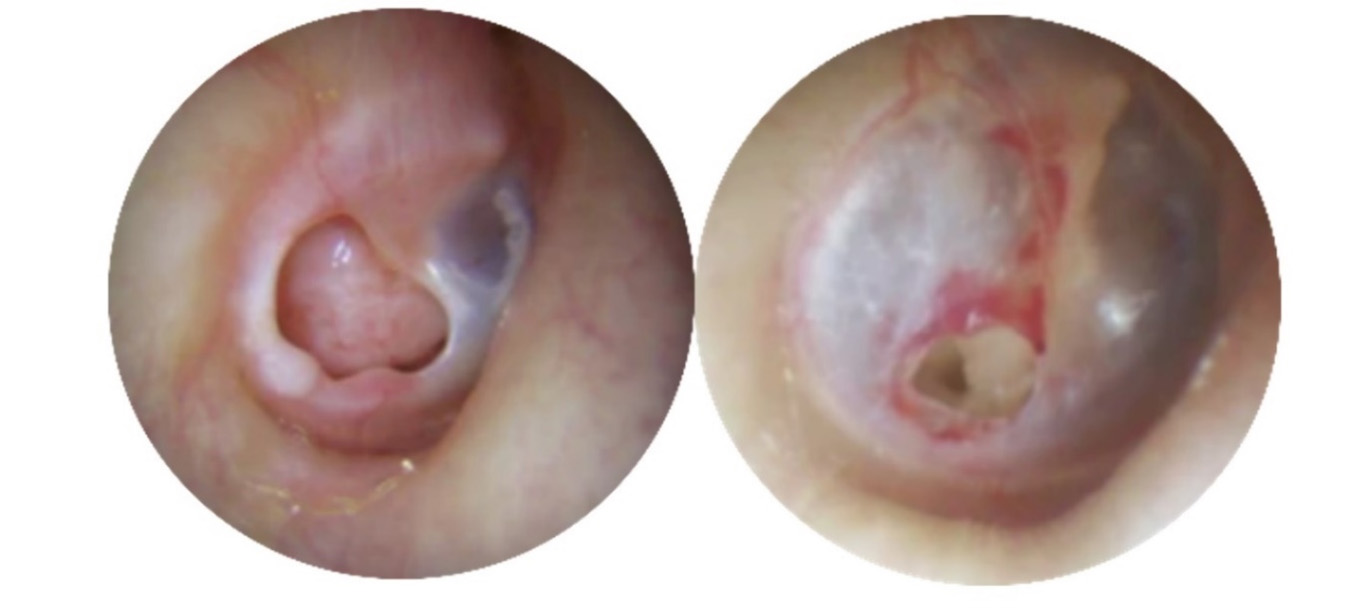
No obstante, a pesar de su importancia, el tímpano es vulnerable a diversas lesiones, siendo las perforaciones timpánicas una de las complicaciones más habituales que pueden afectar a su integridad y estructura (3)( Figura 2). Estas perforaciones pueden deberse a diversas causas, como traumatismos, infecciones o procedimientos médicos, manifestándose con síntomas como pérdida de audición, otalgia u otorrea (4). Existen múltiples criterios para clasificarlas, si bien, las distinciones más habituales suelen realizarse tanto en base a su extensión o localización (subtotales, marginales, centrales) como a su tiempo de evolución (5). El tratamiento de las perforaciones timpánicas puede variar en función de su tamaño, tipo y localización, incluyendo desde medidas expectantes como la vigilancia estrecha hasta la realización de intervenciones quirúrgicas con la posibilidad de aplicar o no injertos de distinta naturaleza como es la timpanoplastia (6).
Figura 2. Perforación crónica subtotal (izquierda) y perforación aguda traumática (derecha). Elaboración propia.
A pesar de los avances en el tratamiento de las perforaciones timpánicas, existen desafíos y limitaciones asociados con las opciones terapéuticas actuales. La reparación quirúrgica puede estar sujeta a complicaciones como recidivas, retraso en la cicatrización o daño a estructuras adyacentes (7). En este sentido, las terapias avanzadas y la ingeniería tisular han emergido postulándose como una posible alternativa para el tratamiento de estas. El potencial de estas terapias se basa en la utilización combinada de biomateriales y/o células para promover la regeneración del tejido dañado de forma controlada y eficaz. Su potencial para el cierre de perforaciones timpánicas ya ha sido señalado y analizado en la literatura científica actual, postulándose como uno de los campos más prometedores dentro de la otorrinolaringología e ingeniería tisular, con una alta expectativa de poder lograr su traslado futuro a la práctica clínica habitual (6,8).
Por tanto, el objetivo del presente trabajo es realizar a través de una revisión de la literatura, una evaluación del estado actual de las distintas terapias avanzadas que se hayan empleado para el abordaje y tratamiento de las perforaciones timpánicas en modelos in vivo.
materiales y métodos
Para llevar a cabo la presente revisión, se siguieron las normas PRISMA (9). En primer lugar, se efectuó una búsqueda bibliográfica en diferentes bases de datos (PubMed, Scopus, Medline) sobre estudios que relacionasen el tratamiento de las perforaciones timpánicas aplicadas a modelos in vivo con medios o productos pertenecientes a la ingeniería tisular y/o terapias avanzadas. Para ello se emplearon los siguientes términos de búsqueda: (eardrum OR tympanic ) AND perforation AND “tissue engineering” AND “in vivo”. La búsqueda se realizó en agosto del 2024, incluyendo todos los trabajos sin ningún filtro temporal. Las diferentes estrategias de búsquedas empleadas en cada una de las bases de datos pueden consultarse en el siguiente enlace: https://sway.cloud.microsoft/HC3Gl95vTMF6Af4d?ref=Link.
Los criterios seguidos para la inclusión de estudios en este trabajo fueron: i) artículos originales de experimentación en los que se empleasen compuestos pertenecientes a la ingeniería tisular y/o terapias avanzadas para el cierre de perforaciones timpánicas, ii) que los compuestos hubiesen sido testados en estudios in vivo iii) que se evaluase en los artículos con alguna variable la eficacia y/o capacidad de cierre de la perforación timpánica iv) artículos escritos en el idioma inglés.
Los criterios seguidos para la exclusión de estudios fueron no cumplir alguna de las premisas señaladas en el apartado anterior, correspondientes a los criterios de inclusión.
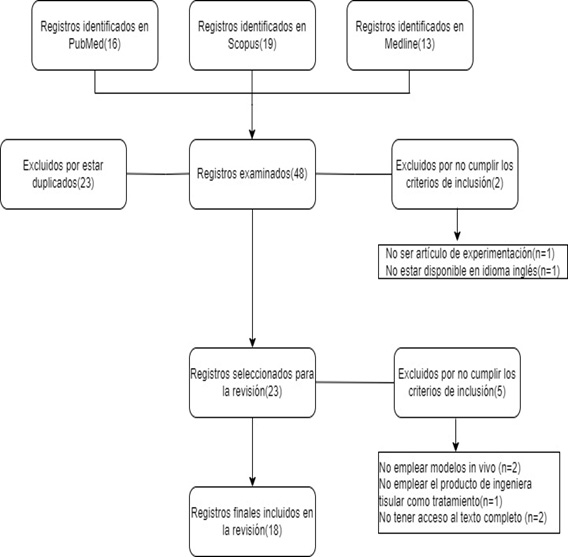
Una vez realizada esta primera búsqueda, se obtuvieron 48 registros, quedando finalmente seleccionados, tras ser filtrados por título y resumen, tras excluir registros duplicados, así como dos estudios adicionales que no cumplieron alguno de los criterios de inclusión (uno de ellos era una revisión y no un artículo de experimentación mientras que el otro no fue capaz de ser encontrado en idioma inglés) un total de 23 registros. Finalmente, de estos 23 registros finales tuvieron que eliminarse, tras realizar una búsqueda por título y resumen, cinco de los mismos por no cumplir adicionalmente alguno de los criterios de inclusión (dos de ellos no empleaban estrictamente modelos in vivo, otro de ellos no empleaba el producto de ingeniera tisular como tratamiento para la perforación en sí mientras que en dos de ellos no pudo disponerse de acceso al texto completo). Todo el proceso de búsqueda y selección fue realizado por dos operadores de forma independiente y ciega. En caso de desacuerdo, intervino un tercer operador para decidir si el registro debía ser incluido o rechazado.
El resultado de los registros analizados queda recogido en el diagrama de flujo de la revisión (Figura 3).
Figura 3. Diagrama de flujo de la revisión sistemática
Para el análisis y estudio de los registros seleccionados se extrajeron de forma sistemática en cada uno de los registros incluidos las siguientes variables: tipo de perforación, especie animal y número de la misma, el/ los productos de ingeniería tisular o terapias avanzadas empleados para la restauración de la perforación timpánica, el tipo y cantidad de especies celulares (si las hubo), la presencia o no de factores de crecimiento (si habían sido empleados con el fin de ayudar al cierre de la perforación o habían formado parte del biomaterial a estudio), así como un apartado de resultados en el que se trató de sintetizar de forma homogénea los hallazgos más relevantes obtenidos de la parte in vivo de cada estudio, desde una perspectiva centrada primordialmente en la funcionalidad de la membrana timpánica de forma que ello permitiese la comparación y traslación de los mismos, a una posible interpretación más cercana a la clínica.
A su vez, se aplicaron los criterios ARRIVE (versión 2.0) como método para evaluar de manera indirecta la calidad metodológica de ensayos realizados con animales in vivo. Esta evaluación se efectuó en todos los artículos incluidos en la presente revisión a excepción de uno ellos, que, al emplear humanos, no era apto para ser estudiado con los mismos (10,11).
resultados
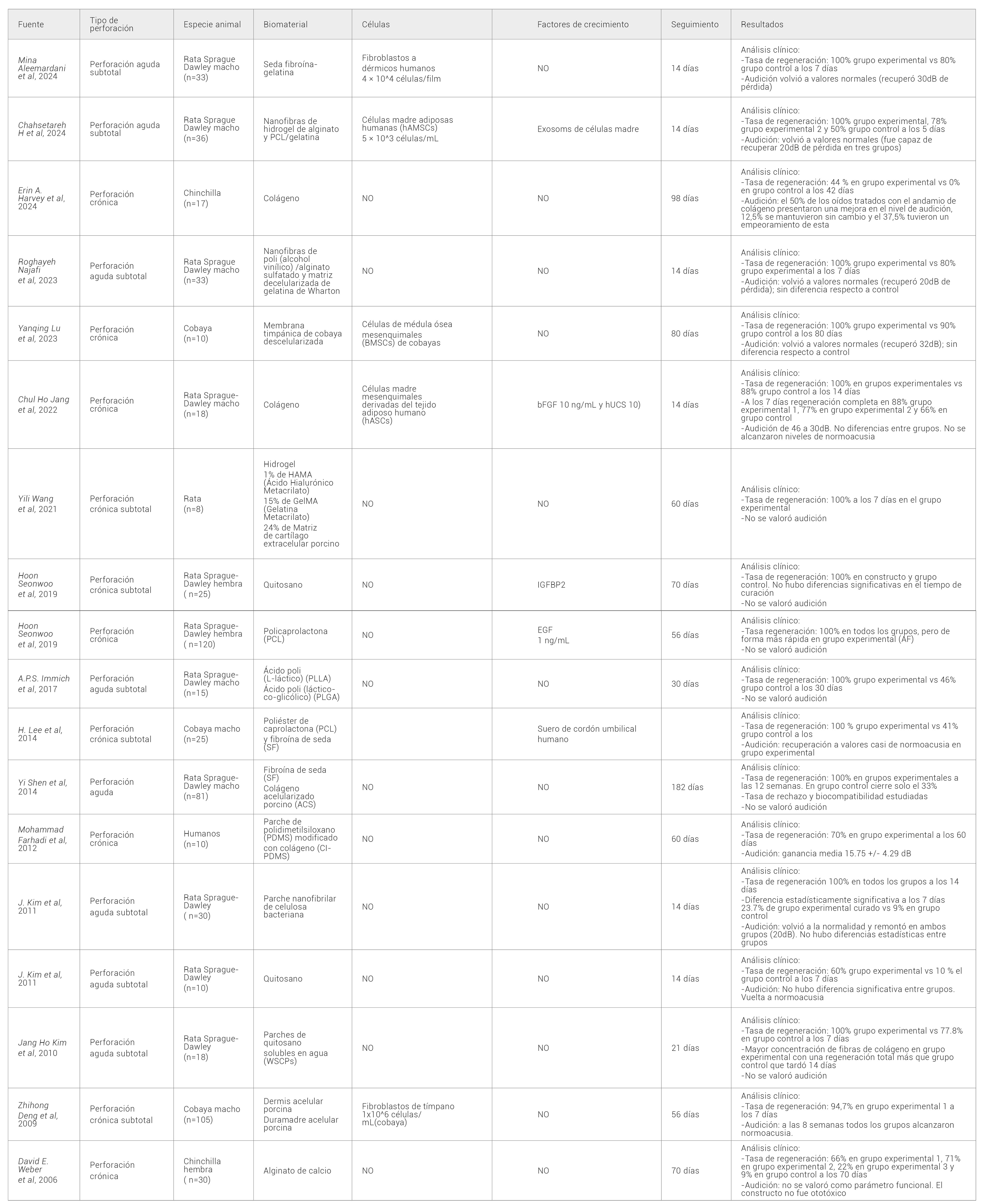
En la presente revisión sistemática se han incluido un total de 18 trabajos de investigación, que han sido sometidos a una extracción y síntesis sistemática de las diferentes variables anteriormente descritas. El resumen de dicha evaluación puede consultarse en la Tabla 1.
Tabla 1.
Desde el punto de vista del tipo de perforación, entre los registros analizados se empleó el modelo de perforación timpánica aguda en 8/18 registros frente a 10/18 registros en los que se usó un modelo de perforación timpánica crónica, siendo estos dos los tipos de perforación timpánica más frecuentemente estudiados.
Respecto al uso de biomateriales de naturaleza celular los resultados arrojan que, en 5/18 registros analizados se emplearon células destacando el uso repetido de poblaciones celulares de fibroblastos y células provenientes del tejido adiposo (12,13,14,15). Esta aparente homogeneidad en cuanto a los tipos celulares empleados no se observó en los factores de crecimiento, ya que, salvo el suero de cordón umbilical que fue empleado en dos estudios (14,16) los restantes tres artículos, que contaron con factores de crecimiento, emplearon compuestos de diferente naturaleza, con lo que es difícil poder esclarecer cuál de ellos tuvo un impacto mayor a la hora de desarrollar el constructo en el que se aplicó. Por último, cabe destacar el uso conjunto combinado de poblaciones celulares y factores de crecimiento en dos de los estudios analizados (12,14).
Por otra parte, entre los registros que emplearon biomateriales de naturaleza exclusivamente acelular destaca, por su uso repetido, el empleo de colágeno en 4/18 estudios, así como el quitosano y la fibroína de seda, con una participación en ambos casos en 3/18 estudios analizados. También se observó el uso combinado de dos de estos biomateriales, colágeno y fibroína de seda, en uno de los estudios analizados (17). Dentro de estos compuestos el quitosano pareció obtener los resultados más llamativos logrando acelerar la curación hasta la mitad de tiempo respecto a sus controles como refleja el estudio de Kim J et al en 2011. En general, aunque no ha sido el propósito de esta revisión, destaca el hecho de que el empleo de algunos materiales logró, independientemente de la naturaleza de su constructo, generar un neotímpano con características estructurales más similares al tímpano nativo, al obtener, tanto una mayor cantidad de fibras de colágeno como una estratificación y orden mejor de las mismas (17,18).
En relación con el modelo animal, en todos los trabajos que generaron una perforación timpánica para su posterior regeneración se emplearon roedores. Dentro de estos roedores, el modelo animal más empleado fue la rata, siendo la especie Sprague-Dawley empleada en 11/18 estudios. Además de la rata, que fue empleado de forma adicional en otro estudio sin que se mencionase su especie (19), destaca el uso de la cobaya en 3/18 artículos analizados, seguido de la chinchilla, que se empleó en 2/18. Por otro lado, también cabe mencionar la presencia de un artículo cuya especie de estudio fue el humano (10).
Respecto a los resultados obtenidos, dado que el objeto de la presente revisión fue buscar parámetros que se centrasen de forma predominante en la funcionalidad, se escogieron la valoración de la audición y la tasa de regeneración timpánica como indicadores del posible fracaso o éxito de los biomateriales o constructos implantados para el cierre de los distintos tipos de perforaciones. Los resultados reflejan, que, todos los artículos incluidos en la revisión, a excepción de un estudio llevado a cabo por Farhadi M en 2012, lograron tasas de regeneración totales con una tasa de cierre del 100% con los distintos constructos empleados. Además, los resultados reflejan que este cierre se produjo, generalmente, de forma más acelerada en aquellas perforaciones que fueron tratados con productos de terapias avanzadas con respecto a las perforaciones no tratadas, independientemente de la naturaleza del constructo utilizado. De hecho, en aquellos casos en los que se utilizaron constructos celularizados, la tasa de cierre completa fue más precoz (12). Por su parte la audición demostró, en los casos en los que fue valorada, obtener tasas de recuperación a niveles sanos en la mayoría de estudio alcanzado niveles de normalidad auditiva completa en más del 70% de los casos.
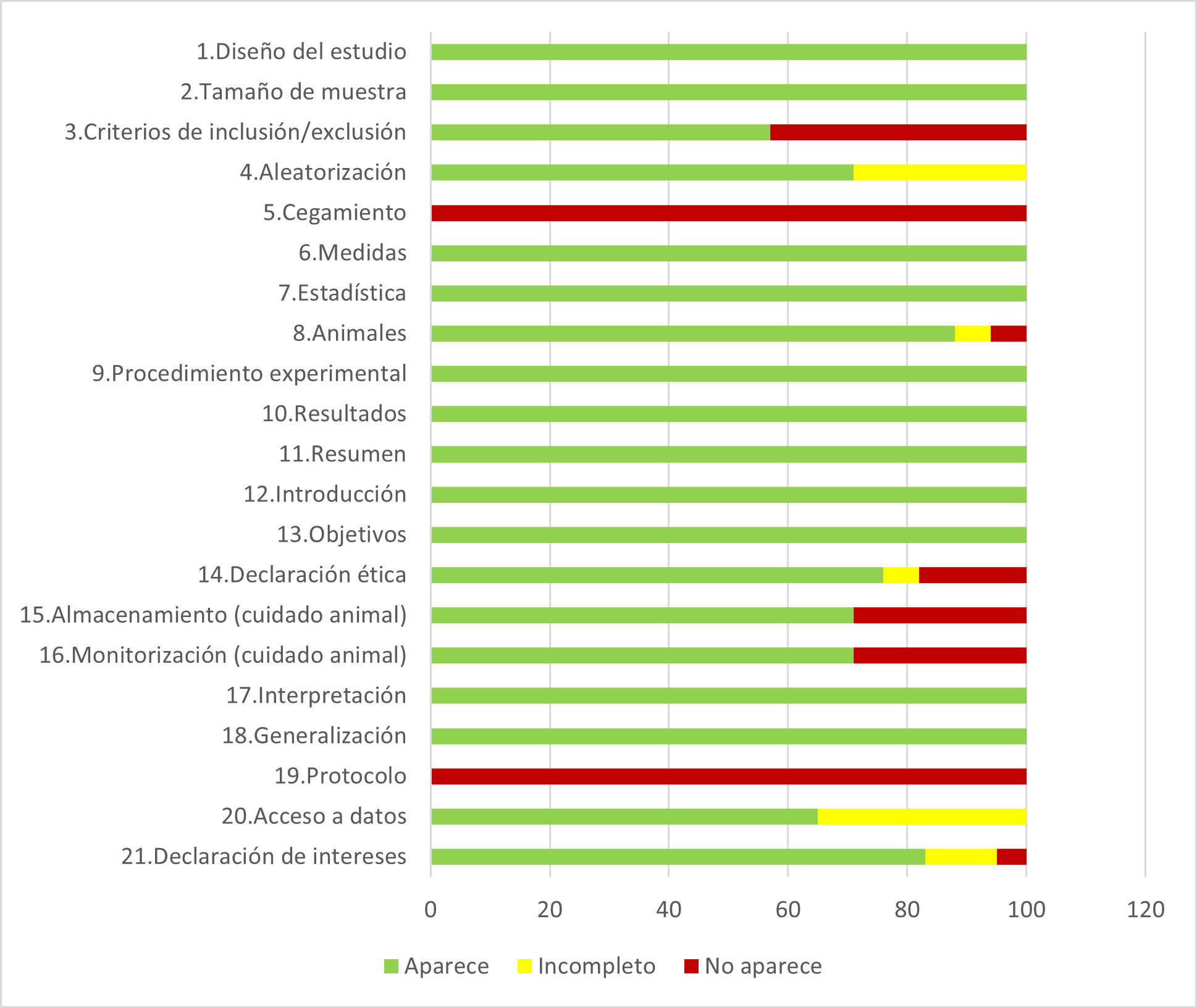
En relación con la evaluación del riesgo de sesgo después de aplicar las normas ARRIVE 2.0, los resultados se muestran en la Figura 4.
Figura 4. Resumen de la aplicación de los Criterios ARRIVE (versión 2.0) con los estudios incluidos en la revisión
Discusión
La otorrinolaringología, al igual que muchas otras especialidades médico-quirúrgicas, se está viendo beneficiada por el auge y el desarrollo de las terapias avanzadas y, de forma concreta, por la ingeniería tisular. El desarrollo de tejidos artificiales constituye una potencial estrategia terapéutica novedosa que puede abrir la puerta a un tratamiento optimizado de muchas patologías otorrinolaringológicas. En este sentido, estudios previos realizados en el Departamento de Histología de la Universidad de Granada, han estudiado previamente el papel de la ingeniería tisular otorrinolaringológica, estableciendo que el tratamiento de la perforación timpánica o de la microtia son dos de las áreas donde más se ha investigado y, por tanto, donde merece la pena hacer un esfuerzo mayor que permita conseguir la adecuada traslación clínica que permita, en última instancia, la mejora del tratamiento actual de estas patologías mediante Medicina Regenerativa (8). Por lo tanto, el presente trabajo se ha centrado en llevar a cabo una revisión de la literatura científica disponible en relación con el uso de estrategias que empleen la ingeniería tisular y terapias avanzadas como tratamiento para las perforaciones timpánicas.
A la hora de analizar el papel de la ingeniería tisular y las terapias avanzadas como tratamiento para las perforaciones timpánicas, cabe destacar que existen multitud de factores, desde su propia localización en la membrana hasta la extensión de la misma. Estas variables tienen en sí un impacto notable y determinan desde que el cierre de estas se produzca en un plazo de tiempo mayor o menor hasta la efectividad con lo que pueda lograrse la curación del defecto (20). Comenzando por el tipo de perforación, el modelo subtotal, que es probablemente el que tendría mayor impacto de poder ser regenerado en la clínica, se usó en 7/8 registros con perforación aguda frente a 4/10 que emplearon la perforación crónica. Este defecto, que comprende una superficie mayor al 40-50% de extensión del tímpano, dificulta de forma habitual el cierre espontáneo de la membrana, requiriendo en gran cantidad de casos del uso de injertos que actúen como soporte para conseguir su regeneración total (21).
Respecto al modelo in vivo, el hecho de que en 11 de las 18 revisiones se emplease la rata Sprague-Dawley como especie animal no es extraño, ya que su facilidad de manejo y cuidados hacen que su uso como animal de experimentación sea muy habitual (22). No obstante, debe señalarse que, en varios de los registros incluidos, las condiciones de almacenamiento y cuidado de los distintos tipos de animales no aparecían correctamente detalladas, siendo estos algunas de las debilidades metodológicas detectadas en la mayoría de los trabajos. Además de esto, alguno de los estudios incluía tamaños de muestra que podrían considerarse pequeños (19,23) probablemente debido a las recomendaciones de limitación en el uso de animales de experimentación. Esto podría haber dado lugar tanto a algunos sesgos de información como puede ser la sobreestimación de alguno de los resultados obtenidos. La ausencia de protocolos previamente publicados o la utilización de técnicas de ciego para la evaluación de los grupos experimentales son otras de las debilidades metodológicas que se detectaron en el conjunto de documentos evaluados. Ante esto, quizá deba señalarse la necesidad de que futuros experimentos empleen técnicas de cegamiento para la comparación de los diferentes grupos analizados, incluidos los grupos control. A pesar de esto, en términos generales, la evaluación del riesgo de sesgo reveló que los artículos revisados tenían una calidad metodológica aceptable, ya que en 13 de los 21 ítems evaluados se observó un cumplimiento parcial o total de los mismos.
A la hora de analizar de nuevo las perforaciones subtotales tanto agudas (PAS) como crónicas (PCS), destaca el hecho de que, ambas, obtuvieron resultados satisfactorios con una tasa de cierre del cien por cien en todos los casos. No obstante, la realidad es, que existen diferencias, comenzando por el modelo animal escogido para el caso de las PAS, donde se empleó rata Sprague-Dawley en todos los casos, frente a los modelos de PCS, que contaron hasta en la mitad de los casos con la cobaya como modelo animal (15, 16).
Estas diferencias se extienden también al tiempo de seguimiento donde los estudios que recogieron PAS alcanzaron un máximo de 30 días (18) frente a aquellos que emplearon PCS, donde el seguimiento llegó a los 70 días (24). La realidad es, que, de forma general, los tiempos de seguimiento fueron siempre inferiores si el modelo de perforación era agudo frente a crónico, con la excepción de un artículo que, a pesar de basarse en perforaciones agudas, reportó un tiempo de seguimiento superior a seis meses (19). Estas diferencias pueden deberse, entre otras causas, a qué, como ya han indicado algunos estudios la tasa de cierre espontánea de las perforaciones agudas suele producirse, en la gran mayoría de los casos, en un tiempo inferior a tres semanas (1). Este límite coincide, a excepción del estudio llevado a cabo por Immich APS et al en 2017, con el tiempo máximo de seguimiento de los estudios que trataron PAS por lo que esta podría ser quizá una de las causas por las que no se planificaron seguimientos mayores para estos casos.
Respecto a esto último, algunos estudios señalan que un tiempo de seguimiento inferior a 8 semanas puede resultar insuficiente, ya que genera pérdidas de información que dificultan la posibilidad de objetivar y recoger fenómenos como la aparición de una reacción a cuerpo extraño que, podría actuar como reflejo directo de una posible tasa de rechazo (25). En el caso concreto de esta revisión la mitad de los artículos incluidos (9/18) no alcanzaron el plazo seguimiento mencionado de 8 semanas, por lo que pudieron verse afectados por este hecho. Por consiguiente la evaluación de características relevantes como la biocompatibilidad de los distintos constructos que estuviesen aplicándose podría estar comprometida debido a una falta de seguimiento con lo que quizá deba ampliarse en futuras investigaciones sobre todo si pretenden valorarse parámetros que permitan ver no tanto si logra regenerarse el defecto sino como es capaz de integrarse un constructo determinado en el tejido de implantación, algo que acaba por determinar en muchas ocasiones el fracaso o éxito del tratamiento.
Esta franja de 8 semanas se emplea también de forma habitual como límite en clínica, dado que la presencia de cualquier defecto en la membrana pasado este tiempo suele implicar una falta de capacidad del organismo para regenerarlo.
Quizá esta diferencia entre modelos pueda deberse también a qué en una perforación aguda los sistemas de replicación del propio tejido se encuentran más activos al tener un estímulo súbito cuando se produce la lesión, con lo qué, cabe esperar que su capacidad de regeneración sea mayor y, por ende, más corta. Esto último quizá implique que las perforaciones crónicas sirven mejor como modelo para corroborar distintos tratamientos pues sus características propias implican que el fracaso o éxito en su cierre dependa predominantemente del constructo aplicado, pues los mecanismos inherentes de reparación del propio tejido han demostrado ser insuficientes de por sí.
A la hora de hablar sobre la naturaleza de los constructos, los resultados avalan que el injerto de naturaleza celular que obtuvo mejores resultados para PAS fue aquel que combinó células madre adiposas con exosomas como componentes para un andamio hecho a base de alginato y PCL. Quizá parte de este éxito se deba al empleo de células de extirpe mesenquimal pues sus tasas tanto de replicación como de regeneración son altas por lo que pueden ser óptimos para tratar pérdidas de masa celular como son las perforaciones timpánicas (26). Estos resultados concuerdan con estudios recientes que han utilizado células madre adiposas con moléculas secretadas por las mismas (secretoma), para optimizar la curación de heridas cutáneas en un modelo animal de roedores (27). Esto refleja la importancia de elegir sistemas de señalización adecuados que permitan una mayor y mejor actividad metabólica del constructo de forma que así pueda obtenerse una regeneración precoz y más completa de los tejidos dañados. En lo que respecta a PCS los resultados más completos y sólidos son aquellos que se obtuvieron mediante la creación de un constructo que combinó dermis y duramadre acelular porcina junto con fibroblastos (15).
Por otra parte, respecto a la tasa de regeneración timpánica los resultados reflejan que la aplicación de los distintos compuestos permitió, sin destacar preferencia por el tipo de perforación o biomaterial, regenerar de forma completa el 100% de las distintas perforaciones, a excepción del estudio llevaba a cabo por Farhadi M et al en 2012, que obtuvo una tasa de éxito del 70%. Estos resultados quizá estuviesen en parte motivados por que hubo una tasa de complicaciones ajenas al injerto en hasta el 20% de los casos. Sin embargo, más importante que la tasa de regeneración al final del estudio, quizá sea analizar el tiempo que se tarda en alcanzar dicha regeneración. En este sentido, los tiempos de regeneración se vieron acelerados en las perforaciones timpánicas que fueron tratadas mediante ingeniería tisular, llegando a reducir los tiempos de curación incluso a la mitad, en comparación con los distintos controles de cada estudio. Si bien es cierto que en muchos casos los controles lograban también tasas de regeneración cercanas al 100%, pero en la mayoría de los casos requerían de un tiempo superior para lograrlo (28,29,30,31). Estos resultados suponen una evidencia a la hipótesis de que las terapias avanzadas y, particularmente la ingeniería de tejidos, son una alternativa real en la optimización de los tratamientos clínicos actuales.
Más allá de la recuperación del tejido dañado o parcialmente perdido, es muy importante que dichos tejidos nuevos sean funcionales. Por ello, las variables funcionales también han sido incluidas en este trabajo. En relación con la audición, debe señalarse que fue evaluada mediante pruebas complementarias objetivas en 12/18 artículos, si bien en uno de ellos el estudio de la audición solo pretendía valorar la posible ototoxicidad del compuesto implantado y no la audición en sí misma (32). Los datos reflejan que en la mayoría de estos estudios se obtuvo una mejora funcional de la lesión, al reportarse recuperaciones medias de la audición en torno a 20dB, logrando una vuelta a la normalidad auditiva en todos los casos excepto en algunos estudios en los que, si bien se consiguieron mejoras, no se logró una recuperación completa de la misma (14,16). Sin embargo, también se observó algún estudio con resultados muy heterogéneos, que no permiten asegurar que el constructo en cuestión tuviera un impacto positivo sobre la audición (29). Es importante destacar que, si bien esto es un campo prometedor para la mejora de calidad de los tratamientos clínicamente disponibles, aún es un área de investigación en desarrollo. Precisamente por ello, este tipo de trabajo permite relucir las características de los estudios, sus fortalezas, debilidades y cuáles deberían ser las pautas por seguir en el diseño de los futuros estudios de investigación.
En resumen, aunque los resultados parecen avalar que el empleo de productos de ingeniería tisular permite acelerar el cierre de distintos modelos y tipos de perforaciones in vivo, especialmente en aquellos casos en los que dichos productos están celularizados. Como debilidad se puede destacar que aún existen pocos estudios y que son muchas las variables que dificultan homogeneizar los resultados para poder obtener conclusiones rigurosas. Quizá una de las claves que facilitaría este proceso sería lograr crear un modelo de perforación timpánica estándar que sirviera como base para futuros ensayos (33).
CONCLUSIONES
Las perforaciones timpánicas suponen una patología con una alta incidencia y prevalencia dentro del campo de la otorrinolaringología. A pesar de que existen multitud de opciones terapéuticas para poder abordarlas, muchas de estas terapias no logran devolver la funcionalidad íntegra al tejido, por no hablar de que no están exentas de presentar complicaciones.
Por otra parte, la ingeniería tisular y las terapias avanzadas han irrumpido de un tiempo a esta parte, demostrando un amplio potencial tanto a nivel médico como investigador. En el caso concreto de las perforaciones timpánicas, se postulan como una posible herramienta que añadir al arsenal terapéutico, al haber demostrado, como se ha analizado en este trabajo en el caso concreto de modelos in vivo, obtener no solo un cierre completo de las perforaciones en la mayoría de los casos, sino sobre todo lograr que este se produjese de forma más rápida, obteniendo una recuperación de la audición a valores normales en la mayoría de los estudios que analizaron dicho parámetro.
No obstante, no debemos olvidar que aún existen desafíos y limitaciones asociados a estas terapias. La variabilidad en los modelos animales y tipos de perforaciones unida a la complejidad de los procedimientos y la ausencia de estudios clínicos a largo plazo son algunos de los obstáculos que aún deben superarse. Además, tanto la biocompatibilidad como la integración a largo plazo de los biomateriales siguen siendo áreas de investigación en desarrollo con múltiples lagunas, por lo que, si bien los resultados parecen prometedores, debe seguir ahondándose en este campo con el fin de avanzar y obtener hallazgos que permitan aplicar estas terapias para resolver problemas de la práctica clínica habitual, como son las perforaciones timpánicas.
referencias bibliográficas
- ↑Dolhi N, Weimer AD. Perforación de la membrana timpánica. [Actualizado el 14 de agosto de 2023]. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Ene-.
- ↑Szymanski A, Toth J, Ogorevc M, et al. Anatomy, Head and Neck, Ear Tympanic Membrane. [Updated 2023 May 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-
- ↑Azimi B, Milazzo M, Danti S. Cellulose-Based Fibrous Materials From Bacteria to Repair Tympanic Membrane Perforations. Front Bioeng Biotechnol. 2021 Jun 7; 9:669863. doi: 10.3389/fbioe.2021.669863. PMID: 34164386;
- ↑Ding, Yanyan & Liu, Qin & Chen, Jinwu & Cai, Hua & Qiu, Yue & Li, Ming & Xie, Le & Zhao, Zhenyu & Xiao, Ying. (2024). Advancements in bioprinting for the treatment of hearing loss: A review. International Journal of Bioprinting. 10.36922/ijb.3497.
- ↑Castelhano L, Correia F, Colaço T, Reis L, Escada P. Tympanic membrane perforations: the importance of etiology, size and location. Eur Arch Otorhinolaryngol. 2022 Sep;279(9):4325-4333. doi: 10.1007/s00405-021-07186-6. Epub 2022 Jan 14. PMID: 35028696.
- ↑Sainsbury E, Amaral RD, Blayney AW, Walsh RM, O’Brien FJ, O’Leary C. Tissue engineering and regenerative medicine strategies for the repair of tympanic membrane perforations. Biomater Biosyst. 2022 Mar 28; 6:100046. doi: 10.1016/j.bbiosy.2022.100046. PMID: 36824158;
- ↑Xue H, Chen S, Hu Y, Huang J, Shen Y. Advances in 3D printing for the repair of tympanic membrane perforation: a comprehensive review. Front Bioeng Biotechnol. 2024 Aug 12; 12:1439499. doi: 10.3389/fbioe.2024.1439499. PMID: 39188376.
- ↑Padilla-Cabello J, Martin-Piedra MA, Santisteban-Espejo A, Moral-Munoz JA. Tissue engineering in otorhinolaryngology: A knowledge-based analysis. Laryngoscope Investig Otolaryngol. 2023 Dec 19;9(1):e1182. doi: 10.1002/lio2.1182. PMID: 38362196.
- ↑Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, Shamseer L, Tetzlaff JM, Akl EA, Brennan SE, Chou R, Glanville J, Grimshaw JM, Hróbjartsson A, Lalu MM, Li T, Loder EW, Mayo-Wilson E, McDonald S, McGuinness LA, Stewart LA, Thomas J, Tricco AC, Welch VA, Whiting P, Moher D. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021 Mar 29;372: n71. doi: 10.1136/bmj. n71. PMID: 33782057.
- ↑Farhadi M, Mirzadeh H, Solouk A, Asghari A, Jalessi M, Ghanbari H, et al. Collagen-immobilized patch for repairing small tympanic membrane perforations: in vitro and in vivo assays. J Biomed Mater Res A. 2012;100(3):549-53.
- ↑Percie du Sert N, Ahluwalia A, Alam S, Avey MT, Baker M, et al. (2020) Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology 18(7): e3000411. https://doi.org/10.1371/journal.pbio.3000411
- ↑Chahsetareh H, Yazdian F, Pezeshki-Modaress M, Aleemardani M, Hassanzadeh S, Najafi R, et al. Alginate hydrogel-PCL/gelatin nanofibers composite scaffold containing mesenchymal stem cells-derived exosomes sustain release for regeneration of tympanic membrane perforation. International Journal of Biological Macromolecules. 2024;262.
- ↑Aleemardani M, Akbarnejad Z, Jalessi M, Chahsetareh H, Hajmohammadi Z, Hassanzadeh S, et al. Silk fibroin-gelatin films crosslinked by genipin for regenerating tympanic membrane perforations. Journal of Drug Delivery Science and Technology. 2024;95.
- ↑Jang CH, Kim W, Moon C, Kim G. Bioprinted Collagen-Based Cell-Laden Scaffold With Growth Factors for Tympanic Membrane Regeneration in Chronic Perforation Model. IEEE Transactions on Nanobioscience. 2022;21(3):370-9.
- ↑Deng Z, Wu J, Qiu J, Wang J, Tian Y, Li Y, et al. Comparison of porcine acellular dermis and dura mater as natural scaffolds for bioengineering tympanic membranes. Tissue Eng Part A. 2009;15(12):3729-39.
- ↑Lee H, Jang CH, Kim GH. A polycaprolactone/silk-fibroin nanofibrous composite combined with human umbilical cord serum for subacute tympanic membrane perforation; an-in vitro and in vivo study. J Mater Chem B. 2014;2(18):2703-13.
- ↑Shen Y, Redmond SL, Papadimitriou JM, Teh BM, Yan S, Wang Y, et al. The biocompatibility of silk fibroin and acellular collagen scaffolds for tissue engineering in the ear. Biomed Mater. 2014;9(1):015015.
- ↑Immich APS, Pennacchi PC, Naves AF, Felisbino SL, Boemo RL, Maria-Engler SS, et al. Improved tympanic membrane regeneration after myringoplastic surgery using an artificial biograft. Mater Sci Eng C Mater Biol Appl. 2017; 73:48-58.
- ↑Wang Y, Wen F, Yao X, Zeng L, Wu J, He Q, et al. Hybrid Hydrogel Composed of Hyaluronic Acid, Gelatin, and Extracellular Cartilage Matrix for Perforated TM Repair. Front Bioeng Biotechnol. 2021; 9:811652.
- ↑Illés K, Gergő D, Keresztély Z, Dembrovszky F, Fehérvári P, Bánvölgyi A, Csupor D, Hegyi P, Horváth T. Factors influencing successful reconstruction of tympanic membrane perforations: a systematic review and meta-analysis. Eur Arch Otorhinolaryngol. 2023 Jun;280(6):2639-2652. doi: 10.1007/s00405-023-07831-2. Epub 2023 Feb 22. PMID: 36811654.
- ↑Arora RD, Thakur N, Kamble P, Jati M, Nagarkar NM, Thakur JS. Circumferential subannular tympanoplasty: surgical and hearing outcome in 224 ears with subtotal perforation. Acta Otolaryngol. 2022 Mar-Apr;142(3-4):254-258. doi: 10.1080/00016489.2022.2042596. Epub 2022 Mar 2. PMID: 35235490. 22
- ↑Gileta AF, Fitzpatrick CJ, Chitre AS, St Pierre CL, Joyce EV, Maguire RJ, McLeod AM, Gonzales NM, Williams AE, Morrow JD, Robinson TE, Flagel SB, Palmer AA. Genetic characterization of outbred Sprague Dawley rats and utility for genome-wide association studies. PLoS Genet. 2022 May 31;18(5):e1010234. doi: 10.1371/journal.pgen.1010234. PMID: 35639796.
- ↑Lu Y, Li J, Hou N, Zhou L, Quan X, Tang Y, et al. Decellularized tympanic membrane scaffold with bone marrow mesenchymal stem cells for repairing tympanic membrane perforation. Artif Organs. 2023;47(1):62-76.
- ↑Seonwoo H, Kim SW, Shin B, Jang KJ, Lee M, Choo OS, et al. Latent stem cell-stimulating therapy for regeneration of chronic tympanic membrane perforations using IGFBP2-releasing chitosan patch scaffolds. Journal of Biomaterials Applications. 2019;34(2):198-207.
- ↑Ghanad I, Polanik MD, Trakimas DR, Knoll RM, Castillo-Bustamante M, Black NL, Kozin ED, Remenschneider AK. A Systematic Review of Nonautologous Graft Materials Used in Human Tympanoplasty. Laryngoscope. 2021 Feb;131(2):392-400. doi: 10.1002/lary.28914. Epub 2020 Jul 27. PMID: 33176008.
- ↑Widowati W, Noverina R, Ayuningtyas W, Kurniawan D, Kusuma HSW, Arumwardana S, Artie DS, Sholihah IA, Handayani RAS, Laksmitawati DR, Rinendyaputri R, Rilianawati R, Faried A. Proliferation, Characterization and Differentiation Potency of Adipose Tissue-Derived Mesenchymal Stem Cells (AT-MSCs) Cultured in Fresh Frozen and non-Fresh Frozen Plasma. Int J Mol Cell Med. 2019 Fall;8(4):283-294. doi: 10.22088/IJMCM.BUMS.8.4.283. PMID: 32587838.
- ↑Cases-Perera O, Blanco-Elices C, Chato-Astrain J, Miranda-Fernández C, Campos F, Crespo PV, Sánchez-Montesinos I, Alaminos M, Martín-Piedra MA, Garzón I. Development of secretome-based strategies to improve cell culture protocols in tissue engineering. Sci Rep. 2022 Jun 15;12(1):10003. doi: 10.1038/s41598-022-14115-y. PMID: 35705659.
- ↑Najafi R, Yazdian F, Pezeshki-Modaress M, Aleemardani M, Chahsetareh H, Hassanzadeh S, et al. Fabrication and optimization of multilayered composite scaffold made of sulfated alginate-based nanofiber/decellularized Wharton’s jelly ECM for tympanic membrane tissue engineering. Int J Biol Macromol. 2023;253(Pt 6):127128.
- ↑Harvey EA, Hong W, Sheehy EJ, do Amaral RJ, Khampang P, Runge CL, et al. Chronic tympanic membrane perforation repair with a collagen-based scaffold: An in vivo model. Int J Pediatr Otorhinolaryngol. 2024; 176:111807.
- ↑Kim J, Kim SW, Choi SJ, Lim KT, Lee JB, Seonwoo H, et al. A healing method of tympanic membrane perforations using three-dimensional porous chitosan scaffolds. Tissue Eng Part A. 2011;17(21-22):2763-72.
- ↑Kim J, Kim SW, Park S, Lim KT, Seonwoo H, Kim Y, et al. Bacterial cellulose nanofibrillar patch as a wound healing platform of tympanic membrane perforation. Adv Healthc Mater. 2013;2(11):1525-31.
- ↑Weber DE, Semaan MT, Wasman JK, Beane R, Bonassar LJ, Megerian CA. Tissue-engineered calcium alginate patches in the repair of chronic chinchilla tympanic membrane perforations. Laryngoscope. 2006;116(5):700-4.
- ↑Zahid Hussain and Renjun Pei 2021 Biomed. Mater. 16 032004DOI 10.1088/1748-605X/abcf5d
- Kim JH, Choi SJ, Park JS, Lim KT, Choung PH, Kim SW, et al. Tympanic membrane regeneration using a water-soluble chitosan patch. Tissue Eng Part A. 2010;16(1):225-32.
- Seonwoo H, Shin B, Jang KJ, Lee M, Choo OS, Park SB, et al. Epidermal Growth Factor-Releasing Radially Aligned Electrospun Nanofibrous Patches for the Regeneration of Chronic Tympanic Membrane Perforations. Adv Healthc Mater. 2019;8(2):e1801160.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Francisco Díaz Rodríguez. Av del Conocimiento s/n 18007. Email: frandiaro@gmail.com