Revisión
Estado actual de las resistencias a carbapenemes: consideraciones clínicas y terapéuticas
Current status of resistance to carbapenem resistance: clinical and therapeutic considerations
Actual Med.2024;109(819):166-175 DOI: 10.15568/am.2024.820.rev01
Recibido: 08/11/2023
Revisado: 17/10/2024
Aceptado: 27/11/2024
Resumen
Los carbapenemes son antibióticos de amplio espectro utilizados contra infecciones graves. Su uso excesivo ha promovido la aparición de resistencias a los mismos en forma de carbapenemasas, que son unas enzimas capaces de hidrolizarlos. Esto representa una amenaza creciente para la salud pública ya que la prevalencia de infecciones provocadas por bacterias productoras de carbapenemasas es cada vez mayor, sobre todo, en el ámbito nosocomial. Hay que tener en cuenta que los pacientes con mayor riesgo de adquirirlas son aquellos de edad avanzada, inmunodeprimidos, con estancias hospitalarias prolongadas o uso reciente de antibióticos, entre otros. Se ha desarrollado un herramienta conocida como INCREMENT-CPE score que permite predecir la mortalidad en infecciones graves por enterobacterias productoras de carbapenemasas (CPE), lo que puede guiar decisiones terapéuticas y manejo clínico.
Es importante optimizar el tratamiento de estas infecciones que en muchas ocasiones debe ser individualizado, considerando distintas variables, entre ellas, la epidemiología local. Los antibióticos tradicionales, como por ejemplo la tigeciclina o polimixinas, a menudo se usan en combinación para mejorar la eficacia, aunque pueden aumentar la resistencias bacterianas. En los últimos años se han ido desarrollando nuevos antibióticos (como ceftazidima-avibactam o meropenem-vaborbactam) que muestran eficacia contra cepas resistentes produciendo un descenso de la mortalidad y una menor toxicidad respecto a las terapias convencionales; existiendo, sin embargo, limitaciones en su disponibilidad y alto costo. También es importante conocer que las CPE pueden colonizar diversos tejidos sin causar infección, siendo recomendable en ciertos contextos el uso de cultivos de control para identificar portadores así cómo establecer criterios de cómo tratar a estos pacientes cuando muestren datos de infección. Por último, resaltar que las medidas de prevención como el aislamiento de contacto, la higiene de manos o la vigilancia activa, son esenciales para reducir la transmisión de bacterias productoras de carbapenemasas en hospitales.
Palabras clave: Bacterias gram-negativas resistentes a carbapenemes; Carbapenemasas; Terapia dirigida; Manejo pacientes colonizados; Control de la infección.
ABSTRACT
Carbapenems are broad-spectrum antibiotics used against severe infections. Their excessive use has led to the development of resistances. Carbapenemases are enzymes capable of hydrolyzing these antibiotics. This represents a growing public health threat as the prevalence of infections caused by carbapenemase-producing bacteria is increasing, especially in hospital settings. It is important to note that patients at higher risk of acquiring these infections are typically elder people, immunocompromised individuals, those with prolonged hospital stays, or recent antibiotic use, among other factors. A tool known as the INCREMENT-CPE score has been developed to predict mortality in severe infections caused by carbapenemase-producing Enterobacteriaceae (CPE), which can help guide therapeutic decisions and clinical management. Individualized treatment of these infections is crucial, taking into account several factors, including local epidemiology. Traditional antibiotics, such as tigecycline or polymyxins, are often used in combination to improve efficacy, although they may increase bacterial resistance. In recent years, new antibiotics (such as ceftazidime-avibactam or meropenem-vaborbactam) have been developed, showing efficacy against resistant strains, reduction in mortality and lower toxicity compared to conventional therapies; however, there are limitations in their availability and high cost. It is also advisable, in certain contexts, to use screening cultures to identify carriers and establish criteria for treating these people when infection indicators appear. Finally, prevention measures such as contact isolation, hand hygiene, and active surveillance are essential to reduce the transmission of carbapenemase-producing bacteria in hospitals.
Keywords: Carbapenem-resistant gram-negative bacteria; Carbapenemases; Targeted therapy; Colonized-patients management; Infection control measures.
Leer Artículo Completo
INTRODUCCIÓN
Los carbapenemes son un grupo de antibióticos betalactámicos, muy empleados en la práctica clínica debido a su amplio espectro y, sobre todo, por su acción contra las betalactamasas de espectro extendido (BLEEs); lo que los convierte en un arma de gran utilidad frente a la gravedad de estas infecciones (entre ellas: neumonías, bacteriemias, infecciones del tracto urinario e intraabdominales donde dichos gérmenes están implicados). Así mismo se usan en el tratamiento empírico de infecciones graves. El uso abusivo de estos fármacos puede contribuir al incremento de aparición de carbapenemasas. En las últimas décadas han aparecido unas enzimas capaces de hidrolizarlos llamadas carbapenemasas, lo cual constituye una amenaza global, en materia de salud pública. Debido a su velocidad de difusión y la aparición de distintos subtipos de carbapenemasas, los antibióticos existentes que hacen frente a estos microorganismos son escasos, por lo que es necesario un mayor número de ensayos clínicos que comparen las distintas opciones terapéuticas (1,2,3)
Los bacilos gram negativos son los agentes más frecuentemente implicados en el desarrollo de carbapenemasas, entre ellos, las enterobacterias como Klebsiella pneumoniae resistente a carbapenemes (KPRC) o E.coli (1,4)
La epidemiología toma un papel relevante en el abordaje de estas infecciones ya que su distribución por subtipos varía en los diferentes lugares del mundo (1,5). Su frecuencia también varía, desde países como Italia o Grecia, donde la situación es endémica, a otros con menor prevalencia, pero con una distribución mundial.
En España la prevalencia en hospitales es alta, especialmente como infecciones nosocomiales, predominando Klebsiella spp, Citrobacter spp y Enterobacter spp. Predomina la OXA-48(71.5%) seguida por la VIM (25.3%). Se ha visto en Madrid que la colonización intestinal por OXA-48 es alta, sugiriendo un incremento en el remplazamiento de la microbiota del huésped por Klebsiella pneumoniae productora de OXA-48. Los principales factores que se asocian con este cambio son el tratamiento previo antibiótico y el desarrollo de infección. Los pacientes mayores de residencias son especialmente vulnerables a la colonización de OXA-48. Por otro lado la tasa de infecciones por carbapenemasas en España producidas por Klebsiella pneumoniae o E.coli fue de 4.01 por 10.000 admisiones, siendo la ratio entre Klesiella pneumoniae/E.Coli 9:1(6).
Así mismo es importante conocer los mecanismos de resistencia desde el punto de vista microbiológico, para ello, las carbapenemasas se dividen en distintas clases: A, B y D y estás a su vez en diferentes subtipos como, por ejemplo, OXA-48 (Oxacilinasa 48) que pertenece a la clase D y es uno de los subtipos más frecuentemente aislados en España en nuestros días (1,7). En el laboratorio se disponen de distintas pruebas para detectar la presencia de carbapenemasas e identificar de qué subtipo se trata (8)
En esta revisión bibliográfica nos centraremos en los aspectos clínicos como son: los factores de riesgo para la adquisición de carbapenemasas, el modelo INCREMENT, que es una escala de predicción de mortalidad, así como las nuevas opciones terapéuticas; el score de riesgo de Gianella que se utiliza para el manejo del paciente colonizado por microorganismos productores de carbapenemasas y las medidas de prevención recomendadas para evitar la difusión de estos microorganismos.
1. Factores de riesgo para la adquisión de carbapenemasas
En términos generales, entre los factores que predisponen a padecer una infección por un microorganismo productor de carbapenemasas o multirresistente se encuentran: la inmunosupresión, la edad avanzada, el ingreso en UCI, la ventilación mecánica, el tratamiento reciente con antibióticos, el trasplante de un órgano sólido o de células madre y la estancia hospitalaria prolongada (1,2).
Un meta-análisis encontró que el uso de dispositivos médicos y el empleo de carbapenemes (causado, entre otras razones, por el aumento de infecciones originadas por bacterias portadoras de BLEEs) fueron los factores de riesgo más significativos para la adquisición de carbapenemasas (2).
En concreto, y debido a su importante capacidad de expansión nosocomial, la mortalidad asociada a K. Pneumoniae resistente a carbapenemes (42,14%) es significativamente más elevada que la mortalidad que deriva de infecciones provocadas por K.Pneumoniae sensible a carbapenemes (21,16%). Además, la mortalidad está íntimamente relacionada con el estado de salud del paciente, siendo mayor en pacientes con bacteriemia, ingresados en la UCI o que estén trasplantados de un órgano sólido; sin embargo, la mortalidad es más reducida (13, %) en aquellos con infección del tracto urinario inferior (1,4). Según algunos estudios, uno de cada tres pacientes infectados con K.pneumoniae resistente a carbapenemes muere a pesar del tratamiento antibiótico y menos del 70% de los mismos logra una respuesta favorable del punto de vista clínico o microbiológico (9).
La expansión comunitaria es un motivo creciente de preocupación, aunque los datos sobre su prevalencia son escasos. Mientras K.Pneumoniae es más propensa a causar brotes dentro del ambiente hospitalario, E.Coli resistente a carbapenemes posee un mayor riesgo de difusión en la comunidad, a través de la cadena alimentaria a raíz alimentos de origen animal (2).
Por consiguiente, aunque una terapia antibiótica adecuada administrada de manera precoz ha demostrado mejorar la supervivencia, la severidad de la infección y las comorbilidades, tienen más peso en la tasa de mortalidad global del paciente que la propia administración de una terapia empírica adecuada; por tanto, se debe prestar especial atención al perfil de pacientes de alto riesgo a la hora de controlar la infección de manera efectiva, así como al hecho de establecer una terapia dirigida lo antes posible (1,4).
2. INCREMENT score: gravedad clínica y mortalidad
El INCREMENT-CPE score es una herramienta diseñada para predecir la mortalidad en pacientes con infecciones graves por Enterobacterias Productoras de Carbapenemasa (CPE). El objetivo del INCREMENT-CPE score es ayudar a los médicos a identificar a los pacientes con mayor riesgo de mortalidad, lo que puede guiar decisiones terapéuticas y manejo clínico.
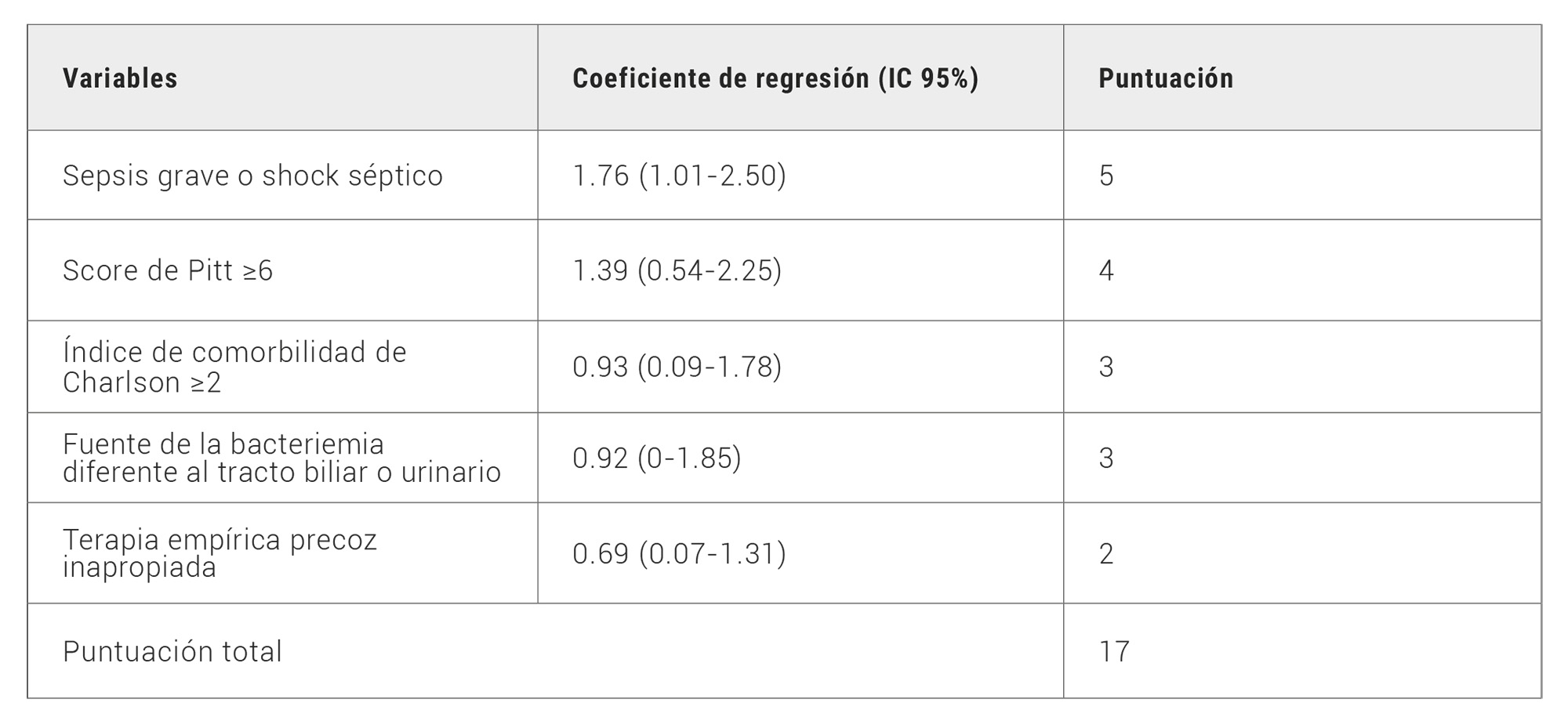
El INCREMENT-CPE score se basa en un estudio observacional multicéntrico publicado en 2017 (10), que incluyó a más de 400 pacientes con infecciones por CPE en varios países europeos. Este score tiene en cuenta varios factores clínicos como la edad del paciente, el tipo de infección (por ejemplo, bacteriemia), la gravedad de la enfermedad subyacente y el tratamiento adecuado y oportuno con antibióticos activos frente a CPE. Los factores que evalúa son: el índice de Charlson (predice la mortalidad de un paciente en base a las comorbilidades subyacentes que padezca), score de Pitt (mide la gravedad de la enfermedad aguda con un considerable valor pronóstico, frecuentemente empleada en pacientes con bacteriemias provocadas por gram-negativos multirresistentes), la presencia de shock séptico o sepsis severa, bacteriemia y terapia empírica precoz inapropiada (10) (Tabla 1).
Tabla 1. Escala de riesgo INCREMENT. Adaptado de: “A Predictive Model Of Mortality In Patients With Bloodstream Infections Due To Carbapenemase-producing Enterobacteriaceae”, por B. Gutiérrez-Gutiérrez, E. Salamanca et. al, 2016, Mayo Clin Proc ,91, p. 1362-1371.
La puntuación obtenida predice la probabilidad de mortalidad a los 14 días de infección y ha demostrado una buena capacidad predictiva en estudios validados.
En la práctica clínica, el INCREMENT-CPE score puede aplicarse de la siguiente manera:
- Identificación del riesgo: Los pacientes que puntúan alto tienen un riesgo elevado de mortalidad, lo que puede influir en decisiones sobre cuidados intensivos o terapias antimicrobianas más agresivas.
- Guía para el tratamiento antibiótico: La puntuación ayuda a los médicos a decidir si un paciente requiere una combinación de antibióticos activos o si se puede utilizar monoterapia.
- Estratificación del tratamiento: En pacientes con baja puntuación, el enfoque clínico puede ser más conservador, mientras que aquellos con puntuaciones altas pueden requerir un manejo más intensivo, incluyendo la consideración de terapias experimentales o cuidados de soporte avanzados.
Existen varios desafíos asociados con la implementación práctica del INCREMENT-CPE score:
- Variabilidad en el acceso a antibióticos: Algunos países o instituciones no tienen acceso rápido a antibióticos activos frente a CPE, como ceftazidima-avibactam o meropenem-vaborbactam, lo que puede dificultar la aplicación efectiva de este score.
- Diagnóstico microbiológico oportuno: La identificación de las cepas productoras de carbapenemasa se puede demorar, lo que puede influir negativamente en la aplicabilidad inmediata del score, ya que su valor depende del uso rápido de antibióticos activos frente al microorganismo implicado.
- Cambio en los patrones de resistencia: Los perfiles de resistencia bacteriana evolucionan constantemente. Si bien el INCREMENT-CPE score se basó en datos de un momento determinado, los cambios en la prevalencia de resistencia o la introducción de nuevos antibióticos pueden afectar su precisión predictiva en algunos contextos clínicos actuales.
- Uso limitado en ciertas poblaciones: El score fue validado principalmente en pacientes adultos hospitalizados en Europa. Por lo tanto, puede no ser aplicable de la misma manera en poblaciones pediátricas, pacientes ambulatorios o en regiones donde las infecciones por CPE tienen diferentes patrones epidemiológicos.
- Complejidad en la evaluación: Aunque el score es relativamente sencillo, requiere que se recopilen varios datos clínicos de manera oportuna, lo que, en situaciones de emergencia, como el manejo inicial de una sepsis, puede ser complicado. La sobrecarga de trabajo para el personal médico podría dificultar la aplicación sistemática del score en todos los casos.
Con respecto al tratamiento, aporta recomendaciones relevantes. En primer lugar, la importancia de un tratamiento activo precoz, dentro de los primeros 5 días de la infección, con el objetivo de reducir la mortalidad; en segundo lugar, el tratamiento combinado ha demostrado ser superior sólo en los pacientes clasificados de alto riesgo (8 a 15 puntos). Por el contrario, para pacientes con menor riesgo de mortalidad de acuerdo con esta escala (0 a 7 puntos), sería suficiente el tratamiento en monoterapia. Individualizar el tratamiento de estas infecciones permite una optimización en el uso de los antibióticos, lo que contribuye a evitar la expansión de las resistencias bacterianas, así como a disminuir los distintos efectos secundarios de estas terapias (11).
3. Tratamiento frente a gérmenes productores de carbapenemasas
El principal motivo de preocupación acerca del aumento de las infecciones producidas por organismos resistentes a carbapenemes es la escasez de tratamientos consolidados de primera línea y, en consecuencia, la necesidad de emplear a veces fármacos con alta toxicidad y farmacocinética deficiente. Es fundamental saber optimizar el uso de los antibióticos tradicionales, así como seleccionar aquellos pacientes que se puedan beneficiar del uso de los nuevos compuestos disponibles (12).
En estos pacientes el tratamiento ha de ser lo más individualizado posible, ya que en su éxito influyen distintas variables como los valores de sensibilidad a los antimicrobianos, los datos de farmacocinética y farmacodinamia (por los cuales la dosis estándar puede ser insuficiente en algunas ocasiones) y los fármacos disponibles actualmente. Además, es importante la epidemiología local a la hora de establecer un tratamiento empírico, ya que la sensibilidad de los antibióticos varía en función del tipo de carbapenemasa causante de la resistencia y, por tanto, conociendo las carbapenemasas prevalentes en cada zona, se puede mejorar la elección del tratamiento empírico (12).
Antibióticos Tradicionales
Los tratamientos antibióticos ya conocidos que se emplean para combatir las infecciones causadas por microorganismos resistentes a carbapenemes son: las tigeciclinas, las polimixinas (sobre todo la colistina), aminoglucósidos y los carbapenemes, a menudo, en combinación con alguna de las opciones anteriores. Una de las principales desventajas del uso de estos fármacos es el incremento de la presión selectiva sobre las bacterias que conlleva la aparición de resistencias (1,2,12).
Por lo general, hay evidencias de que la terapia combinada se asocia a una mortalidad inferior que los regímenes de monoterapia, sin embargo, según algunos estudios, no se observan diferencias significativas en términos de respuesta clínica o microbiológica entre los pacientes tratados con terapia combinada y los que reciben monoterapia, por lo que se sugiere que debe haber otros factores implicados en la mortalidad como la gravedad de la infección, el foco de la misma, el patrón de sensibilidad antimicrobiano y las comorbilidades presentes. Coincidiendo con los resultados del estudio INCREMENT y con los datos recogidos por el Centro europeo para la prevención y control de enfermedades (ECDC), se recomienda el empleo de la terapia combinada con dos o más fármacos activos en los pacientes con alto riesgo de morbimortalidad (2,9.11).
Carbapenemes
El beneficio de incluir un carbapenémico en el tratamiento depende de la CMI (concentración mínima inhibitoria) del patógeno responsable de la infección, estimándose oportuna su inclusión solamente en caso de que la CMI sea baja o poco elevada. En cambio, si la CMI es alta (>8 mg/L para meropenem), no se recomienda su empleo para el control de la infección. Las dosis diarias empleadas son el doble de las recomendadas habitualmente: 2 gr cada 8 horas en perfusión extendida durante 3 horas en el caso de meropenem y 2 gr cada 24 horas para ertapenem. Un régimen compuesto por una doble terapia con carbapenémicos, sólo se ha utilizar cuando no haya otra alternativa de tratamiento disponible, habitualmente en caso de gérmenes panresistentes o en pacientes en estado grave, habiéndose demostrado la disminución de la mortalidad en distintos estudios llevados a cabo. La hipótesis que sustenta la utilidad de este régimen es que al tener ertapenem una gran afinidad por KPC, esta lo hidroliza rápidamente, lo que permite a meropenem hacer su efecto de forma concomitante(3,9.12).
Tigeciclina
En el caso de la tigeciclina, se administra una dosis de carga de 100 mg y posteriormente 50 mg cada 12 horas. Su efectividad clínica depende sobretodo del foco que origina la infección. Alcanzan baja concentración en sangre, líquido cefalorraquídeo, orina y tejido pulmonar, por lo que no está recomendado el uso de este antibiótico en infecciones que afecten estos tejidos y, en general, no se emplean en monoterapia para el manejo de CPE. Por otra parte, considerar el uso de altas dosis de tigeciclina (200 mg de dosis de carga y 100 mg cada 12 horas) para el tratamiento de la neumonía nosocomial entre otras infecciones de carácter grave (3,9.12).
Polimixinas
Con respecto a las polimixinas, en particular la colistina, su principal inconveniente es establecer la dosificación óptima, ya que es un fármaco con una estrecha ventana terapéutica y una farmacocinética muy variable, además de un elevado riesgo de aparición de efectos adversos, especialmente en ancianos y afectos de insuficiencia renal. No se han encontrado diferencias significativas entre tratamientos combinados con y sin polimixinas, por tanto, se recomienda su utilización cuando las demás opciones estén limitadas frente a la infección en cuestión y preferentemente en combinación. Actualmente la posología de colistina recomendada es una dosis de carga de 9 MU, seguida de 9 MU/día repartidas en 2-3 dosis para el tratamiento de infecciones provocadas por CPE (3,9.12).
Aminoglucósidos
La inclusión de aminoglucósidos en la terapia combinada, sobre todo gentamicina (5-7 mg/kg/día) y amikacina (15-20 mg/kg/día) dependerá de la localización de la infección, debido a que este grupo de antibióticos penetra mal en los focos pulmonares y gastrointestinales, por lo que los resultados en este caso no compensan el alto riesgo de efectos adversos como la nefrotoxicidad y la ototoxicidad. Sin embargo, su inclusión se ha asociado a mejores resultados cuando se trata de infecciones del tracto urinario. Algunos estudios han encontrado beneficios en el empleo de aminoglucósidos a alta dosis (amikacina 25 mg/kg/día o gentamicina 10–15 mg/kg/día) en pacientes con enfermedad severa, aunque hacen falta más datos para poder recomendar esta pauta en infecciones ocasionadas por CPE (3,9.12).
Fosfomicina
La fosfomicina se ha empleado para tratar infecciones del tracto urinario inferior ocasionadas por K.pneumoniae resistente a carbapenemes debido a su baja tasa de resistencias asociada, no obstante, no es activa frente a infecciones causadas por P.aeruginosa. No se recomienda como tratamiento de primera línea siempre que haya otras opciones disponibles a considerar o se use con el objetivo de disminuir la aparición de resistencias. En el supuesto de que se emplease, se aconseja que se haga como parte de una terapia combinada a la dosis recomendada de 16 a 24 gramos diarios por vía intravenosa(1,9.12).
Nuevos antibióticos
Las nuevas opciones terapéuticas se clasifican en tres grupos principales: betalactámicos tradicionales combinados con nuevos inhibidores de betalactamasas, nuevas cefalosporinas y antibióticos no betalactámicos. Los antibióticos nuevos, han demostrado una buena actividad in vitro. Desafortunadamente hay pocos ensayos clínicos randomizados de tratamiento en infecciones por bacilos gran negativos productores de carbapenemasas. Varios estudio observacionales y un limitado número de pequeños ensayos randomizados han demostrado que ceftazidima/avibactam, plazomicina, imipenem relebactam y meropenem/vaborbactam tienen mejores resultados comparados con los regímenes de polimixina en infecciones causadas por gérmenes productores de KPC carbapenemasa (13).
Igualmente, varios estudios observacionales han mostrado que la eficacia de ceftazidima/avibactam es significativamente mejor que tigeciclina o polimixina en las infecciones por enterobacterales productores de OXA-48 (13).
Actualmente, se están desarrollando más estudios clínicos con el propósito de comparar estas opciones nuevas con la mejor terapia disponible hasta el momento, sin embargo, aún hay muchas limitaciones para poder llevar a cabo ensayos clínicos aleatorizados a gran escala. Por otra parte, hay que tener en cuenta el elevado coste de estos fármacos con respecto a los antiguos (12).
Betalactámicos tradicionales combinados con nuevos inhibidores de betalactamasas: Ceftazidima-avibactam, Meropenem-vaborbactam, Imipenem-relebactam. Otros
Ceftazidima-avibactam es activa frente a las infecciones producidas por CPE, excepto para aquellas que producen metalocarbapenemasas (MBLs). Esta terapia fue aprobada en junio de 2016 por la Agencia Europea del medicamento (EMEA) y sus indicaciones son: infecciones intraabdominales complicadas, infecciones de tracto urinario complicadas, neumonías nosocomiales e infecciones ocasionadas por bacterias gram-negativas cuando no haya otras alternativas terapéuticas disponibles. Otro nuevo antibiótico perteneciente a este grupo es meropenem-vaborbactam, aprobado por la EMEA en diciembre de 2018 con las mismas indicaciones que cetfazidima-avibactam pero no es activo frente a gérmenes productores de OXA 48.(2,12).
Imipenem/cilastina–relebactam, combina un carbapeneme ya conocido con un nuevo inhibidor de betalactamasas. Relebactam, cuya función es potenciar la actividad de imipenem contra CPE no susceptibles a imipenem, tiene una estructura similar a avibactam por lo que posee actividad in vitro contra las carbapenemasas de tipo A y C aunque difiere de avibactam porque carece de actividad contra OXA-48. En los estudios que se han llevado a cabo hasta el momento, imipenem/cilastatina-relebactam ha demostrado eficacia clínica y seguridad para el tratamiento de infecciones complicadas de tracto urinario inferior e intrabdominales. En comparación con colistina más imipenem/cilastina, la mortalidad presentada es menor así como la incidencia de nefrotoxicidad (3)
Sulbactam-durlobactam ha sido recientemente aprobado por la FDA para el tratamiento de la neumonía producida por Acinetobacter carbapeneme resistente (14).
Cefepime/taniborbactam (inhibidor del ácido bórico) está pendiente de aprobación.
Antibióticos no betalactámicos: Plazomicina y Eravaciclina
Plazomicina es un aminoglucósido de nueva generación que ha demostrado una buena actividad in vitro frente a bacterias productoras de KPC en comparación con los antiguos aminoglucósidos. Su actividad es limitada ante las MBLs de tipo NDM. La Food and Drug Administration (FDA) aprobó su uso en junio de 2018 (con una dosis recomendada de 15 mg/kg cada 24 horas si la función renal es normal) para el tratamiento de infecciones complicadas del tracto urinario inferior, debido a las evidencias presentes de que disminuye la mortalidad y la toxicidad renal en comparación a los tratamientos combinados clásicos, aunque aún se necesitan mayores estudios que apoyen su utilidad (3,12).
Eravaciclina es una tetraciclina semisintética con estructura similar a tigeciclina, pero no se afecta por los mecanismos que originan resistencia a las tetraciclinas. Posee un amplio espectro y es activa frente agentes patógenos productores de BLEEs, KPC y OXA. No obstante, al ser una tetraciclina, no presenta actividad ante P.aeruginosa. La FDA y la EMEA han aprobado su formulación intravenosa (dosis de 1 mg/kg cada 12 horas) con indicación para tratar infecciones intrabdominales complicadas (3,12).
Cefalosporinas sideróforas: Cefiderocol
Otro antibiótico recién comercializado es el cefiderocol. Este es una cefalosporina que actúa con un mecanismo único, uniéndose al ácido férrico e introduciéndose en el interior del microorganismo a través de un canal de hierro. Posee una potente actividad in vitro e in vivo frente a gram-negativos incluyendo CPE. Puede ser útil para las metalocarbapenemasas aunque según datos del EUCAST (European Commitee on Antimicrobial Susceptibility Testing) en menos del 75% de los aislamientos En la actualidad se están realizando estudios más amplios para demostrar su eficacia en el tratamiento de infecciones graves por CPE y compararla con las mejores opciones disponibles (3).
Recomendaciones terapéuticas actuales
Los datos disponibles hasta el momento han demostrado que el uso de los betalactámicos tradicionales combinados con nuevos inhibidores de betalactamasas presenta una mejoría en los resultados clínicos, descenso de la mortalidad y una menos toxicidad, con respecto a las terapias convencionales. Por ello, se recomienda el empleo tanto de ceftazidima-avibactam (2,5 gr cada 8 horas) o meropenem-vaborbactam (2 gr cada 8 horas) como primera elección en infecciones causadas por CPE. No se han hallado hasta ahora diferencias de eficacia de uno respecto al otro, pero en zonas donde haya elevada prevalencia de OXA-48, es preferible el empleo de ceftazidima-avibactam que, además, es activo también contra P.aeruginosa resistente a carbapenémicos aunque carece de actividad frente a carbapenemasas de clase B o MBLs (3,12).
Adicionalmente, la combinación de aztreonam-avibactam, que ha sido autorizada en la Unión Europea para infecciones intraabdominales, urinarias y neumonía hospitalaria (incluida la asociada a ventilación mecánica) puede ser una opción prometedora en el manejo de infecciones ocasionadas por microorganismos productores de MBLs. Se usaría con dosis de carga de 2 gr aztreonam/0.5 gr avibactam y mantenimiento de 1.5/0.5 gr cada 6 horas en perfusión (si el Ccr es > 50 ml/h). No es útil para Acinetobacter carbapeneme resistente.
Meropenem-vaborbactam es recomendable en áreas donde la prevalencia de OXA-48 sea baja ya que, por otro lado, posee mayor actividad contra gérmenes productores de KPC y un bajo potencial de generar resistencias. También tiene actividad contra carbapenemasas de tipo C (3,12).
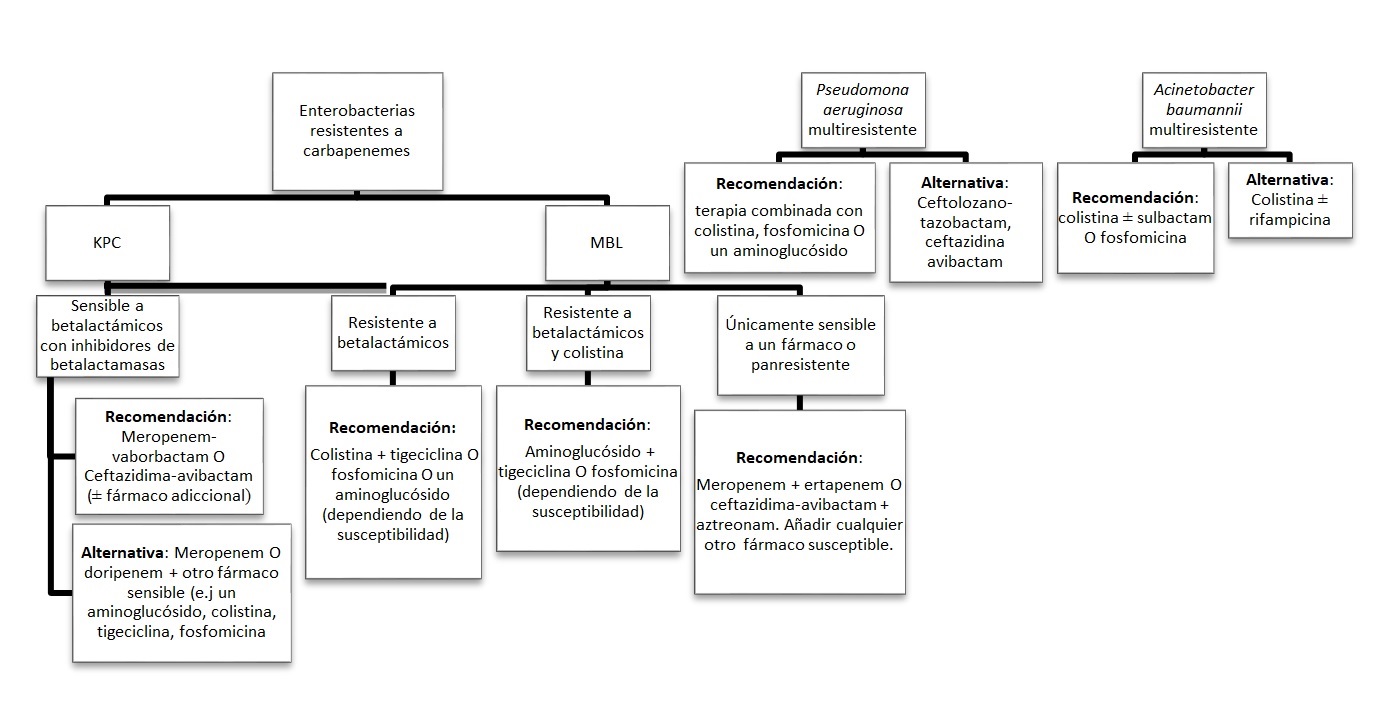
Es fundamental a la hora de establecer un tratamiento dirigido y una adecuada desescalada terapéutica, conocer el antibiograma con los datos de susceptibilidad. Debido a la presencia de múltiples y complejos mecanismos de resistencias así como la posibilidad del desarrollo de resistencias durante el tratamiento, por tanto se recomienda repetir el antibiograma ante la persistencia de cultivos positivos (2,12) (figura 1).
Figura 1. Algoritmo de prescripción antibiótica personalizada para infecciones por gran-negativos resistentes a carbapenemes. Adaptado de: “Epidemiology an clinical signifi cance of carbapenemases in Australia: a narrative review”, por Tarik Aslan A, Paterson DL et al, 2024, Internal Medicine Journal
4. Estado de portador
Las CPE, particularmente K.pneumoniae productora de KPC (Kp-KPC), son capaces de colonizar tracto gastrointestinal, orofaringe, piel y tracto urinario; esto puede ser motivo de infecciones subsecuentes en el hospedador (con una tasa global de 16,5%, y un rango del 0 al 89% en pacientes de alto riesgo). Hay un porcentaje significativo de pacientes que están colonizados por bacterias resistentes, esto apoya la importancia de implementar un sistema de screening a través de la realización cultivos de control a los posibles portadores. Una buena estrategia para identificar a estos portadores sería recoger exudados rectales y de otras localizaciones como garganta, heridas o tracto respiratorio inferior(2,15).Un estudio realizado en nuestro medio demuestra que entre los pacientes de residencias colonizados por gérmenes multirresistentes el 27.5% era por K.Pneumoniae productora de OXA-48 y el 2.5 % de los E.Coli también eran productores de la OXA-48.Los factores de riesgo para estar colonizados eran el número de hospitalizaciones durante el último año, las hospitalizaciones debidas a infecciones y el número de días de hospitalización durante el último año (16).
Lamentablemente, la erradicación de estos patógenos de la flora intestinal es difícil. Se han hecho intentos con medicación antibiótica oral no absorbible y también con trasplantes de microbiota fecal, pero los resultados son limitados (2).
Además, el estado de portador puede contribuir a la propagación de estos patógenos en el ambiente hospitalario, ya que actúan como reservorios, lo que conlleva riesgo de desarrollar brotes nosocomiales (15).
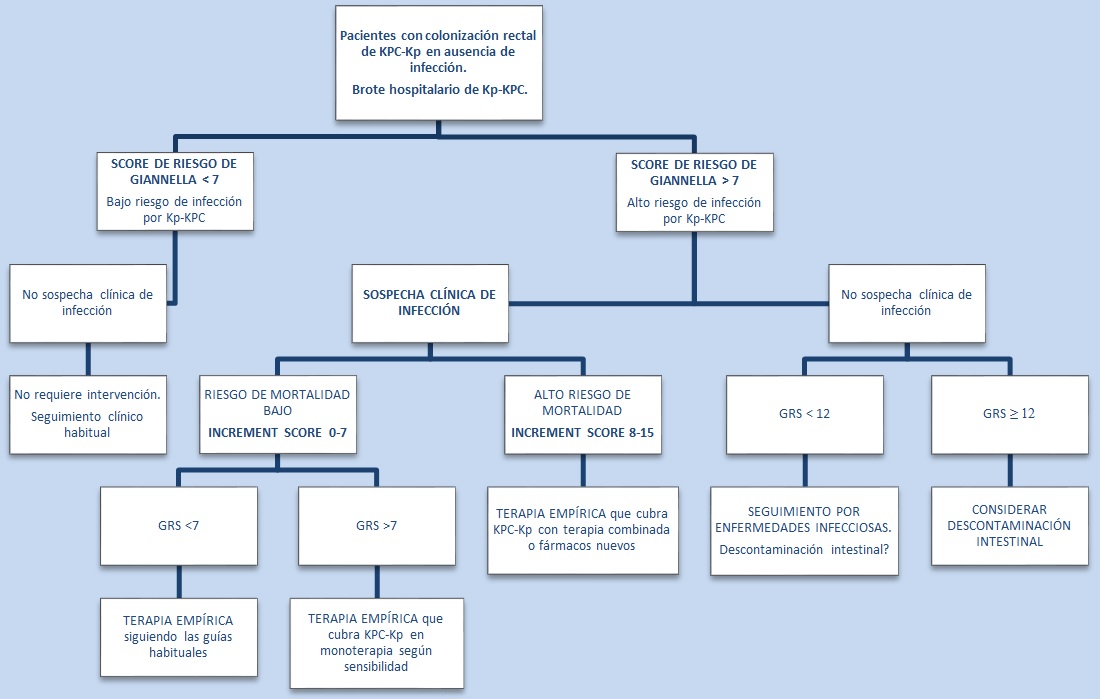
Para el manejo de los portadores de Kp-KPC se publicó un estudio en la revista Clinical Infectious Diseases en 2018 que propone un algoritmo que combina dos scores ya existentes: el score de mortalidad INCREMENT y el score de riesgo de Gianella (GRS por sus siglas en inglés), aplicable en pacientes colonizados (17).
Para reducir la mortalidad de estas infecciones, es necesario establecer criterios objetivos, para decidir cuándo se debe empezar la terapia empírica activa en pacientes colonizados que desarrollan signos de infección, ya que conlleva el uso de fármacos nuevos cuyo uso debe ser limitado o de fármacos de amplio espectro en combinación con tratamientos de segunda línea, con una elevada toxicidad. Además, serían menos eficaces en el caso de que la infección estuviera causada por una cepa susceptible en vez de por Kp-KPC (17).
El objetivo principal de este estudio fue demostrar la validez externa de ambos scores (INCREMENT y GRS) y su valor predictivo, así como establecer un algoritmo de manejo de estos pacientes para un adecuado tratamiento empírico mediante la combinación de ambos scores (17) (figura 2).
Figura 2. Algoritmo de manejo de pacientes colonizados por Kp-KPC. Adaptado de “Risks of Infection and Mortality among Patients Colonized with Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management”, por A. Cano, B.Gutiérrez-Gutiérrez etal., 2018, Clin Infect Dise, 66, p.1204-1210.
5. Medidas de prevención
En primer lugar, es importante un adecuado aislamiento de contacto, esto incluye el uso obligatorio de batas y guantes tanto para los profesionales de la sanidad como para las visitas de los pacientes. Incluso, se estima oportuno el empleo de fonendoscopio, esfigmomanómetro y termómetro de uso exclusivo (15).
Asimismo, la higiene de manos resulta un elemento clave, ya que se ha visto que las manos, son un vector de transmisión de infecciones muy importante en el ámbito sanitario. Por tanto, se debe lavar las manos de manera adecuada antes de entrar a la habitación de cada paciente y antes de salir (15).
El aislamiento de los pacientes y de sus contactos estrechos también constituye un pilar básico en la contención de la transmisión de gram-negativos productores de carbapenemasas (15).
Otra medida a considerar es la adecuada limpieza y esterilización de los ambientes, así como de los aparatos de uso invasivos. El ambiente hospitalario juega un papel fundamental en la expansión de estos agentes patógenos ya que actúa como reservorio. En uno de los estudios, se tomaron muestras para cultivo tanto de las superficies como del equipamiento, habiéndose hallado K.pneumoniae productora de carbapenemasas en colchones, barandillas de las camas, bombas de infusión, llaves de medicación intravenosa, monitores de televisión y tubos endotraqueales. Para evitar que esto ocurra, puede ser beneficioso establecer un equipo instruido en este tipo de limpieza que se dedique en exclusiva a este ámbito, recomendando además el uso de solución antiséptica de clorhexidina en la higiene diaria del paciente (15).
Algunos estudios asignaron un equipo de expertos para supervisar que las tareas de prevención se desarrollaban de forma adecuada entre el personal sanitario, se vio que era necesario una mayor concienciación y entrenamiento del personal sanitario, ya que en muchas ocasiones no se cumplían las medidas de manera adecuada. De forma similar, en Israel durante un brote que tuvo lugar en marzo de 2007, el ministerio de sanidad conformó un comité de expertos en enfermedades infecciosas, que se dedicaban a controlar que se cumplían las medidas apropiadas, lo que contribuyó favorablemente en la contención del brote (15).
En 2011, el ECDC realizó una revisión sistemática de la efectividad de las medidas de control de infecciones para prevenir la propagación de CPE, con una actualización en 2014 (2).
Las medidas identificadas como efectivas incluyeron (figura 3):
Figura 3. Medidas de aislamiento de contacto. Creada por: Beatriz Calvo Bernal.
- Implementación temprana de vigilancia activa, a través de muestra rectal para detectar portadores de CPE al ingreso hospitalario, admisión en unidades específicas, y durante brotes
- Aislamiento preventivo al ingreso
- Medidas de precaución de contacto
- Higiene de manos
- Cohorte de pacientes
- Aislamiento de pacientes
- Enfermería especializada
- Limpieza ambiental
- Educación del personal
- Notificación de casos
- Rastreo de contactos
- Restricción en el uso de antibióticos
Conclusiones
Las infecciones producidas por gérmenes productores de carbapenemasas constituye un serio problema, ya que van extendiéndose a todo el mundo. La mortalidad de estas infecciones es alta. En los últimos años han aparecido nuevos antibióticos o antibióticos betalactámicos tradicionales asociados a nuevos inhibidores de betalactamasas que han mejorado el tratamiento de estas infecciones. No obstante, se necesita seguir acumulando experiencia con dichos fármacos con series amplias y es necesaria una vigilancia activa de la aparición de resistencias a estos antibióticos. Es conveniente también una más rápida comercialización de los ya investigados, una mayor investigación de nuevos fármacos activos que suplan las deficiencias de los actuales y un precio más asequible para que puedan ser usados en todos los países. El conocimiento epidemiológico de la situación de cada país y de cada hospital respecto a estas infecciones contribuirá a un mejor manejo de las mismas.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Codjoe F, Donkor E. Carbapenem Resistance: A Review. Med Sci [Internet]. 2017; 6(1):1. Disponible en: http://www.mdpi.com/2076-3271/6/1/1
- ↑European Centre for Disease Prevention and Control (ECDC). Rapid risk assessment: Carbapenem-resistant Enterobacteriaceae-26 September 2019. Stockholm. Ecdc. 2019
- ↑Sheu CC, Chang YT, Lin SY, Chen YH, Hsueh PR. Infections caused by carbapenem-resistant Enterobacteriaceae: An update on therapeutic options. Frontiers in Microbiology. 2019.
- ↑Xu L, Sun X, Ma X. Systematic review and meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae. Ann Clin Microbiol Antimicrob [Internet]. 2017;16(1):18. Disponible en http://ann-clinmicrob.biomedcentral.com/articles/10.1186/s12941-017-0191-3
- ↑Cantón R, Akóva M, Carmeli Y, Giske CG, Glupczynski Y, Gniadkowski M, et al. Rapid evolution and spread of carbapenemases among Enterobacteriaceae in Europe. Clinical Microbiology and Infection. 2012;18:413-431
- ↑Rivera Izquierdo M, Lainez Ramos Bossini AJ, Rivera Izquierdo C, López Gómez J, Fernández Martinez NF, Redruello Guerrero P, Martin de los Reyes LM, Martinez Ruiz V. Moreno Roldan E, Jimenez Mejías E.OXA-48 Carbapenemase-Producing Enterobacterales in Spanish Hospitals: An Updated Comprehensive Review on a Rising Antimicrobial Resistance.Antibiotic 2021;10:89-104
- ↑Nordmann P, Dortet L, Poirel L. Carbapenem resistance in Enterobacteriaceae: Here is the storm! Trends in Molecular Medicine. 2012;18:263-72
- ↑Lutgring JD, Limbago BM. The Problem of Carbapenemase-Producing-Carbapenem-Resistant-Enterobacteriaceae Detection. Journal of Clinical Microbiology. 2016;54:529-534
- ↑Agyeman AA, Bergen PJ, Rao GG, Nation RL, Landersdorfer CB. A systematic review and meta-analysis of treatment outcomes following antibiotic therapy among patients with carbapenem-resistant Klebsiella pneumoniae infections. International Journal of Antimicrobial Agents. 2020.
- ↑Gutiérrez-Gutiérrez B, Salamanca E, de Cueto M, Pascual A, Rodríguez-Baño J, Hsueh PR, et al. A Predictive Model of Mortality in Patients With Bloodstream Infections due to Carbapenemase-Producing Enterobacteriaceae. Mayo Clin Proc. 2016;91(10):1362–71.
- ↑Gutiérrez-Gutiérrez B, Salamanca E, de Cueto M, Hsueh PR, Viale P, Paño-Pardo JR, et al. Effect of appropriate combination therapy on mortality of patients with bloodstream infections due to carbapenemase-producing Enterobacteriaceae (INCREMENT): a retrospective cohort study. Lancet Infect Dis. 2017;17(7):726-734.
- ↑Peri AM, Doi Y, Potoski BA, Harris PNA, Paterson DL, Righi E. Antimicrobial treatment challenges in the era of carbapenem resistance. Diagnostic Microbiology and Infectious Disease. 2019; 94(4):413-25
- ↑AslamAT,Akova M.The role of colistin in the era of new β-lactam/β-lactamase inhibitor combinations.Antibiotic 2022;11:277
- ↑Tarik Aslan A, Paterson DL. Epidemiology an clinical significance of carbapenemases in Australia: a narrative review. Internal Medicine Journal 2024;54:535-544
- ↑Campos AC, Albiero J, Ecker AB, Kuroda CM, Meirelles LEF, Polato A, et al. Outbreak of Klebsiella pneumoniae carbapenemase–producing K pneumoniae: A systematic review. American Journal of Infection Control. 2016; 44(11):1374-80
- ↑Rivera Izquierdo M, Benavente Fernández A, López Gómez J, Lainez Ramos Bossini AJ, Rodriguez Camacho M, Valero Urbiena MC, Martin de los Reyes LM, Jimenez Mejías E, Moreno Roldan E, Lardelli Claret P, Martinez Ruiz V. Prevalence of Multi-Resistant Microorganisms and Antibiotic Stewardship among Hospitalized Patients Living in Residential Care Homes in Spain: A cross-Sectional Study. Antibiotics 2020; 9:324-332.
- ↑Cano A, Gutiérrez-Gutiérrez B, Machuca I, Gracia-Ahufinger I, Pérez-Nadales E, Causse M, et al. Risks of Infection and Mortality among Patients Colonized with Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management. Clin Infect Dis. 2018;66(8):1204–1
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Beatriz Calvo Bernal. C/ Valero Rivera nº 11, Almería 04004. Email: beacalvo27@gmail.com