Revisión
El uso de BMP-2 en Traumatología. Avances en Ingeniería Tisular
BMP-2 in Traumatology. Advances in Tissue Engineering
Actual. Med. 2013; 98: (790): 154-159
Enviado: 16-09-2013
Revisado: 01-12-2013
Aceptado: 10-12-2013
RESUMEN
Las proteínas morfogenéticas óseas – en inglés, Bone Morphogenetic Proteins (BMPs) – son proteínas producidas localmente por los osteoblastos y que intervienen en multitud de funciones celulares como son la regulación de la hematopoyesis, la estimulación de la síntesis de matriz extracelular, el mantenimiento celular (incluida la apoptosis), el crecimiento y diferenciación de osteoblastos y condroblastos, así como en la morfogénesis de diferentes tejidos y órganos, como el renal y el nervioso. Las BMPs son los únicos factores morfógenos existentes, capaces de estimular la multiplicación de las células conectivas y transformarlas en células osteoprogenitoras. Dentro de esta familia de proteínas, destaca la BMP-2 como un factor de crecimiento capaz de inducir la formación de hueso y cartílago mediante la estimulación de la diferenciación de los osteoblastos y condrocitos en diversos tipos celulares. En la actualidad, son numerosos los campos donde se estudian los efectos de la BMP-2 o, incluso, se usa como complemento a otras técnicas quirúrgicas existentes en el ámbito hospitalario. La proteína BMP-2 ha mostrado ser capaz de estimular la producción de hueso, ayudando a la curación de defectos en la unión de huesos largos o la fusión espinal, así como al tratamiento de fracturas abiertas o aplicaciones odontológicas, entre otras.
En este artículo se realiza una revisión de la literatura sobre los avances recientes del uso de la BMP-2, prestando especial atención a los ámbitos de la Traumatología (en particular al tratamiento de fracturas abiertas, pseudoartrosis y fusión lumbar) y la Ingeniería Tisular. Aunque parece que, en general, la mayoría de trabajos muestran que la BMP-2 proporciona resultados positivos e incluso puede reducir los costes de intervención en comparación con otras técnicas, otros estudios indican los posibles eventos adversos que su uso puede producir.
Palabras clave: BMP-2, aplicaciones, traumatología, ingeniería tisular.
ABSTRACT
Bone Morphogenetic Proteins (BMPs) are proteins locally produced by osteoblasts that are involved in many cellular functions such as the regulation of the hematopoiesis and the stimulation of the extracellular matrix synthesis; they also influence the cellular maintenance (including the apoptosis) and are involved in the growth and differentiation of osteoblasts and chondroblasts. BMPs are the unique existing morphogens that are capable of stimulating the proliferation of connective cells and transform them into osteoprogenitor cells. Within this protein family, BMP-2 is presented as a key growth factor that induces the bone and cartilage formation, stimulating the differentiation of osteoblasts and chondrocytes in several cell types. The effects of BMP-2 have been studied in many fields. Moreover, BMP-2 has been even used as a supplement to other existing surgical techniques in clinic. In addition, the BMP-2 protein is able to stimulate the bone production, aiding the healing of defects in the long bone union or spine fusión, and the treatment of open fractures or dental applications, among others.
In this paper, recent advances on the usage of BMP-2 are reviewed in the literature, paying attention to the areas of Traumatology (particularly the treatment of open fractures, nonunions and spinal fusion) and Tissue Engineering. Even though, most of the studies show that there are applications of BMP-2 that provide positive results and may reduce the costs of intervention compared to other techniques, other studies indicate the potential adverse events that their use can produce.
Keywords: BMP-2, applications, traumatology, tissue engineering.
Leer Artículo Completo
Introducción
Las BMPs son proteínas formadas por dos cadenas polipeptídicas idénticas que pertenecen a la familia de los factores de crecimiento transformantes TGF-β, una super-familia de proteínas directamente relacionada con la condrogénesis, la osteogénesis y la inducción de tejido conjuntivo (1). Las BMPs se encuentran en todos los organismos, desde las esponjas hasta los seres humanos (2). Éstas se caracterizan principalmente por su inmenso potencial osteoinductivo, ya que son capaces de promover la formación de hueso nuevo mediante la estimulación de las células osteoprogenitoras para diferenciarse en osteoblastos (3, 4). Durante la formación de hueso inducen una secuencia de eventos relacionados con la condro-osteogénesis y, en última instancia, permiten la curación de fracturas, incluyendo la quimiotaxis, la proliferación de células osteoprogenitoras mesenquimales y su diferenciación en un linaje osteogénico o condrogénico (3).
Las BMPs son críticas para el desarrollo embrionario y la homeostasis del tejido en organismos adultos (2). Algunos ejemplos de procesos dependientes de las BMPs durante el desarrollo son, por ejemplo, la formación del eje embrionario, el desarrollo de las extremidades, los patrones del sistema nervioso, la formación de la cresta neural y el desarrollo de las estructuras craneofaciales (2, 5). Por otra parte, la mutación o eliminación de sus componentes origina patologías como la hipertensión arterial pulmonar, la telangiectasia hemorrágica hereditaria, la fibroplasia osificante progresiva, así como anomalías esqueléticas y algunos tipos de cáncer (1).
El descubrimiento de las BMPs por Urist en 1965 (6) ha supuesto especialmente una gran investigación dedicada a la identificación y caracterización de factores de crecimiento osteoinductivos. Se sabe que las BMPs interactúan con receptores específicos que se encuentran en la superficie celular, lo que provoca una transducción de la señal que origina la movilización de proteínas de la familia de Smad (7). Así, las proteínas de la familia Smad reguladas por las BMPs (como son el R-Smad, Smad1, Smad4, Smad5, Smad8 y co-Smad) juegan un papel crítico como reguladores transcripcionales en osteogénesis y condrogénesis (8).
Aunque existen diferentes tipos de BMPs (9), la mayor parte de los estudios recientes en la literatura se han centrado en la BMP-2, -6, -7, -9, y -14. Entre ellas, como se mencionó anteriormente, la BMP-2 es una proteína que actúa como factor de crecimiento capaz de inducir la formación del hueso y cartílago mediante la estimulación de la diferenciación de los osteoblastos y los condrocitos en diversos tipos celulares (10-12). Debido a estas propiedades, su estudio y utilización en determinados ámbitos, como es la Traumatología (en la cual se centra la Sección 2) y la Ingeniería Tisular (que se analiza en la Sección 3) parece tener una gran importancia, lo cual queda reflejado por el creciente número de publicaciones de los últimos años en ambos campos.
Sobre el uso de la BMP-2 en Traumatología
La proteína BMP-2 se ha evaluado en numerosos modelos preclínicos y clínicos. Se ha aplicado con éxito en la curación de diversas patologías debido a que es capaz de estimular la producción de hueso (13-17). En algunos casos, como es el tratamiento de fracturas abiertas, incluso es recomendada debido a que es capaz de reducir el coste de otras técnicas (18). Aunque sus aplicaciones se han centrado principalmente en el tratamiento de retrasos en la consolidación ósea, la pseudoartrosis y artrodesis vertebrales, actualmente se está ampliando su uso en las siguientes patologías (19):
Fracturas agudas de tibia en adultos: la BMP-2 se usa como complemento al tratamiento estándar que utiliza la reducción abierta y el enclavado intramedular.
Defectos óseos: en este grupo se incluyen también los defectos peroneos tras osteotomía tibial.
Procesos de elongación ósea.
Hueso osteoporótico: la BMP-2 se utiliza de forma conjunta con bifosfonatos.
Algunos trabajos muestran que la BMP-2 es una alternativa viable al injerto y permite superar algunos de sus inconvenientes (4, 20). Además, puede ser combinada con otros factores, células, biomateriales e injertos para mejorar los resultados de curación (21, 22). Sin embargo, en la actualidad se están revisando sus posibles efectos adversos, entre los cuales pueden citarse el aumento del número de células inflamatorias en el lugar de aplicación, el aumento sérico de las concentraciones de anticuerpos anti-BMP-2, el edema generalizado, el crecimiento óseo y la aparición de osificaciones heterotópicas (19). En las siguientes secciones se analizan las ventajas y posibles problemas que el empleo de la BMP-2 puede tener en tres de sus aplicaciones más importantes dentro de la Traumatología, como son su uso en fracturas abiertas (Sección 2.1), pseudoartrosis (Sección 2.2) y fusión lumbar (Sección 2.3).
2.1. BMP-2 y fracturas abiertas
Dado el complicado tratamiento de las fracturas abiertas, es mucho el interés para mejorar su curación. Sin embargo, pese a que BMP-2 es un potente agente osteoinductivo, su uso en la cirugía de fracturas todavía se está estudiando, por lo que no es abundante la literatura perteneciente a este ámbito (23-25). Aún así, el uso de la BMP-2 como complemento a otros tratamientos, como el enclavado intramedular, parece ser una de las alternativas más prometedoras (17). Esta técnica, disminuye las tasas de reintervención (ya que se reducen las tasas de pseudoartrosis y el fracaso del material) y el tiempo de curación, lo cual implica un ahorro económico. Además, se suele observar una reducción en las tasas de infección y el dolor postoperatorio con respecto al tratamiento conservador.
En fracturas graves de tibia, la BMP-2 aumenta las tasas de curación sin necesidad de los procedimientos secundarios comúnmente aplicados con otras técnicas tradicionales (23). Adicionalmente, este tratamiento sobre fracturas agudas supone una reducción económica del coste invertido comparando con el enclavado intramedular y la gestión de los tejidos blandos (18, 23). Sin embargo, la aplicación de la BMP-2 en fracturas abiertas de tibia tratadas además con fijación por clavo intramedular fresado parece no ofrecer una mejora significativa en la consolidación de la fractura, produciendo un alto porcentaje de infección en los pacientes tratados (24).
El uso de la BMP-2 en localizaciones periarticulares no parece ofrecer tampoco resultados satisfactorios, suponiendo un mantenimiento de la integridad del hueso subcondral similar a no usar la BMP-2 (25). Además, produce con frecuencia complicaciones tales como hueso heterotópico, lo que aumenta las tasas de re-intervención.
2.2. BMP-2 y pseudoartrosis
Una de las aplicaciones más prometedoras para el uso de las BMPs es el tratamiento de la pseudoartrosis (21, 26, 27). Los requerimientos necesarios para ser utilizadas con esta patología incluyen un lecho limpio, sin contaminación bacteriológica, viable y vascularizado con una buena estabilización del defecto óseo (19). Bajo estas condiciones, las BMPs son capaces de formar hueso huésped y remodelar el implante que permite tratar la pseudoartrosis (16, 28), evitando muchas de las infecciones o reacciones alérgicas que pueden producirse con otros métodos (28). Así, las BMPs se han postulado como un sustituto del injerto óseo autólogo y una alternativa a la amputación en este campo (28, 29).
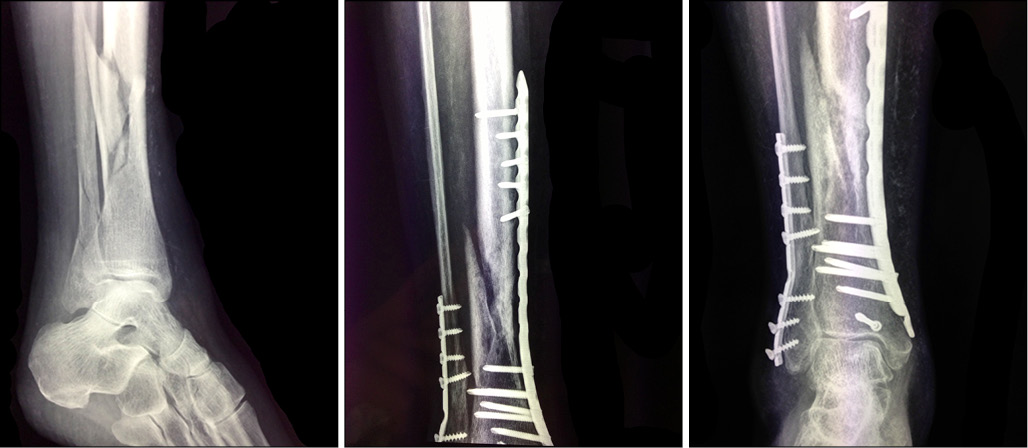
El uso combinado de la BMP-2 recombinante humana (rhBMP-2) con otras técnicas tradicionales para tratar la pseudoartrosis parece mejorar la eficacia de los tratamientos de esta patología (Figura 1). Así se ha hecho, por ejemplo, para tratar la pseudoartrosis congénita de tibia en niños (21, 22). La rhBMP-2 se ha combinado con estabilización intramedular y fijación externa para mejorar la velocidad inicial de la unión y reducir el tiempo de consolidación (21). La combinación con el procedimiento de Masquelet también permitió alcanzar una mayor reconstrucción ósea (22). Por otro lado, Bostrom et al. usan conjuntamente la proteína osteoinductiva y la rhBMP-2 (combinada con microesferas porosas) para curar un gran defecto diafisario de conejo (26). En este trabajo se observó que la mayor tasa de formación de hueso se obtuvo con las dosis más altas de la BMP-2 mientras que con las dosis más bajas se logró una menor unión ósea, mostrándose así la BMP-2 como un morfógeno potente en la regeneración ósea.
Figura 1: Fractura abierta de tibia y peroné y tratamientos aplicados. La figura (a) muestra la fractura abierta que fue posteriormente tratada quirúrgicamente. La figura (b) muestra el tratamiento con una reducción abierta y osteosíntesis con placas y tornillos, cuya evolución fue a la pseudoartrosis. La figura (c) muestra el tratamiento de la pseudoartrosis: se realizó apertura del foco y se administró rhBMP-2, observándose al poco tiempo el inicio de la consolidación ósea.
La rhBMP-2 también se ha usado por separado para el tratamiento de pseudoartrosis de huesos largos, mostrándose como una alternativa adecuada al injerto autólogo de cresta ilíaca e implicando un menor tiempo quirúrgico y una menor pérdida de sangre intraoperatoria (16).
2.3. BMP-2 y fusión lumbar
A pesar de los posibles efectos adversos informados sobre el uso de la BMP-2 en el tratamiento de la fusión lumbar (30, 31), la utilización de la rhBMP-2 se ha postulado como una alternativa viable al autoinjerto de cresta iliaca en la artrodesis de columna (20, 32, 33). Ésta ha mostrado una mayor tasa de fusión radiográfica y clínica, así como ciertas ventajas, entre las que están una menor pérdida sanguínea, tasas de fusión ósea más temprana y una menor frecuencia de pseudoartrosis y necesidad de reintervenciones (32, 33). Otros estudios no encuentran diferencias significativas en la tasa de la unión ósea al usar la BMP-2 o el injerto cresta iliaca (20), aunque informan que su uso no produce tantas complicaciones adicionales, como pseudoartrosis y problemas con el sitio donante.
Sin embargo, la experiencia con el uso de la proteína BMP-2 en fusión lumbar ha mostrado que su utilización puede conllevar eventos adversos (34-36). Así, se han registrado las posibles complicaciones potencialmente graves asociadas a las BMPs, como son la resorción ósea local o los problemas que conllevan la obstrucción de las vías respiratorias (34). La rhBMP-2 también puede interactuar con el sistema nervioso (35). El acceso directo al parénquima de la médula espinal o a los ganglios de la raíces dorsales por parte de la rhBMP-2 puede desencadenar la inflamación significativa y cambios morfológicos dentro de estos tejidos que podrían ser perjudiciales para la recuperación neurológica. También, aunque de forma reversible, se ha registrado la aparición de hiperalgesia mecánica en la cirugía de la artrodesis posterolateral de la columna lumbar (35).
Otras complicaciones de su uso, incluyendo eventos que amenazan la vida, se han observado con el uso de la rhBMP-2 en fusión anterior cervical, intersomática anterior y lumbar posterior o fusiones posterolaterales (36). En la fusión intersomática anterior se objetivaron más efectos adversos que en los controles, como el desplazamiento del implante, el hundimiento, infección y eventos urogenitales. En la fusión intersomática lumbar posterior su uso se asoció con radiculitis, la formación de hueso ectópico y la osteolisis. Por último, en fusiones posterolaterales, el riesgo de efectos adversos era equivalente o mayor que el del injerto con cresta iliaca; los sujetos informaron de dolor temprano, incluyendo el de piernas. Se comprobó que dosis más altas de rhBMP-2 implicaban un mayor riesgo de malignidad.
Después de la artrodesis vertebral, también se han registrado casos de pseudoartrosis y ésta sigue siendo una complicación clínicamente significativa tras la cirugía de columna (37). En este caso, las características individuales del paciente (como son fumar, la osteoporosis, la cirugía multinivel y la revisión) aumentan el riesgo de pseudoartrosis (37). Otros estudios reportan nuevos efectos adversos de la rhBMP-2 en cirugía de columna (30, 31). Éstos incluyen la formación de hueso ectópico, la resorción ósea o remodelación en el sitio del injerto, hematoma, hinchazón del cuello y seroma doloroso. Otras potenciales preocupaciones teóricas incluyen efectos carcinógenos y teratógenos. Además, se ha estudiado que la reexposición a la BMP-2 en cirugía lumbar podía provocar algunas complicaciones como la existencia de anticuerpos anti-BMP-2 (31). Dicha existencia se asoció con la reexposición a dicha proteína, pero existía una variabilidad inmunológica que dependía del paciente; así pues su frecuencia no se podía cuantificar con exactitud.
Debido a la controversia de los estudios realizados, la Food and Drug Administration de los Estados Unidos ha tenido que desempeñar un papel regulador. Ésta sugiere posible sesgo en los diseños de los estudios de los ensayos originales, así como un claro aumento del riesgo de complicaciones y los eventos adversos a los pacientes que reciben rhBMP-2 en la fusión espinal (36). Así pues, parece imprescindible que el cirujano de columna evalúe a cada paciente individualmente en base a la edad, la calidad del hueso, el diagnóstico, comorbilidades, y los riesgos de falta de unión para determinar la corrección del uso de BMP para aumentar la fusión espinal (37). Además, debido a su alto coste en comparación a los tratamientos tradicionales de fusión lumbar, el uso de la BMP-2 no se recomienda sistemáticamente.
Aplicación de la BMP-2 en Ingeniería Tisular: nuevos avances
Se ha demostrado que la BMP-2 realiza varias funciones en el tejido óseo, como actuar como un agente quimiotáctico y promover la proliferación y la diferenciación osteoblástica de las células madre mesenquimales (10). También es capaz de promover la diferenciación del cartílago y la maduración de la matriz en el cartílago (38). Su gran capacidad osteogénica hace que su aplicación en seres humanos aumente enormemente la osteocalcina, induciendo la formación de hueso (39, 40). Además, juega un papel crucial para la proliferación de condrocitos y la maduración durante el desarrollo de hueso endocondral (41). Todas estas propiedades indican una importancia de la BMP-2 en la reparación y el crecimiento de los tejidos ortopédicos.
Existen estudios que muestran que la aplicación de las BMPs en ratones promueven la rehabilitación de defectos óseos, lo que las hace útiles en el campo de la ingeniería de tejidos y la regeneración (42). Otros trabajos han mostrado que la incorporación de la BMP-2 en un material promueve las propiedades osteoinductivas de dicho material (43, 44). Así, la BMP-2 se presenta como uno de los factores de crecimiento más importantes en la ingeniería de tejido óseo que pueden promover la regeneración completa de los mismos. Debido a su fuerte osteoinductividad es capaz de inducir la expresión de marcadores osteogénicos, tales como la fosfatasa alcalina y la osteocalcina a través de la proteína quinasa activada por mitógenos (44).
La conjugación de la BMP-2 y matrices biocerámicas porosas sin una capa de revestimiento ha mostrado mejorar las propiedades de osteointegración en comparación con las matrices sin la BMP-2 (43, 44). Sin embargo, esta metodología tiene varias limitaciones, como son la desnaturalización causada por reacciones de degradación física/química y la dificultad de la liberación sostenida del factor de crecimiento.
Para solucionar estos problemas, una posible alternativa es recubrir las matrices porosas de hidroxiapatita (HA) con xerogel de sílice y quitosano que contenía ciertas cantidades de BMP-2 (11). La respuesta in vitro de las células osteoblásticas y la formación de hueso nuevo en conejos mejoró al utilizar esta capa cargada con la BMP-2 en comparación con los de la matriz porosa de HA o la capa híbrida sin BMP-2. Estos resultados revelaron que el recubrimiento híbrido que contiene BMP-2 tiene un gran potencial para ser utilizado en implantes de hueso y sus propiedades osteogénicas son promovidas por la liberación de BMP-2 de una manera controlada durante un período prolongado de tiempo.
En la misma línea, otros trabajos pretenden profundizar en los efectos de los materiales de las matrices celulares al usar la BMP-2 en ingeniería tisular in vivo (12). Varios geles (entre los que están el alginato, el colágeno, la agarosa o el hialuronato) se mezclan con la BMP-2 para funciones celulares de la médula ósea y se inyecta en los músculos de ratones atímicos para evaluar la osteogénesis y la condrogénesis resultantes. Los geles que más sinergia presentaron al ser combinados con la BMP-2 para formar nuevo hueso fueron los de colágeno, hialuronato o el de alginato, mientras que los que presentaron menos sinergia al formar poco o ningún hueso fueron los geles de fibrina o el Pluronic.
Estos estudios indican que la BMP-2 podría promover mejor la osteogénesis y condrogénesis en aplicaciones de ingeniería de tejidos, especialmente en el campo de la traumatología y ortopedia. En la actualidad, la BMP-2 se está utilizando también in vitro en otros ámbitos importantes, como puede ser para la regeneración del cartílago articular o condrogénesis (Sección 3.1) o la Odontología (Sección 3.2).
3.1. Aplicación de la BMP-2 en la condrogénesis
Sabemos que el cartílago articular, cuando está dañado por enfermedad degenerativa o traumática, tiene una limitada capacidad de autorreparación debido a su condición de avascularidad principalmente. Al mismo tiempo, la BMP-2 juega un importante papel en la regulación de la osteogénesis y la condrogénesis de células madre (45, 46). En el caso del cartílago, la BMP-2 actúa induciendo el crecimiento del mismo por diferenciación celular a partir de los fibroblastos y células mesenquimatosas del pericondrio.
La sinergia entre el factor de crecimiento de fibroblastos-2 (FGF-2), y la BMP-2 para la formación de cartílago bovino fue estudiada por Martin y sus colaboradores (15). Tras la experimentación, se llegó a la conclusión de que la expansión de los condrocitos con FGF-2 (en el cultivo 2D) seguido del uso de la BMP-2 (en el cultivo 3D) ofrecía mejores resultados que cualquier otra alternativa (como usar sólo FGF-2 o BMP-2 sobre los condrocitos primarios). Otra experimentación sobre animales usó un microgel inyectable de perlecan-ácido hialurónico con el fin de conseguir una liberación controlada de la BMP-2 y así mejorar su acción (45). Para ello, se introdujo daño en el cartílago articular de ratones usando un modelo reversible de osteoartritis. Posteriormente se trató intra-articularmente a los ratones con estos microgeles con la BMP-2, con los microgeles sin la BMP-2 y sólo con la BMP-2. El análisis de las rodillas tras estas inyecciones mostró que las rodillas tratadas con el microgel con la BMP-2 presentaron un menor daño de osteoartritis en comparación con los otros inyectables. Además, éstas presentaban niveles más altos de ARNm que condificaba el colágeno tipo II y los proteoglicanos y una disminución de los niveles de ARNm que codificaba las enzimas que degradan el cartílago y colágeno tipo X. También se consiguieron niveles mejorados de agrecano en el cartílago articular. El trabajo concluyó que el microgel inyectable de perlecan-ácido hialurónico con la BMP-2 constituía una mejora en comparación con los otros inyectables probados para conseguir la estimulación de la matriz del cartílago y, además, éste podía servir como un agente terapéutico para retardar o inhibir el inicio de la osteoartritis después de una lesión de rodilla.
Recientemente, algunos trabajos han mostrado que la terapia génica combinada con técnicas de ingeniería de tejidos relacionadas con la BMP-2 podría ser un enfoque prometedor para la regeneración del cartílago (46). Así, se ha estudiado la relación de la BMP-2 con el gen SOX-9 (considerado uno de los principales factores de transcripción para la condrogénesis). Estos estudios muestran que el uso combinado de ambos componentes mejora las propiedades condrogénicas normales de los condrocitos y la formación de cartílago respecto a considerar ambos individualmente.
3.2. Aplicación de la BMP-2 en odontología
En el campo de la odontología, la cirugía oral se ha visto beneficiada particularmente con la comercialización de esta proteína (13, 14), (47-49). Por ejemplo, se ha observado que la dosis adecuada de la rhBMP-2 es importarte para una aplicación clínica exitosa en el movimiento dental en el hueso (13). Además, se ha analizado la relación de la BMP-2 con otros factores de crecimiento estudiados tradicionalmente en odontología. Por ejemplo, Ilić et al. estudiaron la relación entre los niveles de la BMP-2 y el factor de crecimiento endotelial vascular (VEGF) en la pulpa dental humana (49). Ambos son factores de crecimiento que participan en los eventos celulares relacionados con la curación de la pulpa y es bien sabido que la expresión de los mismos se incrementa en diferentes tejidos en la diabetes. Basándose en esto, los autores intentaron cuantificar los niveles de VEGF y de la BMP-2 en la pulpa dental (de dientes intactos y tratados por recubrimiento pulpar indirecto) de humanos sanos y diabéticos. Los resultados obtenidos mostraron que los niveles de VEGF y de la BMP-2 fueron mayores en la pulpa de los dientes intactos de diabéticos que en los sujetos sanos y estos niveles se redujeron significativamente en los dientes con recubrimiento pulpar indirecto tanto en personas sanas como diabéticas. Además, los niveles de VEGF y BMP-2 mostraron en todos los casos tener una fuerte correlación positiva. Así, se llegó a la conclusión de que estos cambios similares en los niveles de VEGF y de la BMP-2 en los dientes intactos y tratados de pacientes sanos y diabéticos podrían ser un indicativo de las funciones de estos factores de crecimiento en las respuestas de la pulpa dental de personas sanas y diabéticas.
Algunos trabajos han mostrado también la importancia de combinar la BMP-2 con otros compuestos para mejorar resultados en el campo de la odontología (14, 48). Así, por ejemplo, se ha estudiado el potencial de los compuestos de BMP-2 y colágeno para convertirse en materiales para la aplicación en la obliteración mastoidea de rata (48). Los implantes de este compuesto en la mastoides de rata se mostraron capaces de formar hueso nuevo, siendo además éste estable según el análisis histológico y consiguiendo persistir durante un periodo de 24 semanas. Además, no se encontraron reacciones inmunológicas adversas durante el experimento. Por otra parte, Jiang et al. estudian el uso de la BMP-2 como complemento para promover la formación de hueso y la elevación y maduración en el seno maxilar de conejo (14). En su trabajo, se cultivaron células estromales de médula ósea (bMSC) y se transdujeron con adenovirus con la BMP-2 (adBMP-2), con una mejora genética in vitro de la proteína fluorescente verde (AdEGFP). Estas bMSCs autólogas modificadas se combinaron después con beta fosfato tricálcico (beta-TCP) y se utilizan para elevar el seno maxilar en conejos. Los resultados mostraron que los conejos que usaron este compuesto con la BMP-2 mejorada genéticamente presentaban hueso con mayor área ósea que los que sólo usaron beta-TCP o beta-TCP sobre bMSC sin la BMP-2. Además, se detectó una estructura de hueso maduro en el centro del espacio elevado. Así pues, se llegó a la conclusión de que las bMSCs con la adBMP-2 modificada genéticamente podría promover exitosamente la formación de hueso y la maduración en el seno maxilar de conejo. Sin embargo, algunos estudios han demostrado que las combinaciones de la BMP-2 con algunos agentes también pueden producir efectos no deseables, como es el caso de la adición de la rhBMP-2 a Bio-Oss que afectaba de forma negativa sobre la formación de hueso para el aumento del seno maxilar (47).
Conclusiones
En este artículo se realiza una revisión sobre las aplicaciones de la BMP-2, centrando especialmente la atención en los campos de la Traumatología y la Ingeniería Tisular, dos de los ámbitos donde parece más prometedor su uso debido al creciente número de publicaciones en los últimos años.
El uso de la BMP-2 en la cirugía de fracturas abiertas todavía está en una fase temprana de desarrollo. Se ha informado de los buenos resultados obtenidos de su utilización como complemento al enclavado intramedular, aunque su uso junto con la fijación por clavo intramedular fresado parece no ofrecer una mejora significativa. En fracturas graves de tibia su uso es recomendado por numerosos trabajos, indicando un aumento de las tasas de curación sin necesidad de los procedimientos secundarios y reduciendo los costes.
La BMP-2 también se muestra capaz de formar hueso huésped y remodelar el implante que permite la curación de pseudoartrosis, evitando muchas de las infecciones o reacciones alérgicas. El uso combinado de la rhBMP-2 con otras técnicas (como la estabilización intramedular, el procedimiento de Masquelet o la proteína osteoinductiva) parece mejorar la eficacia de los tratamientos, aunque su empleo por separado también ofrece resultados satisfactorios en un menor tiempo comparado con el injerto autólogo de cresta ilíaca.
La utilización de la rhBMP-2 se ha postulado como una alternativa viable al autoinjerto de cresta iliaca en la artrodesis de columna, mostrando una mayor tasa de fusión radiográfica y clínica, entre otras ventajas. Sin embargo, la mayor parte de trabajos sobre el uso de la proteína BMP-2 en fusión lumbar ha mostrado que su utilización puede conllevar eventos adversos, por lo que parece imprescindible que el cirujano de columna evalúe a cada paciente individualmente para determinar la corrección del uso de la BMP-2.
En Ingeniería Tisular, la BMP-2 se presenta como uno de los factores de crecimiento más importantes para promover la regeneración completa del tejido óseo. Entre los trabajos más destacados dentro de este campo están aquellos que estudian la conjugación de la BMP-2 con matrices biocerámicas porosas, los que se centran en el recubrimiento de estas matrices porosas con xerogel de sílice y quitosano, o los estudios sobre la sinergia de determinados geles (como el colágeno, el hialuronato o el de alginato) al ser combinados con la BMP-2 para formar nuevo hueso.
Los enfoques más prometedores que hacen uso de la BMP-2 para la regeneración del cartílago son aquellos que se combinan con la terapia génica que hace uso del gen SOX-9 o junto con microgeles inyectables, o aplican la BMP-2 tras la una fase de expansión realizada por el factor de crecimiento FGF-2. La cirugía oral también se ha visto especialmente beneficiada con el uso de la BMP-2. En este campo, la BMP-2 también se combina con otros elementos para potenciar sus resultados, como son el colágeno o el factor de crecimiento VEGF, aunque existen compuestos cuya combinación con la BMP-2 pueden afectar de forma negativa a la formación del hueso maxilar, como el Bio-Oss.
REFERENCIAS
- Miyazono K, Kamiya Y, Morikawa M. Bone morphogenetic protein receptors and signal transduction. J. Biochem. 2010; 147:35-51.
- Blitz IL, Cho KW. Finding partners: how BMPs select their targets. Dev. Dyn. 2009; 238:1321-31.
- Zimmermann G, Moghaddam A. Allograft bone matrix versus synthetic bone graft substitutes. Injury, Int. J. Care Injured. 2011; 42:S16–S21.
- Mauffrey C, Seligson D, Lichte P, Pape HC, Al-Rayyan M. Bone graft substitutes for articular support and metaphyseal comminution: What are the options? Injury, Int. J. Care Injured. 2011; 42:S35–S39.
- O’Connor MB, Umulis D, Othmer HG, Blair SS. Shaping BMP morphogen gradients in the Drosophila embryo and pupal wing. Development. 2006; 133: 183-93.
- Urist MR. Bone: formation by autoinduction. Science. 1965; 150:893-9.
- Heldin, CH, Miyazono K, Ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature. 1997; 390: 465-71.
- Nishimura R, Kato Y, Chen D, Harris SE, Mundy GR, Yoneda T. Smad5 and DPC4 are key molecules in mediating BMP-2-induced osteoblastic differentiation of the pluripotent mesenchymal precursor cell line C2C12. J. Biol. Chem. 1998; 273:1872-79.
- Cheng H, Jiang W, Phillips FM, et al. Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs). J Bone Joint Surg Am. 2003; 85-A:1544-52.
- Riley EH, Lane JM, Urist MR, Lyons KM, Lieberman JR. Bone morphogenetic protein 2. Biology and applications. Clin Orthop. 1996; 324:39-46.
- Jun SH, Lee EJ, Jang TS, Kim HE, Jang JH, Koh YH. Bone morphogenic protein-2 (BMP-2) loaded hybrid coating on porous hydroxyapatite scaffolds for bone tissue engineering. J Mater Sci Mater Med. 2013; 24(3):773-82.
- Xu XL, Lou J, Tang T, Ng KW, Zhang J, Yu C, Dai K. Evaluation of different scaffolds for BMP-2 genetic orthopedic tissue engineering. J Biomed Mater Res B Appl Biomater. 2005; 75(2):289-303.
- Kawamoto T, Motohashi N, Kitamura A, Baba Y, Suzuki S, Kuroda T. Experimental tooth movement into bone induced by recombinant human bone morphogenetic protein-2. Cleft Palate Craniofac J. 2003; 40(5):538-43.
- Jiang XQ, Sun XJ, Lai HC, Zhao J, Wang SY, Zhang ZY. Maxillary sinus floor elevation using a tissue-engineered bone complex with beta-TCP and BMP-2 gene-modified bMSCs in rabbits. Clin Oral Implants Res. 2009; 20(12):1333-40.
- Martin I, Suetterlin R, Baschong W, Heberer M, Vunjak-Novakovic G, Freed LE. Enhanced cartilage tissue engineering by sequential exposure of chondrocytes to FGF-2 during 2D expansion and BMP-2 during 3D cultivation. J Cell Biochem. 2001; 83(1):121-8.
- Tressler MA, Richards JE, Sofianos D, Comrie FK, Kregor PJ, Obremskey WT. Bone morphogenetic protein-2 compared to autologous iliac crest bone graft in the treatment of long bone nonunion. Orthopedics. 2011; 34(12):877-84.
- Wei S, Cai X, Huang J, Xu F, Liu X, Wang Q. Recombinant human BMP-2 for the treatment of open tibial fractures. Orthopedics. 2012; 35(6):847-54.
- Alt V, Donell ST, Chhabra A, Bentley A, Eicher A, Schnettler R. A health economic analysis of the use of rhBMP-2 in Gustilo-Anderson grade III open tibial fractures for the UK, Germany, and France. Injury. 2009; 40(12):1269-75.
- Forriol F. Proteínas morfogénicas óseas y su aplicación clínica. Rev esp cir ortop traumatol. 2010; 54(Supl 1):2-10.
- Katayama Y, Matsuyama Y, Yoshihara H, et al. Clinical and radiographic outcomes of posterolateral lumbar spine fusion in humans using recombinant human bone morphogenetic protein-2: an average five-year follow-up study. Int Orthop. 2009; 33(4):1061-7.
- Spiro AS, Babin K, Lipovac S, et al. Combined treatment of congenital pseudarthrosis of the tibia, including recombinant human bone morphogenetic protein-2: a case series. J Bone Joint Surg Br. 2011; 93(5):695-9.
- Dohin B, Kohler R. J Child Orthop. Masquelet’s procedure and bone morphogenetic protein in congenital pseudarthrosis of the tibia in children: a case series and meta-analysis. 2012; 6(4):297-306.
- Garrison KR, Shemilt I, Donell S, et al. Bone morphogenetic protein (BMP) for fracture healing in adults. Cochrane Database Syst Rev. 2010; (6):CD006950.
- Aro HT, Govender S, Patel AD, et al. Recombinant human bone morphogenetic protein-2: a randomized trial in open tibial fractures treated with reamed nail fixation. J Bone Joint Surg Am. 2011; 93(9):801-8.
- Mehta V. Bone morphogenetic proteins for tendon injuries: an orthopedic primer. Am J Orthop (Belle Mead NJ). 2005; 34(9):451-4.
- Bostrom M, Lane JM, Tomin E, et al. Use of bone morphogenetic protein-2 in the rabbit ulnar nonunion model. Clin Orthop Relat Res. 1996; 327:272-82.
- Jones NF, Brown EE, Mostofi A, Vogelin E, Urist MR. Healing of a scaphoid nonunion using human bone morphogenetic protein. J Hand Surg Am. 2005; 30(3):528-33.
- Johnson EE, Urist MR. One-stage lengthening of femoral nonunion augmented with human bone morphogenetic protein. Clin Orthop Relat Res. 1998; 347:105-16.
- Johnson EE, Urist MR, Finerman GA. Distal metaphyseal tibial nonunion. Deformity and bone loss treated by open reduction, internal fixation, and human bone morphogenetic protein (hBMP). Clin Orthop Relat Res. 1990; 250:234-40.
- Benglis D, Wang MY, Levi AD. A comprehensive review of the safety profile of bone morphogenetic protein in spine surgery. Neurosurgery. 2008; 62(5 Suppl 2):ONS423-31.
- Singh K, Dumonski M, Stanley T, Ponnappan R, Phillips FM. Repeat use of human recombinant bone morphogenetic protein-2 for second level lumbar arthrodesis. Spine (Phila Pa 1976). 2011; 36(3):192-6.
- Dawson E, Bae HW, Burkus JK, Stambough JL, Glassman SD. Recombinant human bone morphogenetic protein-2 on an absorbable collagen sponge with an osteoconductive bulking agent in posterolateral arthrodesis with instrumentation. A prospective randomized trial. J Bone Joint Surg Am. 2009; 91(7):1604-13.
- Dimar JR 2nd, Glassman SD, Burkus JK, Pryor PW, Hardacker JW, Carreon LY. Clinical and radiographic analysis of an optimized rhBMP-2 formulation as an autograft replacement in posterolateral lumbar spine arthrodesis. J Bone Joint Surg Am. 2009; 91(6):1377-86.
- Even J, Eskander M, Kang J. Bone morphogenetic protein in spine surgery: current and future uses. J Am Acad Orthop Surg. 2012; 20(9):547-52.
- Dmitriev AE, Lehman RA Jr, Symes AJ. Bone morphogenetic protein-2 and spinal arthrodesis: the basic science perspective on protein interaction with the nervous system. Spine J. 2011; 11(6):500-5.
- Carragee EJ, Hurwitz EL, Weiner BK. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J. 2011; 11(6):471-91.
- Hsu WK, Wang JC. The use of bone morphogenetic protein in spine fusion. Spine J. 2008; 8(3):419-25.
- Kaps C, Bramlage C, Smolian H, et al. Bone morphogenetic proteins promote cartilage differentiation and protect engineered artificial cartilage from fibroblast invasion and destruction. Arthritis Rheum 2002; 46:149-62.
- Huang Z, Ren PG, Ma T, Smith RL, Goodman SB. Modulating osteogenesis of mesenchymal stem cells by modifying growth factor availability. Cytokine. 2010; 51:305-10.
- Noel D, Gazit D, Bouquet C, Apparailly F, et al. Short-term BMP-2 expression is sufficient for in vivo osteochondral differentiation of mesenchymal stem cells. Stem Cells. 2004; 22:74-85.
- Shu B, Zhang M, Xie R, et al. BMP2, but not BMP4, is crucial for chondrocyte proliferation and maturation during endochondral bone development. J Cell Sci. 2011; 124:3428-40.
- Chen G, Deng C, Li YP. TGF-beta and BMP signaling in osteoblast differentiation and bone formation. Int J Biol Sci. 2012; 8(2):272-88.
- Jansen JA, Vehof JWM, Ruhe PZ, et al. Growth-factor loaded scaffolds for bone engineering. J Control Release. 2005; 101:127–36.
- Gaalen SV, Kruyt M, Meijer G, et al. Tissue engineering of bone. In: Blitterswijk CV, Thomsen P, Williams D, Hubbell J, Cancedda R, Bruijn JD, et al., editors. editors. Tissue Engineering: United Kingdom; Elsevier Inc; 2008; 559-610.
- Srinivasan PP, McCoy SY, Jha AK, et al. Injectable perlecan domain 1-hyaluronan microgels potentiate the cartilage repair effect of BMP2 in a murine model of early osteoarthritis. Biomed Mater. 2012; 7(2):024109.
- Cha BH, Kim JH, Kang SW, et al. Cartilage tissue formation from dedifferentiated chondrocytes by codelivery of BMP-2 and SOX-9 genes encoding bicistronic vector. Cell Transplant. 2012; 5.
- Kao DW, Kubota A, Nevins M, Fiorellini JP. The negative effect of combining rhBMP-2 and Bio-Oss on bone formation for maxillary sinus augmentation. Int J Periodontics Restorative Dent. 2012; 32(1):61-7.
- Nishizaki K, Tsujigiwa H, Takeda Y, et al. Mastoid obliteration by BMP-2/collagen composites: an experimental study using tissue engineering. Am J Otolaryngol. 2003; 24(1):14-8.
- Ilić J, Radović K, Roganović J, Brković B, Stojić D. The levels of vascular endothelial growth factor and bone morphogenetic protein 2 in dental pulp tissue of healthy and diabetic patients. J Endod. 2012; 38(6):764-8.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Francisca Pulido Albertus. E-mail: paquifriend@hotmail.com