Original
Estudio piloto de tolerabilidad cutánea de láminas de fibrina-agarosa en voluntarios sanos
Pilot study of cutaneous tolerability of fibrin-agarose substitutes in healthy volunteers
Actual. Med. 2016; 101: (799): 171-175 DOI: 10.15568/am.2016.799.or04
Enviado: 01-12-2016
Revisado:14-12-2016
Aceptado: 23-12-2016
RESUMEN
Objetivos: En el presente estudio se persigue comprobar posibles reacciones adversas, derivadas del uso tópico de láminas de fibrina-agarosa en el antebrazo de voluntarios sanos.
Metodología: Se llevó a cabo un estudio experimental en siete voluntarios sanos, cinco varones y dos mujeres, que no presentaban ningún tipo de lesión cutánea visible. En el antebrazo de cada voluntario se colocaron dos láminas de fibrina-agarosa de 4 cm2. Cada lámina se cubrió con un apósito impregnado y sobre una de las láminas se aplicó pomada antibiótica con mupirocina. Ambas láminas se cubrieron finalmente con un apósito protector y se mantuvieron en contacto directo sobre la piel durante 48 horas.
Resultados: Los resultados determinaron que no se detectaron reacciones adversas después de 48 horas de evolución ni en los siguientes 7 días en ningún voluntario. Se observaron diferencias entre las dos láminas implantadas en cada voluntario, ya que al retirar el apósito cubierto con pomada antibiótica, la lámina presentaba un aspecto más hidratado que la que no llevaba pomada antibiótica.
Conclusiones: El uso tópico de las láminas de fibrina-agarosa en voluntarios sanos no presenta reacciones adversas del tipo irritación o alergia al aplicarse directamente por vía tópica. Aunque el tamaño muestral del estudio es limitado, sugiere que la combinación de fibrina-agarosa se presenta como el biomaterial idóneo para el desarrollo de un modelo de piel artificial humana.
Palabras clave: Láminas de fibrina-agarosa, Piel artificial, Tolerabilidad cutánea, Voluntario sano.
ABSTRACT
Purpose: This study aims to analyse possible adverse reactions resulting from the topical use of fibrin-agarose substitutes in the forearm of healthy volunteers.
Methods: An experimental study was carried out in seven healthy volunteers, five males and two females, who did not have any cutaneous lesion. Two fibrin-agarose substitutes of 4 cm2 were placed in the forearm of each volunteer. Each substitute was covered with an impregnated dressing and one of the substitutes was covered with antibiotic ointment (mupirocin). Both substitutes were finally covered with a protective dressing. The substitutes were maintained for 48 hours.
Results: The results determined that no adverse reactions were detected in any volunteer after 48 hours and a week of evolution. Differences were observed between the two substitutes implanted in each volunteer, since when removing the covered dressing with antibiotic ointment, the substitute presented a more hydrated appearance than the one without antibiotic cream.
Conclusions: The implant of fibrin-agarose substitutes in healthy volunteers does not present irritation or allergic type adverse reactions when they applied directly topically on the skin. Although the sample size is low, the fibrin-agarose combination is presented as the biomaterial suitable for the development of an artificial human skin model.
Keywords: Artificial skin, Cutaneous tolerability, Fibrin-agarose substitute, Healthy volunteer.
Leer Artículo Completo
INTRODUCCIÓN
La generación en el laboratorio de sustitutos tisulares que reproduzcan la estructura y la histología del tejido nativo hace necesario combinar el componente celular con biomateriales. Los biomateriales pueden ser de origen natural o sintético y su función es sustituir la matriz extracelular del tejido a reparar.
En ingeniería de tejidos (1)(2), es de vital importancia que el biomaterial permita la proliferación del componente celular en su interior y/o en su superficie. La elección del biomaterial óptimo está fuertemente condicionada al cumplimiento de unos estrictos controles de calidad indicados a continuación:
- Biocompatible: el biomaterial debe integrarse en el individuo receptor sin provocar daños o reacciones adversas.
- Biodegradable: el biomaterial debe ser químicamente estable o inerte.
- No tóxico: el biomaterial debe presentar ausencia de toxicidad o efectos secundarios.
- Resistente: el biomaterial debe cumplir los requerimientos biomecánicos establecidos para desarrollar correctamente su función en el individuo receptor; adecuada resistencia mecánica, elasticidad, etcétera.
- Fácilmente reproducible: el diseño, el tamaño y la forma deben ser los adecuados.
La utilización de biomateriales naturales representa la mejor alternativa como base para el diseño de sustitutos tridimensionales con fines terapéuticos, tanto en ingeniería de tejidos como en cirugía reconstructiva. Este tipo de productos se caracteriza por poseer propiedades físicas y químicas que se asemejan al tejido nativo y han sido ampliamente utilizados en el desarrollo de sustitutos de piel. Para generar un modelo de piel humana artificial (3)(4)(5), es necesario desarrollar un sustituto de estroma dérmico con fibroblastos humanos inmersos en su interior (6) y posteriormente, cultivar los queratinocitos en la parte superior (7)(8).
El polímero natural más utilizado es el colágeno (9–11), componente mayoritario del tejido conjuntivo. El colágeno se caracteriza por poseer elevada fuerza tensil (12), promover la formación de agregados, retener el agua y facilitar la formación de geles. Además, biológicamente, favorece la adhesión celular, interacciona con plaquetas y produce la activación de los componentes del sistema de coagulación sanguínea (13).
Los derivados sanguíneos (14), se presentan como el biomaterial biológico idóneo para formar parte de la composición del andamiaje, por su facilidad de obtención y la posibilidad de obtener equivalentes autólogos (15). La fibrina utilizada como biomaterial tiene propiedades similares al colágeno (16). En condiciones fisiológicas, la reparación tisular de un tejido dañado se inicia con la formación de una compleja red proteica a base de fibrina en la zona afectada. Los sustitutos de fibrina (17) se caracterizan por promover la proliferación y la adhesión celular y facilitar la correcta distribución de las células en la estructura tridimensional (18)(19).
Aunque la utilización de la fibrina como biomaterial supuso un gran avance, la adaptación clínica de este tipo de sustitutos presenta limitaciones basadas en su escasa consistencia y resistencia que dificulta su manipulación e implante. Por esta razón, se hace necesario combinar la fibrina con algún polisacárido que aporte consistencia y resistencia al sustituto tisular. Uno de los sustitutos de tejido más consistentes es aquel que combina el uso de fibrina con la agarosa tipo VII. La agarosa es un polisacárido formado por galactosas alfa y beta que se extrae de algas de los géneros Gellidium y Gracillaria. Por lo tanto, la agarosa es un producto natural que facilita la formación de una matriz inerte y no tóxica.
Hasta el momento, la combinación de fibrina-agarosa como biomaterial ha sido utilizada para el desarrollo de un modelo tridimensional de córnea (20)(21)(22)(23), de mucosa oral (24)(25)(26)(27)(28), de cartílago (29) y más recientemente de piel (30).
La limitación con la que nos hemos encontrado en el proceso de traslación a clínica humana de este modelo de piel humana creada por ingeniería de tejidos, es que un sustituto que contenga en su composición fibrina-agarosa nunca ha sido aplicado tópicamente en humanos. Por esta razón, el objetivo de este trabajo es comprobar que no existen reacciones adversas de tipo irritativo o alérgico al implantar tópicamente láminas de fibrina-agarosa en voluntarios sanos, poniendo de manifiesto la tolerabilidad cutánea de esta combinación de biomateriales.
METODOLOGÍA
1. Elaboración de las láminas de fibrina-agarosa sin células
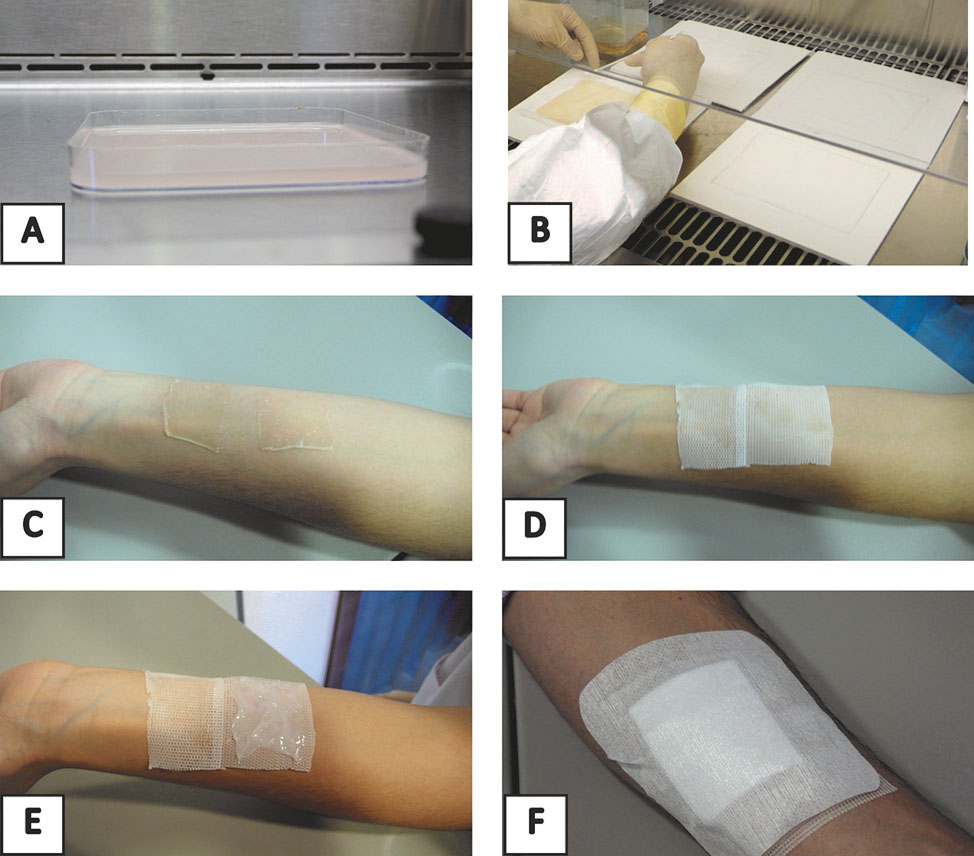
Las láminas de fibrina-agarosa sin células se elaboraron en el laboratorio de control de calidad de la Unidad de Producción Celular e Ingeniería Tisular del Complejo Hospitalario Universitario de Granada utilizando placas de cultivo de 144 cm2 (Greiner bio-one Hungary Kft., Hungría). Las láminas se generaron usando una mezcla de fibrina humana a partir de plasma congelado AB+ y 0,1% de agarosa de tipo VII (Sigma) en agua destilada. Para establecer el estroma dérmico, se añadieron 41,6 ml de plasma humano a 3,35 ml de medio de cultivo específico para fibroblastos dérmicos (MF). La mezcla se suplementó con 830 μl de ácido tranexámico (Amchafibrin, Rottapham, España) para prevenir la fibrinólisis. Para inducir la polimerización de fibrina se añadieron 1 ml de CaCl2 (Braun Medical, España 10 mg / ml) y 720 µl de agua estéril (Fresenius Kabi), seguido de la adición inmediata de 2,5 ml de agarosa concentrada (2,2% en agua destilada) fundida a 37 – 38°C. La concentración final de agarosa en el estroma dérmico fue 0,1%. Finalmente, los 50 ml de mezcla se añadieron en las placas de cultivo de 144 cm2 y se dejaron solidificar a 37°C durante 2 horas (Figura 1-A). Después de dos horas, se añadieron 25 ml de MF.
Las láminas de fibrina-agarosa se mantuvieron durante un día a 37°C con 5% de CO2.
2. Nanoestructuración de las láminas de fibrina-agarosa sin células
Un día después del proceso de fabricación, las láminas de fibrina-agarosa se despegaron de la placa de cultivo, para promover su deshidratación mediante el proceso de nanoestructuración (Figura 1-B).
El proceso de nanoestructuración consistió en colocar la lámina de fibrina-agarosa sobre una superficie de nanoestructuración inferior compuesta por papel absorbente (Thermo Scientific) y malla de 100 µm (Millipore) y 11 µm (Millipore). En la parte superior de la lámina fibrina-agarosa se colocó un tul, y sobre el tul, la superficie de nanoestructuración superior compuesta por malla de 11 µm y 100 µm y papel absorbente. Durante un tiempo concreto se colocó un peso de 300 g en la superficie de nanoestructuración para provocar el alineamiento de las fibras del estroma dérmico y la pérdida de grosor de la lámina.
3. Colocación de las láminas de fibrina-agarosa sin células en voluntarios sanos
Para realizar la colocación en los voluntarios sanos, las láminas de fibrina-agarosa se dividieron en fragmentos de 4 cm2. A cada voluntario se le implantaron dos fragmentos en el antebrazo izquierdo (Figura 1-C). Ambas láminas (Figura 1-D) se cubrieron con un apósito impregnado (Linitul ®) y una de las láminas (Figura 1-E) se cubrió con pomada antibiótica (Mupirocina 20 mg/g, Isdin ®). Finalmente, las dos láminas implantadas en el antebrazo se cubrieron con un apósito protector (Figura 1-F). Todos los voluntarios fueron informados sobre los posibles efectos secundarios asociados con la colocación de la lámina así como del protocolo de seguimiento del estudio.
Figura 1. Resumen gráfico del proceso metodológico. (A) Elaboración de la lámina de fibrina-agarosa. (B) Nanoestructuración de la lámina de fibrina-agarosa. (C) Colocación de dos láminas de fibrina-agarosa de 4 cm2 en el antebrazo de voluntarios sanos. (D) Cobertura de las láminas de fibrina-agarosa con un apósito impregnado Linitul. (E) Cobertura de una de las láminas de fibrina-agarosa con pomada antibiótica Mupirocina. (F) Cobertura final de la zona de implante con un apósito protector.
4. Evaluación post-implante de las láminas de fibrina-agarosa
Las láminas de fibrina-agarosa se mantuvieron en contacto con la piel de los voluntarios sanos durante 48 horas. Pasado este tiempo, se retiró el apósito protector, el apósito impregnado y las láminas de fibrina-agarosa. Finalmente, se procedió a la evaluación de la zona de implante por un dermatólogo especialista a las 48 horas tras el implante y a la semana. Se consideraron las siguientes variables a evaluar: eritema, edema, descamación, vesiculación y aumento de temperatura local en una escala del 0-4 (0=ausencia; 1=reacción leve; 2=reacción moderada y 4=reacción evidente). También se evaluó la presencia de prurito y dolor mediante una escala analógica visual (0-10).
RESULTADOS
Evaluación post-implante de las láminas de fibrina-agarosa
En este estudio participaron siete voluntarios sanos, sin ningún tipo de lesión cutánea visible en la zona donde se realizó la colocación de la lámina ni presencia de antecedentes personales de interés ni alergia a fármacos. En la tabla siguiente se detalla la edad y el sexo de los participantes en el estudio.
En los siete voluntarios sanos, no se observó ningún signo clínico de irritación o alergia cutánea, ni presencia de prurito, dolor (puntuación de 0 en todos los casos en la escala) ni otra sintomatología cutánea o sistémica a las 48 horas. La evaluación de eritema, edema, descamación o vesiculación fue negativa (puntuación de 0 en la escala) en todos los sujetos del estudio. En los 7 días posteriores a la retirada de las láminas se continuó haciendo seguimiento de los voluntarios que participaron en el estudio, sin observar ningún tipo de reacción adversa.
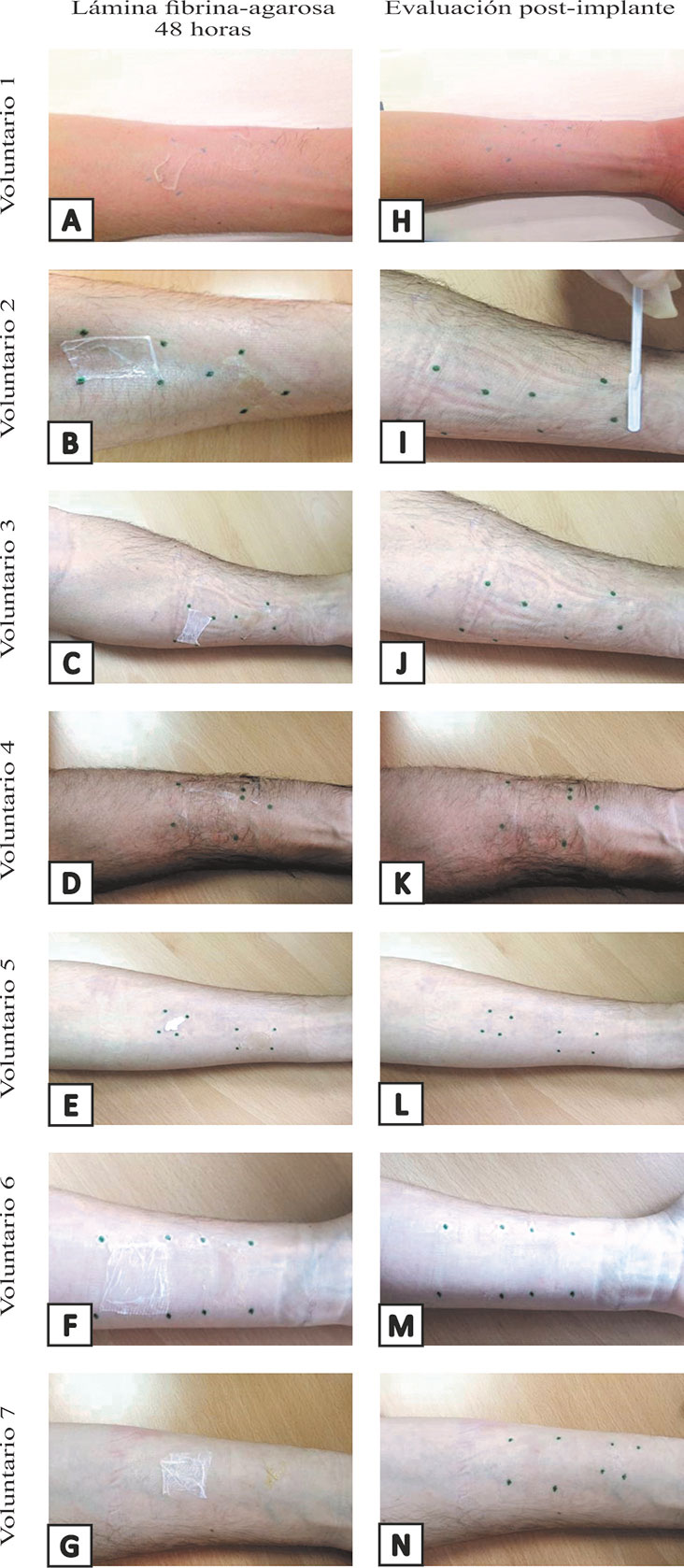
Después de 48 horas tras la colación de la lámina, se observaron diferencias entre las dos láminas implantadas en cada voluntario. La lámina de fibrina-agarosa que había sido cubierta con pomada antibiótica presentaba un aspecto más hidratado y mejor adhesión a la piel que la lámina que había sido directamente cubierta con el apósito impregnado (Figura 2).
Figura 2. Evaluación post-implante en los siete voluntarios sanos que han participado en el estudio de tolerabilidad cutánea. (A-G) Aspecto de las láminas de fibrina-agarosa 48 horas después de la colocación. (H-N) Aspecto de la zona de implante.
DISCUSIÓN Y CONCLUSIÓN
El tipo y el grado de sofisticación de los biomateriales evoluciona a través de la ciencia de los materiales, la matriz extracelular del tejido y la biología celular. Sin embargo, el logro de la traslación clínica y el éxito comercial requiere de biomateriales regenerativos que no sólo sean eficaces y seguros, sino también rentables y compatibles para que la producción sea fácilmente reproducible y favorecer la aplicación.
La búsqueda de sustitutos tisulares seguros y eficaces ha supuesto un esfuerzo continuo en cirugía plástica y estética en las últimas décadas. La bioseguridad es un requisito previo para cualquier sustancia que se utiliza como material de implante.
En este sentido, para el desarrollo de modelos de regeneración tisular en investigación clínica cabe destacar el uso de la agarosa como biomaterial ya que se ha demostrado ampliamente su bioseguridad. Se ha comprobado que este polisacárido es compatible para la adaptación de nanopartículas en cirugía reconstructiva (31), y también es biodegradable en combinación con chitosán y gelatina (32). Los geles de agarosa se han utilizado con éxito como relleno absorbible para el aumento de labios (33) así como para el tratamiento de defectos condrales y osteocondrales en combinación con el alginato (34).
En este estudio, se ha comprobado que la lámina de fibrina-agarosa tras ser aplicada directamente sobre la piel en un ambiente húmedo suplementado con pomada antibiótica muestra una mejor hidratación y adhesión al lecho que en los casos en los que no se ha utilizado la aplicación de la pomada. El asegurar un lecho hidratado y una cura apropiada en los pacientes que se traten con láminas de fibrina-agarosa será muy importante para mantener las propiedades de la misma.
Como limitación de este estudio resalta el reducido tamaño muestral y aunque los resultados preliminares han mostrado que las láminas de fibrina-agarosa nanoestructuradas son bien toleradas utilizadas tópicamente la información obtenida del seguimiento de los pacientes tratados con este biomaterial será muy útil para confirmar la bioseguridad.
En este sentido, el implante de las láminas de fibrina-agarosa en voluntarios sanos no presenta reacciones cutáneas adversas del tipo irritación o alergia al aplicarse directamente por vía tópica después de 48 horas y tras una semana de evolución. Por lo tanto, podemos concluir que la combinación de fibrina-agarosa se presenta como el biomaterial idóneo, desde el punto de vista de la tolerabilidad para el desarrollo de un modelo de piel artificial humana creada por ingeniería de tejidos.
REFERENCIAS
- Langer R, Vacanti JP. Tissue engineering. Science. 1993;260(5110):920–6.
- Bhat ZF, Bhat H, Pathak V. Principles of Tissue Engineering. Principles of Tissue Engineering. 2014. 1663-1683 p.
- Black AF, Bouez C, Perrier E, Schlotmann K, Chapuis F, Damour O. Optimization and Characterization of an Engineered Human Skin Equivalent. Tissue Eng. 2005;11(5-6):723–33.
- Larouche D, Paquet C, Fradette J, Carrier P, Auger FA, Germain L. Regeneration of skin and cornea by tissue engineering. Methods Mol Biol. 2009;482:233–56.
- Bell E, Ehrlich HP, Buttle DJ, Nakatsuji T. Living tissue formed in vitro and accepted as skin-equivalent tissue of full thickness. Science. 1981;211(4486):1052–4.
- Lamme EN, Van Leeuwen RTJ, Brandsma K, Van Marie J, Middelkoop E. Higher numbers of autologous fibroblasts in an artificial dermal substitute improve tissue regeneration and modulate scar tissue formation. J Pathol. 2000;190(5):595–603.
- MacNeil S. Progress and opportunities for tissue-engineered skin. Nature. 2007;445(7130):874–80.
- Supp DM, Boyce ST. Engineered skin substitutes: Practices and potentials. Clin Dermatol. 2005;23(4):403–12.
- Cen L, Liu W, Cui L, Zhang W, Cao Y. Collagen tissue engineering: Development of novel biomaterials and applications. Pediatric Research. 2008. p. 492–6.
- Parenteau-Bareil R, Gauvin R, Berthod F. Collagen-based biomaterials for tissue engineering applications. Materials (Basel). 2010;3(3):1863–87.
- Glowacki J, Mizuno S. Collagen scaffolds for tissue engineering. Biopolymers. 2008;89(5):338–44.
- Chevallay B, Herbage D. Collagen-based biomaterials as 3D scaffold for cell cultures: applications for tissue engineering and gene therapy. Med Biol Eng Comput. 2000;38(2):211–8.
- Lee CH, Singla A, Lee Y. Biomedical applications of collagen. Int J Pharm. 2001;221(1-2):1–22.
- Burnouf T, Su C-Y, Radosevich M, Goubran H, El-Ekiaby M. Blood-derived biomaterials: fibrin sealant, platelet gel and platelet fibrin glue. Isbt Sci Ser Vol 4, No 1, State Art Present. 2009;4:136–42.
- Burnouf T, Goubran HA, Chen T-M, Ou K-L, El-Ekiaby M, Radosevic M. Blood-derived biomaterials and platelet growth factors in regenerative medicine. Blood Rev. 2013 Mar;27(2):77–89.
- Grassl ED, Oegema TR, Tranquillo RT. Fibrin as an alternative biopolymer to type-I collagen for the fabrication of a media equivalent. J Biomed Mater Res. 2002;60(4):607–12.
- Ahmed TAE, Dare E V, Hincke M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Eng Part B Rev. 2008;14(2):199–215.
- Jockenhoevel S, Zund G, Hoerstrup SP, Chalabi K, Sachweh JS, Demircan L, et al. Fibrin gel – advantages of a new scaffold in cardiovascular tissue engineering. Eur J Cardio-thoracic Surg. 2001;19(4):424–30.
- Li Y, Meng H, Liu Y, Lee BP. Fibrin gel as an injectable biodegradable scaffold and cell carrier for tissue engineering. Scientific World Journal. 2015.
- Alaminos M, Sánchez-Quevedo MDC, Muñoz-Ávila JI, Serrano D, Medialdea S, Carreras I, et al. Construction of a complete rabbit cornea substitute using a fibrin-agarose scaffold. Investig Ophthalmol Vis Sci. 2006;47(8):3311–7.
- Ionescu AM, Alaminos M, Cardona J de la C, García-López Durán J de D, González-Andrades M, Ghinea R, et al. Investigating a novel nanostructured fibrin-agarose biomaterial for human cornea tissue engineering: Rheological properties. J Mech Behav Biomed Mater. 2011;4(8):1963–73.
- De J, Cardona C, Ionescu AM, Go R, Gonza M, Campos A, et al. Transparency in a fibrin and fibrin-agarose corneal stroma substitute generated by tissue engineering. Cornea. 2011;30(12):1428–35.
- Garzón I, Martín-Piedra MA, Alfonso-Rodríguez C, Gonźalez-Andrades M, Carriel V, Martínez-Gómez C, et al. Generation of a biomimetic human artificial cornea model using wharton’s jelly mesenchymal stem cells. Investig Ophthalmol Vis Sci. 2014;55(7):4073–83.
- Sanchez-Quevedo MC, Alaminos M, Capitan LM, Moreu G, Garzon I, Crespo P V., et al. Histological and histochemical evaluation of human oral mucosa constructs developed by tissue engineering. Histol Histopathol. 2007;22(4-6):631–40.
- Garzón I, Sánchez-Quevedo MC, Moreu G, González-Jaranay M, González-Andrades M, Montalvo A, et al. In vitro and in vivo cytokeratin patterns of expression in bioengineered human periodontal mucosa. J Periodontal Res. 2009;44(5):588–97.
- Garzon I, Serrato D, Roda O, Del Carmen Sánchez-Quevedo M, González-Jaranay M, Moreu G, et al. In vitro cytokeratin expression profiling of human oral mucosa substitutes developed by tissue engineering. Int J Artif Organs. 2009;32(10):711–9.
- Rodríguez IA, López-López MT, Oliveira ACX, Sánchez-Quevedo MC, Campos A, Alaminos M, et al. Rheological characterization of human fibrin and fibrin-agarose oral mucosa substitutes generated by tissue engineering. J Tissue Eng Regen Med. 2012;6(8):636–44.
- Ionescu AM, Cardona JC, Garzón I, Oliveira AC, Ghinea R, Alaminos M, et al. Integrating-sphere measurements for determining optical properties of tissue-engineered oral mucosa. J Eur Opt Soc. 2015;10.
- Miyata S, Tateishi T, Ushida T. Influence of cartilaginous matrix accumulation on viscoelastic response of chondrocyte/agarose constructs under dynamic compressive and shear loading. J Biomech Eng. 2008;130(5):051016.
- Carriel V, Garzón I, Jiménez JM, Oliveira ACX, Arias-Santiago S, Campos A, et al. Epithelial and stromal developmental patterns in a novel substitute of the human skin generated with fibrin-agarose biomaterials. Cells Tissues Organs. 2012;196(1):1–12.
- Biradar S, Goornavar V, Periyakaruppan A, Koehne J, Hall JC, Ramesh V. Agarose gel tailored calcium carbonate nanoparticles-synthesis and biocompatibility evaluation. J Nanosci Nanotechnol. 2014;14(6):4257–63.
- Shakya AK, Holmdahl R, Nandakumar KS, Kumar A. Polymeric cryogels are biocompatible, and their biodegradation is independent of oxidative radicals. J Biomed Mater Res – Part A. 2014;102(10):3409–18.
- Scarano A, Carinci F, Piattelli A. Lip augmentation with a new filler (agarose gel): a 3-year follow-up study. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. 2009.
- Selmi T a S, Verdonk P, Chambat P, Dubrana F, Potel J-F, Barnouin L, et al. Autologous chondrocyte implantation in a novel alginate-agarose hydrogel: outcome at two years. J Bone Joint Surg Br . 2008;90(5):597–604.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Ana Fernández González. Unidad de Producción Celular e Ingeniería Tisular. Instituto de Investigación Biosanitaria de Granada. Complejo Hospitalario Universitario de Granada Teléfono: 958 020 749 Email: ana.fernandez.gonzalez.exts@juntadeandalucia.es