Original
Evaluación de la densidad ósea en defectos óseos palatinos tras injerto de tejido óseo generado mediante ingeniería tisular en conejos
Evaluation of bone density in palatine bone defects after grafting of bone generated by tissue engineering in rabbits
Actual. Med. Actual. Med. 2017; 102: (800): 13-17 DOI: 10.15568/am.2017.800.or02
Enviado: 24-02-2017
Revisado:15-04-2017
Aceptado:21-04-2017
RESUMEN
Objetivos. Se pretende determinar mediante TAC la densidad ósea tras la utilización de injertos óseos autólogos artificiales generados mediante ingeniería tisular y determinar la utilidad in vivo de estos materiales.
Métodos. Se han utilizado 12 conejos machos (New Zeland White) de 3 semanas de edad. Se generó hueso a partir de células madre mesenquimales del tejido adiposo a las que, tras cultivo y expansión, se indujo diferenciación a la estirpe osteogénica y se combinaron con biomateriales de fibrina y agarosa. Este sustituto óseo fue injertado de forma autóloga en los animales de experimentación. Se establecieron tres grupos de estudio: Grupo I: se crea defecto óseo de 4mm y se implanta el tejido óseo autólogo cubriendo con colgajo mucoperióstico. Grupo II: Como control negativo, se realiza el mismo procedimiento, pero sin implantar tejido óseo. Grupo III: Como control positivo, conejos a los que no se realiza ningún procedimiento.
Se estudió la densidad ósea a los 6 meses tras el implante mediante tomografía computerizada, expresadas en unidades Hounsfield, comparando ambos hemipaladares (lado intervenido y lado control)
Resultados. En el grupo III control positivo, la densidad ósea era similar en ambos hemipaladares (p>0’05). Por el contrario, en el grupo II controles negativos, se observó una diferencia estadísticamente significativa en la densidad del hueso palatino derecho frente al izquierdo (p<0’05). En el grupo I. no se observaron diferencias estadísticamente significativas entra ambos lados del paladar (p>0’05).
Conclusión. La tomografía computerizada y el análisis de los datos en unidades Hounsfield, sugiere que el tejido óseo generado por ingeniería tisular contribuye a mejorar la calidad y densidad ósea en defectos óseos palatinos creados en conejos de laboratorio.
Palabras clave: Densidad ósea, ingeniería tisular, cirugía experimental, tejido óseo, fisura labiopalatina.
ABSTRACT
Purpose. We have carried out a study to determine the bone density after using artificial autologous bone grafts generated by tissue engineering by means of computed tomography, and to determine the in vivo usefulness of these biomaterials.
Methods. Twelve 3-week-old New Zeland White male rabbits were used in this study. Bone substitutes were generated by using adipose tissue mesenchymal stem cells. After culture and expansion, osteogenic differentiation was induced and cells were combined with fibrin-agarose biomaterials. This bone substitute was autologously grafted in experimental animals. Three study groups were established: Group I: a 4mm bone defect was created and the autologous bone tissue was implanted, covered by a mucoperiosteal flap. Group II: as a negative control, the same procedure was performed, but without implanting bone tissue. Group III: as a positive control, native non-operated rabbits were used.
Bone density was studied 6 months after implantation by using computed tomography, expressed in Hounsfield units, and both sides of the palate -operated and control side- were compared.
Results. In group III -positive control-, the bone density was similar in both sides of the palate (p>0.05). In contrast, negative controls corresponding to group II showed a statistically significant bone density difference between the right and the left palate (p<0.05). No statistically significant differences were observed between both sides of the palate in group I (p>0.05).
Conclusion. Computed tomography and data analysis in Hounsfield units suggest that grafting tissue-engineered bone substitutes contributes to improved bone quality and density in palatal bone defects created in laboratory rabbits.
Keywords: Bone density, tissue engineering, experimental surgery, bone tissue, cleft lip and palate.
Leer Artículo Completo
INTRODUCCIÓN
La fisura palatina es una malformación congénita frecuente del área craneofacial, siendo su incidencia alrededor de 1 cada 700 nacidos vivos (1). Hasta el momento se han desarrollado multitud de técnicas quirúrgicas para su corrección; en un primer tiempo quirúrgico se realizan colgajos mucoperósticos para aislar la cavidad oral de la cavidad nasal y recolocar la musculatura palatina con el fin de mejorar la fonación y deglución. Posteriormente es necesaria la aportación de tejido óseo a nivel de la fisura alveolar, si esta está presente (alveoloplastia) (2). El uso de injertos óseos mejora los resultados quirúrgicos y permite alcanzar una estética y una función adecuada (3-5). Los injertos óseos cierran la comunicación oronasal, dan soporte al cartílago alar, estabilizan una morfología alveolar adecuada, dan continuidad al arco maxilar y permiten dar soporte a dientes adyacentes facilitando la manipulación ortodóncica, la erupción dental o una rehabilitación protésica posterior cuando estas sean necesarias (2, 6, 7).
Para la obtención de hueso para llevar a cabo la alveoloplastia, se han descrito múltiples zonas donantes de hueso autólogo, siendo el injerto de cresta iliaca el más popular (3-5). La incidencia de complicaciones con esta técnica es baja, aunque no está exenta de efectos adversos como dolor, hematomas o seromas en la región donante, y conlleva un aumento de la estancia hospitalaria (8-12). Esto nos lleva a la búsqueda de técnicas alternativas, menos invasivas, con el fin de evitar la morbilidad en la zona donante. Se ha descrito el uso de diferentes opciones como materiales aloplásticos, xenoinjertos, etc. Estos materiales presentan una serie de riesgos y complicaciones (transmisión de infecciones, respuesta inmunológica, fístulas oronasales…) y además, no son recomendables en pacientes en periodo de crecimiento, cuando van a erupcionar piezas dentales, o si van a ser necesarios movimientos ortodóncicos (3, 10, 13-16).
En los últimos años ha habido un gran avance en el campo de la ingeniería tisular, lo que ha permitido la creación de múltiples tejidos (cornea, piel, mucosa oral, urotelio, tejido óseo, etc.) a partir de pequeñas biopsias de los tejidos que se quieren reproducir o de células madre de origen mesenquimal (13, 17-19). Estudios realizados en animales de experimentación, sugieren que el tejido óseo obtenido mediante ingeniería tisular puede ser una alternativa válida para el tratamiento de pacientes con defectos palatinos (20-23).
En este trabajo se ha realizado un estudio de experimentación básica en animales de laboratorio, para valorar la densidad ósea tras la utilización de injertos óseos autólogos artificiales generados mediante ingeniería tisular y determinar la utilidad in vivo de estos materiales aplicando un nuevo método basado en tomografía computerizada y unidades Hounsfield.
MATERIAL Y MÉTODOS
Animales de experimentación.
En este estudio hemos utilizado 12 conejos machos (New Zeland White) de 3 semanas de edad y entre 400 y 500 gramos (momento del destete). Todos los animales fueron mantenidos en la Unidad Experimental del Complejo Hospitalario Universitario de Granada, con libre acceso a comida y agua. El estudio fue aprobado por el comité de ética local, y se ajustó al reglamento sobre experimentación animal, siguiendo la regla de las tres R (24).
Generación de tejido óseo.
Para la generación de un sustituto de hueso palatino, en primer lugar, se obtuvieron cultivos de células madre mesenquimales del tejido adiposo de cada animal de experimentación.
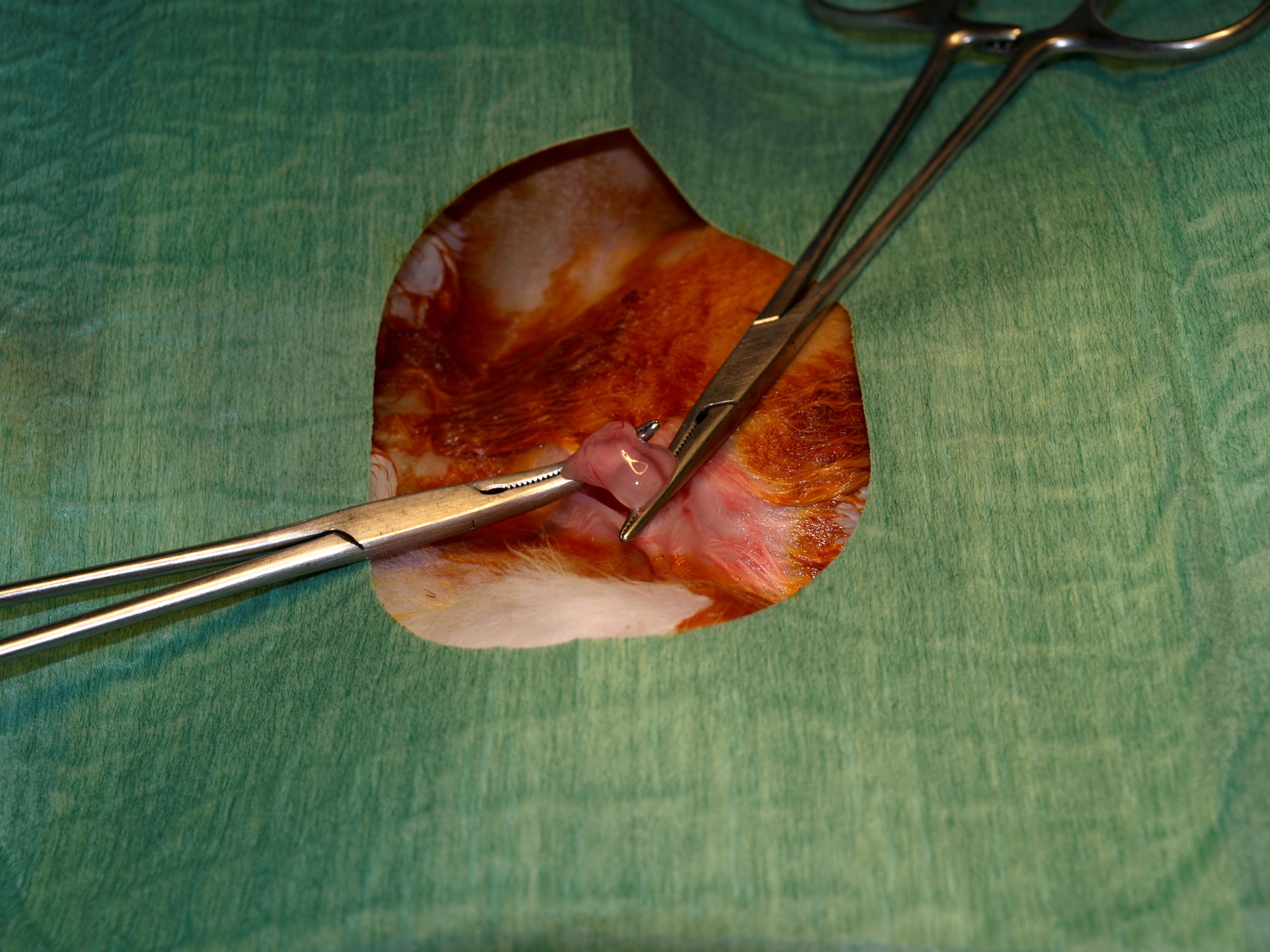
Para ello a las 3-4 semanas de vida del conejo (destete) se tomaron dos biopsias de 1x1cm del tejido adiposo a nivel de ambos pliegues inguinales bajo anestesia general y local, suturando con material reabsorbible (Safil® 4/0). La anestesia general fue administrada utilizando inyección intramuscular de Ketamina y Xilazina, y para la local infiltración con Bupivacaina 0,25% sin vasoconstrictor (Figura 1). Tras la toma, las muestras fueron introducidas en medio de transporte estéril compuesto por medio de cultivo RPMI suplementado con antibióticos (500U/ml de penicilina y 500μg/ml de estreptomicina) y antimicóticos (1,25μg/ml de anfotericina B) para evitar contaminación de la muestra, y mantenidas a 4ºC hasta su procesamiento.
Figura 1. Toma de biopsia de grasa a nivel del pliegue inguinal del conejo.
Estas muestras obtenidas se lavaron con PBS y se digirieron enzimáticamente en una solución de 2mg/ml de colagenasa I de Clostridium hystoliticum, para la obtención de cultivos celulares de células madres mesenquimales de origen adiposo. Estos cultivos se mantuvieron en medio de Dullbecco (DMEM) suplementado con suero bovino fetal al 10% (FCS), según la técnica descrita por Nieto-Aguilar et al, 2011 (17).
Una vez subconfluentes, se tripsinizaron los cultivos celulares y se combinaron con biomateriales de fibrina y agarosa 0’1% (aproximadamente 175000 células/ml), previamente descritos por el grupo de investigación de ingeniería tisular (20), utilizándose ácido tranexámico, como agente inhibidor de la fibrinolisis, y cloruro cálcico como inductor de la gelificación del biomaterial. Tras ello se alicuotó la mezcla en placas de cultivo de 6 pocillos que se incubaron a 37ºC durante 24 horas hasta su total solidificación. Para inducir la diferenciación de estas células hacia la estirpe osteogénica y generar un tejido óseo artificial, los constructos se cultivaron en un medio inductor específico compuesto de DMEM suplementado con 10% de FCS, 100nM de dexametasona, 10nM β-glicerol-fosfato y 50mML de ácido ascórbico durante 21 días, como describió Nieto-Aguilar (17). Una vez transcurrido el periodo de diferenciación se extrajeron los tejidos artificiales de las superficies de cultivo y se sometieron a compresión plástica (nanoestructuración) utilizando un biorreactor específico según lo descrito (20). Posteriormente se implantaron en los animales de experimentación de forma autóloga.
Implante in vivo y grupos de estudio.
De forma aleatoria, a las 7-8 semanas de vida, dividimos los conejos en 3 grupos:
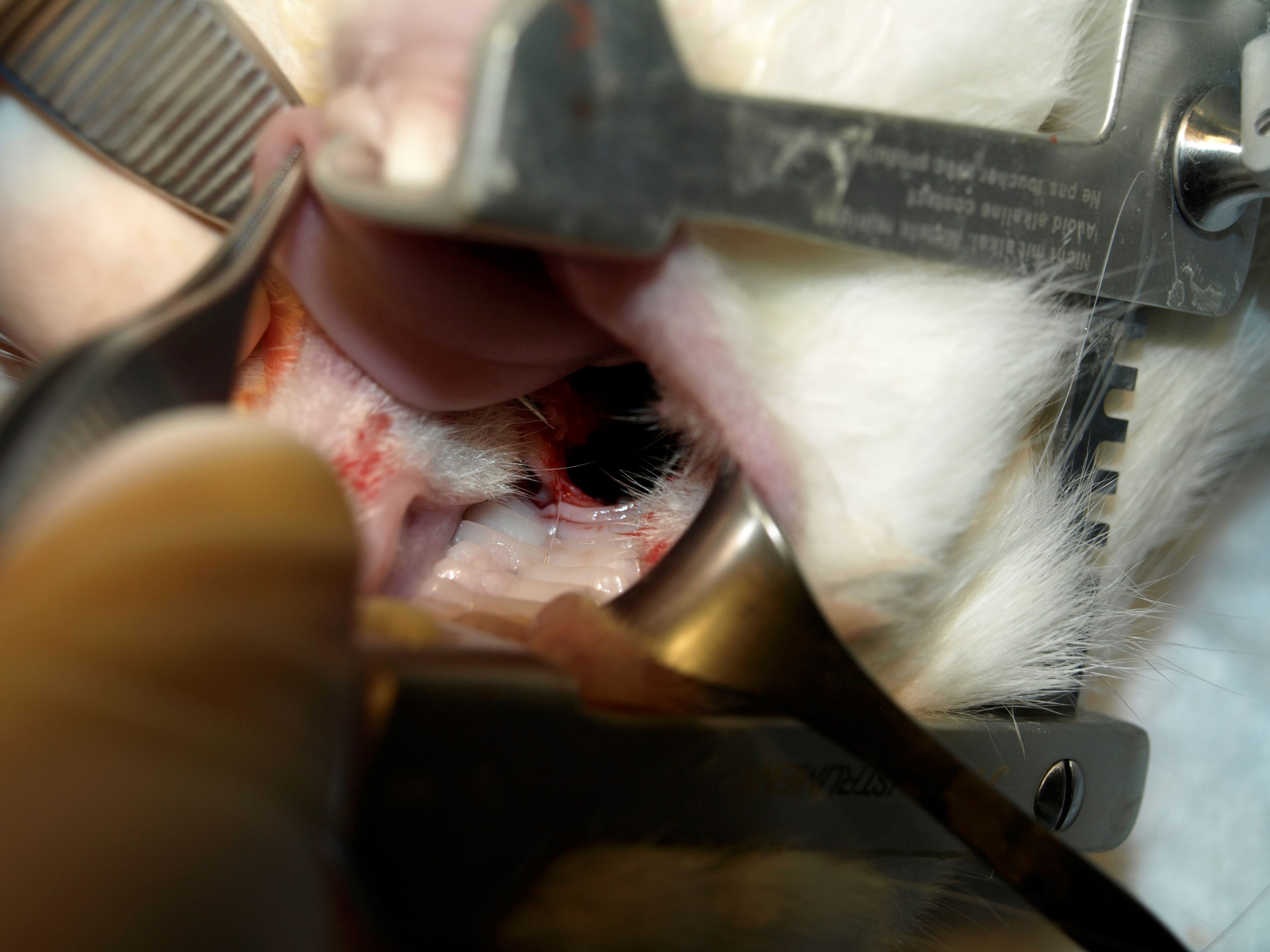
- Grupo I. En un primer grupo, bajo anestesia general, elevamos colgajo mucoperióstico y creamos defectos óseos de 4mm a nivel del segundo molar en el lado derecho mediante fresa de trefina. Posteriormente implantamos el tejido óseo autólogo obtenido por ingeniería tisular, y cubrimos con el colgajo mucoperióstico y cerramos con puntos sueltos de sutura reabsorbible (Safil® 5/0). (Figura 2)
- Grupo II. Como controles negativos, en un segundo grupo de conejos, realizamos el mismo procedimiento, pero sin material implantado tras la creación del defecto óseo.
- Grupo III. Como grupo control positivo, se estudiaron conejos sin defecto creado, no realizándoles ningún procedimiento quirúrgico en el paladar.
En las dos semanas posteriores a la cirugía la alimentación de todos los grupos de estudio fue mediante alimento gelificado. Se administró analgesia postoperatoria en el agua de bebida con Metamizol.
A los 6 meses del implante se sacrificaron los animales de estudio, mediante inyección de cloruro potásico, tras someterlos a anestesia general con Ketamina y Xilacina.
Figura 2. Elevación de colgajo mucoperióstico y defecto óseo creado con fresa de trefina de 4 mm en el hemipaladar derecho a nivel del segundo molar.
Análisis de densidad ósea.
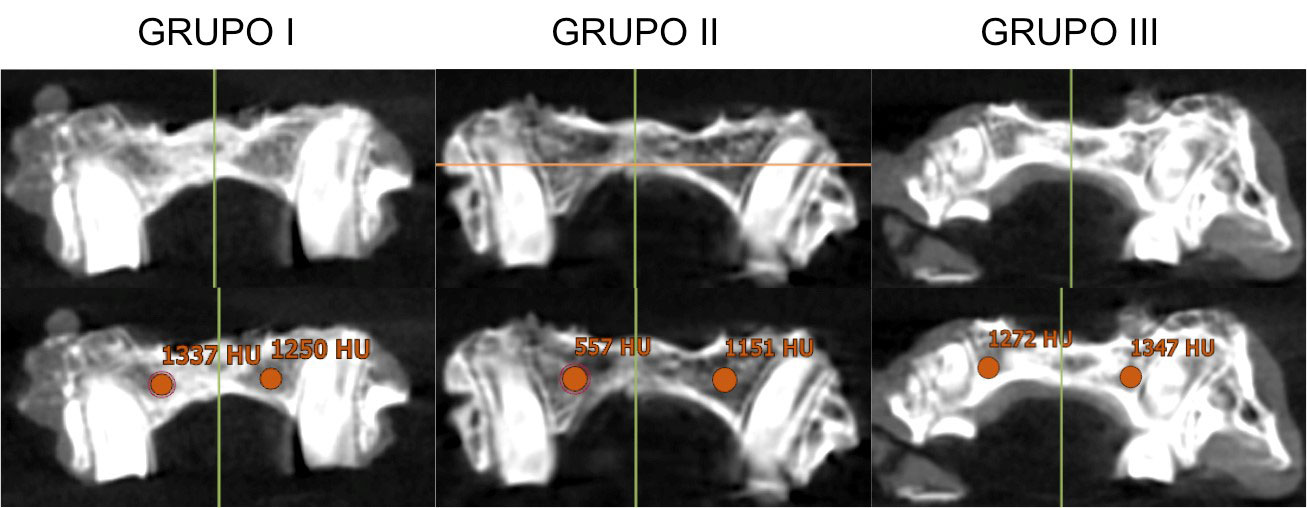
Para la determinación de la influencia del injerto de hueso autólogo en la densidad del hueso esponjoso palatino de los animales intervenidos, a los 6 meses del implante se realizó una tomografía computerizada utilizando PointNix Point 3D Combi 500C Dental Imaging System® (Abex Medical System, Selangor Darul Ehsan, Malaysia). Tras ello se descargaron las imágenes obtenidas en el programa Nobel Clinician 2.4® y se realizaron 3 mediciones de la densidad ósea a nivel de los segundos molares, expresadas en unidades Hounsfield, comparando ambos lados (lado intervenido y lado control). Se tomó como valor la media resultante en cada lado.
Análisis estadístico.
Para la comparación de las medidas de densidad ósea entre el lado intervenido y el contralateral de cada grupo de animales, se utilizó la prueba estadística de Mann-Whitney, considerándose estadísticamente significativo los valores inferiores a 0’05 para los test de doble cola.
Figura 3. Imágenes de tomografía computerizada. Cortes a nivel de 2º molar de los animales de estudio. En la parte inferior cuantificación de la densidad ósea en unidades Hounsfield. Grupo I: animales con injerto óseo autólogo generado con ingeniería tisular. Grupo II: animales a los que se realizó defecto sin injerto alguno. Grupo III: control positivo.
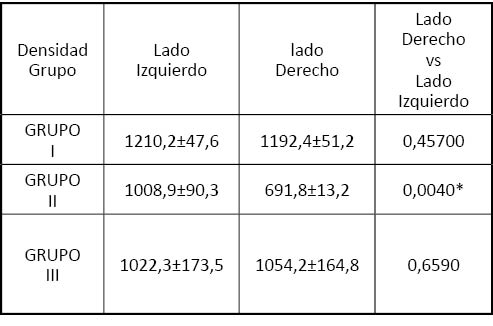
Tabla 1. Resultados del análisis de densidad ósea, expresada en unidades Hounsfield en los animales incluidos en el estudio. Todos los valores se expresan como promedios ± desviación estándar, excepto los valores de comparación estadística que corresponden a los valores de significación p. * valores con diferencia significativa entre lado derecho (intervenido) e izquierdo.
RESULTADOS
Todos los animales toleraron sin incidencias las intervenciones realizadas, no apreciándose efectos adversos relevantes en ninguno de los tres grupos experimentales.
Como se muestra en la tabla 1 y en las figuras 2 y 3, en el análisis correspondiente a los animales pertenecientes al grupo III o control positivo (animales no intervenidos) se encontró que la densidad ósea era similar en ambos hemipaladares (p>0’05). Por el contrario, en el grupo II controles negativos (animales intervenidos, pero sin implantación de tejido óseo) se observó una diferencia estadísticamente significativa en la densidad del hueso palatino derecho frente al izquierdo (p<0’05). Finalmente, en los animales a los que se les implantó tejido óseo artificial (grupo I), no se observaron diferencias estadísticamente significativas entra ambos lados del paladar (p>0’05).
DISCUSIÓN
La alveoloplastia es un procedimiento común en pacientes afectados de fisura palatina. Tiene el objetivo de alcanzar una buena oclusión con unos (25)resultados funcionales y estéticos adecuados, y se utiliza en combinación con técnicas quirúrgicas, ortopédicas, ortodóncicas y protésicas (6, 26, 27). El no estar exenta de complicaciones hace que sea necesario desarrollar nuevas técnicas que presenten menos efectos adversos asociados a la toma de hueso a la zona donante.
En este trabajo hemos evaluado un nuevo modelo de hueso artificial, generado por ingeniería tisular, en un modelo animal de defecto óseo palatino previamente descrito por el grupo de ingeniería tisular (20). Los resultados avalan la factibilidad de la técnica y la utilidad del modelo animal para el estudio de defectos palatinos. En este contexto, nuestros resultados confirman la utilidad del hueso autólogo generado mediante ingeniería tisular a partir de células madre mesenquimales, obtenidas de pequeñas biopsias de tejido adiposo, para favorecer la regeneración ósea, y sugieren por tanto la posible utilidad clínica de estos tejidos artificiales (20).
Otros autores han descrito técnicas de ingeniería tisular para conseguir neoformación ósea mediante el uso células madre del tejido adiposo o de médula ósea, como alternativa al injerto óseo autólogo en animales, aunque utilizando otros soportes para las mismas y sin inducir la diferenciación (13, 21, 28, 29).
Para determinar la utilidad in vivo del injerto de hueso artificial, hemos analizado la densidad ósea.
La densidad ósea es un parámetro de calidad ósea y ha sido estudiada y clasificada por diversos autores. Se han propuesto diversas metodologías para la cuantificación de la densidad ósea, desde la radiología convencional hasta las técnicas más avanzadas como las últimas modalidades de tomografía computerizada, esta última es la más aceptada y utilizada en la actualidad teniendo como unidad de medida el Hounsfield (30-33). Frente a otros métodos igualmente eficaces para determinar la utilidad del injerto, como es el análisis histológico (19, 20), el uso de técnicas radiológicas y análisis mediante programas específicos nos permite un estudio de alta fiabilidad sin necesidad de destruir la muestra y sacrificar el animal de estudio. Esto además presenta una gran utilidad clínica para la posible extrapolación de estos estudios en humanos.
La densidad ósea es determinante tanto para la osteointegración de un posible implante, como para permitir la erupción de piezas incluidas y movimientos ortodóncicos, así como para la realización de tratamientos ortopédicos si fuesen necesarios (6, 14, 33). Lo deseable es una densidad lo más cercana a la del hueso no alterado (26, 33-35). Según los resultados obtenidos en nuestro estudio, el uso de injertos óseos autólogos artificiales generados por ingeniería tisular puede ser una alternativa válida al uso de hueso autólogo de cresta iliaca, ya que la densidad ósea obtenida es similar a la del hueso sano.
Aunque habrá que realizar ensayos clínicos en humanos de acuerdo con lo establecido por la agencia española de medicamentos y productos sanitarios (AEMPS), los resultados de este estudio, junto con resultados previos del propio grupo de investigación (20) sugieren que el injerto de hueso artificial generado en laboratorio presenta escasos efectos adversos y podría contribuir tanto a la regeneración del hueso alveolar, como para el crecimiento equilibrado del macizo facial.
Otras posibles utilidades clínicas de este material sería en otros tipos de defectos óseos maxilares como los de etiología traumática, los defectos oncológicos o los causados por la atrofia ósea relacionada con el envejecimiento. Los resultados que hemos obtenido parecen indicar que el hueso resultante permitiría un soporte adecuado para una rehabilitación protésica implantosoportada, devolviendo al paciente una función y estética adecuada y mejorando su calidad de vida. Se han realizado estudios en humanos, utilizando células madre como adyuvante para disminuir la reabsorción del injerto óseo autólogo de cresta iliaca (36), pero este tipo de técnica no evitaría las complicaciones en la zona donante derivadas de la toma de injerto. En el ámbito de la implantología se han realizado estudios en perros Beagle, que indican un posible uso del tejido óseo artificial obtenido mediante ingeniería tisular para el tratamiento de la pérdida ósea generada en la periimplantitis (37). Serían necesarios nuevos estudios para valorar la osteointegración de implantes en este tejido óseo artificial.
CONCLUSIONES
El estudio mediante tomografía computerizada y el análisis de los datos con programas informáticos que nos permite la medición de unidades Hounsfield de la densidad ósea tras implante de hueso generado mediante ingeniería tisular en animales de experimentación.
El análisis de estas medidas de densidad ósea sugiere, que el tejido óseo generado por ingeniería tisular contribuye a mejorar la calidad y densidad ósea, en defectos óseos palatinos creados en conejos de laboratorio. Esto nos sugiere una futura aplicación clínica.
REFERENCIAS
- Arosarena OA. Cleft lip and palate. Otolaryngol Clin North Am. 2007;40(1):27-6. http://www.ncbi.nlm.nih.gov/pubmed/17346560
- Cho-Lee GY, Garcia-Diez EM, Nunes RA, et al. Review of secondary alveolar cleft repair. Ann Maxillofac Surg. 2013;3(1):46-50. http://www.ncbi.nlm.nih.gov/pubmed/23662259
http://www.amsjournal.com/article.asp?issn=22310746;year=2013;volume=3;issue=1;spage=46;epage=50;aulast=Cho%2DLee - Arangio P, Marianetti TM, Tedaldi M, Ramieri V, Cascone P. Early secondary alveoloplasty in cleft lip and palate. J Craniofac Surg. 2008;19(5):1364-9. http://www.ncbi.nlm.nih.gov/pubmed/18812864
http://ovidsp.tx.ovid.com/ovftpdfs/FPDDNCJCGDOHFF00/fs046/ovft/live/gv025/00001665/00001665-200809000-00025.pdf - Matsui Y, Ohno K, Nishimura A, et al. Long-term study of dental implants placed into alveolar cleft sites. Cleft Palate Craniofac J. 2007;44(4):444-7. http://www.ncbi.nlm.nih.gov/pubmed/17608551
- Semb G. Alveolar bone grafting. Front Oral Biol. 2012;16:124-36. http://www.ncbi.nlm.nih.gov/pubmed/22759676
http://www.karger.com/Article/Abstract/337666 - Wu J, Wang G. [Evaluation of orthodontic teeth moving in bone graft area by dental CT]. Hua Xi Kou Qiang Yi Xue Za Zhi. 2012;30(4):383-7. http://www.ncbi.nlm.nih.gov/pubmed/22934494
- Bousdras VA, Ayliffe PR, Barrett M, Hopper C. Esthetic and functional rehabilitation in patients with cleft lip and palate. Ann Maxillofac Surg. 2015;5(1):108-11. http://www.ncbi.nlm.nih.gov/pubmed/26389047
http://www.amsjournal.com/article.asp?issn=2231-0746;year=2015;volume=5;issue=1;spage=108;epage=111;aulast=Bousdras - Amin K, Khor WS, Rosich-Medina A, Beale V. Alveolar Bone Grafting: Donor Site Review of 100 Consecutive Cases in Cleft Lip and Palate. Cleft Palate Craniofac J. 2015. http://www.ncbi.nlm.nih.gov/pubmed/26506046
- Raposo-Amaral CA, Denadai R, Chammas DZ, et al. Cleft Patient-Reported Postoperative Donor Site Pain Following Alveolar Autologous Iliac Crest Bone Grafting: Comparing Two Minimally Invasive Harvesting Techniques. J Craniofac Surg. 2015;26(7):2099-103. http://www.ncbi.nlm.nih.gov/pubmed/26413958
http://ovidsp.tx.ovid.com/ovftpdfs/FPDDNCJCGDOHFF00/fs047/ovft/live/gv024/00001665/00001665-201510000-00014.pdf - Pessoa EA, Braune A, Casado PL, Tannure PN. Alveolar Bone Graft: Clinical Profile and Risk Factors for Complications in Oral Cleft Patients. Cleft Palate Craniofac J. 2016. http://www.ncbi.nlm.nih.gov/pubmed/27427932
- Muzaffar AR, Warren A, Baker CL. Use of the On-Q Pain Pump in Alveolar Bone Grafting: Effect on Hospital Length of Stay. Cleft Palate Craniofac J. 2016;53(2):e23-7. http://www.ncbi.nlm.nih.gov/pubmed/25531732
- Tavakolinejad S, Ebrahimzadeh Bidskan A, Ashraf H, Hamidi Alamdari D. A glance at methods for cleft palate repair. Iran Red Crescent Med J. 2014;16(9):e15393. http://www.ncbi.nlm.nih.gov/pubmed/25593724
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4270645/pdf/ircmj-16-09-15393.pdf - Stanko P, Mracna J, Stebel A, et al. Mesenchymal stem cells – a promising perspective in the orofacial cleft surgery. Bratisl Lek Listy. 2013;114(2):50-2. http://www.ncbi.nlm.nih.gov/pubmed/23331197
- Yilmaz S, Kilic AR, Keles A, Efeoglu E. Reconstruction of an alveolar cleft for orthodontic tooth movement. Am J Orthod Dentofacial Orthop. 2000;117(2):156-63. http://www.ncbi.nlm.nih.gov/pubmed/10672215
http://ac.els-cdn.com/S0889540600702265/1-s2.0-S0889540600702265-main.pdf?_tid=f9c9029e-54dc-11e6-8458-00000aacb35d&acdnat=1469722054_e026586d0100ff34bb4a939f58f8d573 - Cune MS, Meijer GJ, Koole R. Anterior tooth replacement with implants in grafted alveolar cleft sites: a case series. Clin Oral Implants Res. 2004;15(5):616-24. http://www.ncbi.nlm.nih.gov/pubmed/15355405
http://onlinelibrary.wiley.com/doi/10.1111/j.1600-0501.2004.01052.x/abstract
http://onlinelibrary.wiley.com/store/10.1111/j.1600-0501.2004.01052.x/asset/j.1600-0501.2004.01052.x.pdf?v=1&t=ir6i9rxk&s=b28b7caf610fea46376bf53df4ef7e4a702a8090 - Le BT, Woo I. Alveolar cleft repair in adults using guided bone regeneration with mineralized allograft for dental implant site development: a report of 2 cases. J Oral Maxillofac Surg. 2009;67(8):1716-22. http://www.ncbi.nlm.nih.gov/pubmed/19615587
http://ac.els-cdn.com/S0278239109005126/1-s2.0-S0278239109005126-main.pdf?_tid=797ff066-54dc-11e6-ad65-00000aacb361&acdnat=1469721839_0b2cbae8833f68a8c949954c7ac56049 - Nieto-Aguilar R, Serrato D, Garzon I, Campos A, Alaminos M. Pluripotential differentiation capability of human adipose-derived stem cells in a novel fibrin-agarose scaffold. J Biomater Appl. 2011;25(7):743-68. http://www.ncbi.nlm.nih.gov/pubmed/20237181
http://jba.sagepub.com/content/25/7/743.full.pdf
INFORMACIÓN DEL ARTÍCULO
Agradecimientos: Este trabajo ha sido financiado por el proyecto PI14/02110 del Plan Estatal de Investigación Científica, Desarrollo e Innovación Tecnológica (I+D+I) del Instituto de Salud Carlos III (Ministerio de Economía y Competitividad), y cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER).
Autor para la correspondencia: Ricardo Fernández-Valadés Gámez. C/ Alcántara, 34, 2ºB. 28006 Madrid. Teléfono: 652800373. Email: rfvgamez@gmail.com