Original
¿Existe estabilidad LDL entre dos dosis en pacientes que usan iPCSK9?
Is there LDL stability between two doses in patients using iPCSK9?
Actual. Med. 2019; 104: (807): 98-102 DOI: 10.15568/am.2019.807.or04
Enviado: 18-06-2019
Revisado: 08-07-2019
Aceptado: 02-08-2019
RESUMEN
Introducción y objetivos: Los iPCSK9 han demostrado reducir en más de un 50% los niveles plasmáticos de cLDL. Sin embargo la estabilidad de los niveles LDL en el periodo interdosis nos plantea dudas. Analizamos si la reducción del cLDL es estable durante este periodo.
Material y métodos: Estudio retrospectivo descriptivo. Se incluyeron los pacientes tratados con iPCSK9 en un hospital de tercer nivel. Se agruparon a los pacientes según la fecha del control analítico respecto a la última dosis recibida, en los días 0-3, 4-6, 7-9, 10-12 y 13-15 tras la misma.
Resultados: Se incluyeron 71 pacientes con una reducción de cLDL del 55,02% (p<0,001). En aquellos que se realizaron control analítico en los 3 primeros días se redujo 56,83% (p=0,003), alcanzando el 75,48% entre los días 4-6 (p<0,001), descendiendo a un 52,14% entre 7-9 días (p<0,001), alcanzando un 32,94% (p=0,021) a partir del día 13.
Conclusiones: En nuestra cohorte hemos observado que la efectividad de los iPCSK9 no es estable durante el periodo interdosis, pero se requerirían estudios prospectivos con mayores extracciones sanguíneas para poder afirmar esta condición y su impacto clínico real.
Palabras clave: Hipercolesterolemia; Prevención primaria; Prevención secundaria; IPCSK9; Factores de riesgo cardiovascular; Variabilidad interdosis.
ABSTRACT
Introduction and objectives: IPCSK9 have been shown to reduce plasma LDL-C levels more than 50%. However, the stability of LDL levels in the interdose period raises questions. We analyze if the reduction of LDL-C is stable during this period.
Material and methods: Retrospective descriptive study. All patients, of a tertiary hospital, treated with iPCSK9 were included. Patients were grouped according to the date of the analytical control respect the last dose received, on days 0-3, 4-6, 7-9, 10-12 and 13-15 after the inyection.
Results: We included 71 patients with a LDL-C reduction of 55.02% (p <0.001). In those who performed analytical control in the first 3 days reduced 56.83% (p = 0.003), reaching 75.48% between days 4-6 (p <0.001), decreasing to 52.14% between 7-9 days (p <0.001), reaching 32.94% (p = 0.021) from day 13.
Conclusions: In our cohort we have observed that the effectiveness of iPCSK9 is not stable during the interdose period, but prospective studies with mayor number of blood extractions would be required to be able to affirm this condition and its real clinical impact.
Keywords: Hypercholesterolemia; Primary prevention; Secondary prevention; IPCSK9; Cardiovascular risk factors; Inter-dose variability.
Leer Artículo Completo
INTRODUCCIÓN
Los estudios sobre factores de riesgo cardiovascular y su importancia en la práctica clínica son indiscutibles. Hasta no hace mucho tiempo, muchos de nuestro pacientes padecían hipercolesterolemia no controlable a pesar de una rigurosa dieta, ejercicio y uso de estatinas a dosis plenas (+/- ezetimibe) (1). Más aún en aquellos pacientes que padecían hipercolesterolemias familiares o que habían tenido un evento coronario; en los que los requerimientos de descenso de colesterol total y colesterol asociado a lipoproteínas de baja densidad (cLDL) en particular, son mucho más estrictos.
En 2016, salieron al mercado los inhibidores de la proteína convertasa subtilisina/kexina 9 (iPCSK9). Éstos han demostrado, en sus ensayos pivotales (1-3) y en estudios de vida real (4-7), reducir entre un 50% a 70%, los niveles plasmáticos de cLDL; tanto en monoterapia, como en combinación con estatinas e hipolipemiantes no estatínicos, principalmente ezetimibe (8-9).
De esta manera se abría una nueva puerta para poder alcanzar objetivos de control lipídico tanto en prevención primaria como secundaria en un gran porcentaje de pacientes. Paralelamente, parecían reducir los niveles de otros lípidos aterogénicos [apolipoproteina B, colesterol total, triglicéridos y la lipoproteina(a)] (5, 6, 9). Sin embargo la estabilidad de los niveles LDL en el periodo interdosis (dosis bimensuales) no ha sido estudiada previamente y plantea dudas en la práctica clínica.
El objetivo principal de este trabajo es describir si la reducción del cLDL es estable durante todo el periodo interdosis de la administración de los iPCSK9 o difiere según el momento de extracción de la analítica control. Como objetivos secundarios se pretende analizar las características de pacientes a los que se prescriben estos fármacos, su indicación principal y si previamente habían estado con tratamiento óptimo. Así mismo evaluar la modificación de los perfiles lipídicos (cLDL, TG y cHDL) y describir los posibles efectos secundarios de dichos fármacos.
MATERIAL Y MÉTODOS
Diseño del estudio:
Se trata de un estudio retrospectivo descriptivo, llevado a cabo en un Hospital de tercer nivel, desde Marzo del 2016 hasta junio de 2018.
Procedimiento de muestreo y tamaño de muestra:
Se incluyeron a todos los pacientes que iniciaron tratamiento con iPCSK9 en nuestro hospital, alcanzado finalmente un tamaño total de 90 pacientes.
Criterios de inclusión:
Pacientes que iniciaran tratamiento con iPCSK9.
Criterios de exclusión:
Pacientes que no fueran a ser revisados en nuestro centro hospitalario.
METODOLOGÍA
Se recogieron para cada uno de los pacientes que iniciaban tratamiento con iPCSK9 las diferentes variables estudiadas antes de iniciar tratamiento y una vez establecido el mismo.
Se agruparon los pacientes según la fecha del control analítico (previsto por su médico responsable), respecto a la última dosis recibida, en los días 0-3, 4-6, 7-9, 10-12 y 13-15 tras la misma. Estos controles se realizaron en un tiempo variable (3 meses – 1 año) desde el inicio del fármaco a criterio del médico responsable.
Una vez finalizado el estudio, se procedió al análisis estadístico comparativo entre los valores pre y pos tratamiento.
VARIABLES
Las variables incluidas en el estudio fueron: edad, sexo, factores de riesgo cardiovascular (hipertensión, diabetes, fumador o exfumador), diagnóstico clínico, así como el motivo clínico que justificó el tratamiento con estos fármacos, el servicio prescriptor, el objetivo cLDL (establecido previo al tratamiento, basado en comorbilidades y factores de riesgo cardiovasculares), el tipo de iPCSK9 usado y su dosis. Se recogió también la existencia de un tratamiento previo óptimo, entendiéndolo como dosis máxima de estatinas de alta intensidad más ezetimibe). Dentro de los datos analíticos se analizó: colesterol total (CT), cLDL, cHDL, triglicéridos, transaminasas y creatin kinasa (CK). Así mismo se recogieron los efectos secundarios presentados, la fecha de la analítica de control y la fecha de administración del fármaco.
Se recogieron la fecha de administración del fármaco, la fecha de la analítica de control y los efectos secundarios presentados.
RESULTADOS
Se incluyeron un total de 90 pacientes en los que se había prescrito iPCSK9, de los cuales 15 pacientes no se habían realizaron el control analítico en el momento de este estudio; y 4 fueron excluidos del análisis final por desconocerse el momento de la última administración del fármaco.
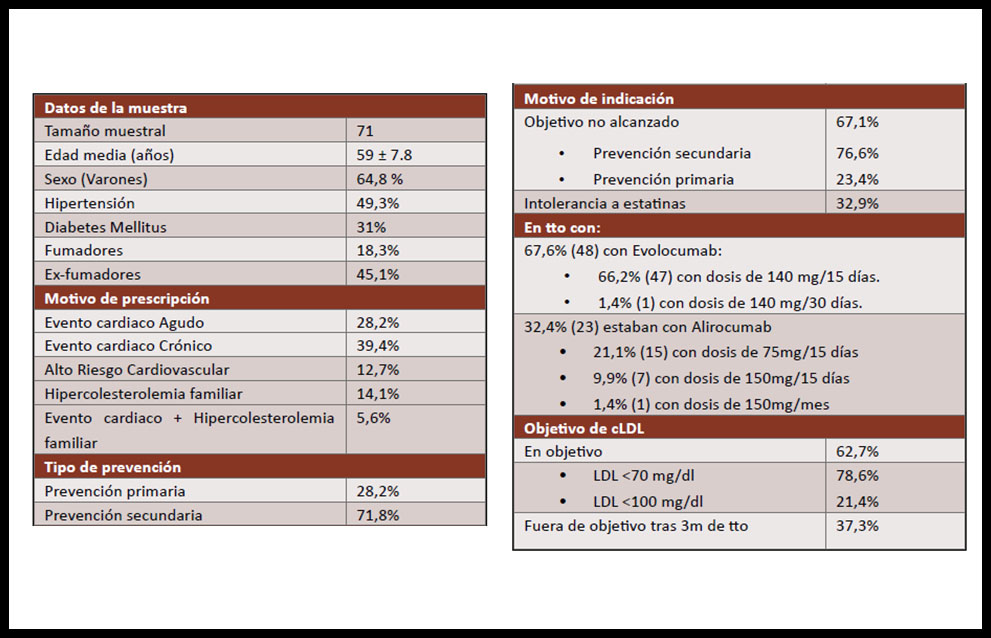
Se analizaron finalmente 71 pacientes con una edad media 59 años, con las características observadas en la tabla I. Los iPCSK9 fueron prescritos en su mayoría (74,6%) por el servicio de cardiología, seguidos de un 12,7% por medicina interna, un 8,5% por nefrología y 3,2% por endocrinología. La principal indicación fue la cardiopatía isquémica (67,6%) en prevención secundaria (71,8%); por no alcanzar objetivo de cLDL (67,1%), a pesar de tratamiento hipolipemiante óptimo con estatina de alta intensidad y ezetimibe (67,6%). Mientras que el 32,9% fue prescrito como consecuencia de la intolerancia a las estatinas (31,8% con aumento documentado de transaminasas (cinco veces por encima de los niveles normales), 40,5% con mialgias, un 27,3% presentando incremento de CK).
Tabla I. Características clínicas de los pacientes estudiados
El 14,1% presentaban hipercolesterolemia familiar.
El 67,6% (48) fueron tratados con Evolocumab 140mg (66,2% con dosis bisemanal y el 1,4% con dosis mensual); 21,1% (15) con Alirocumab 75 mg/14 días y 10,3%(8) con Alirocumab 150 mg bisemanal, salvo un paciente mensual.
Analizando los datos de manera estática, el CT se redujo en un 37,01% de manera estadísticamente significativa (p<0,001), pasando de una media de 237,42 ± 64,70 mg/dl a 149,56 ± 58,83mg/dl. El cLDL basal medio fue de 144,76 ± 66,65mg/dl y tras la administración del iPCSK9 65,12 ± 44,51mg/dl (p<0,001) (reducción del cLDL del 55,02%). En relación a los TG se produjo una disminución media del 23,68% (p=0,03), lo que supuso una disminución de 206,75 mg/dl a 157,8mg/dl y un cHDL basal (50,7 mg/dL) que no sufrió modificación (52,34 mg/dL) (p=0,32). No se hallaron diferencias en los niveles de transaminasas o CK.
El 62,7% estaban en objetivo de cLDL, según indicación (78,6% < 70 mg/dl y 21,4% < 100mg/dl), frente al 37,3% que no se encontraban en objetivo en el momento del control analítico. En cuanto a los efectos secundarios detectados, 4 pacientes refirieron, en relación al tratamiento: mialgias, sangrado gingival, diarrea y cefalea, respectivamente.
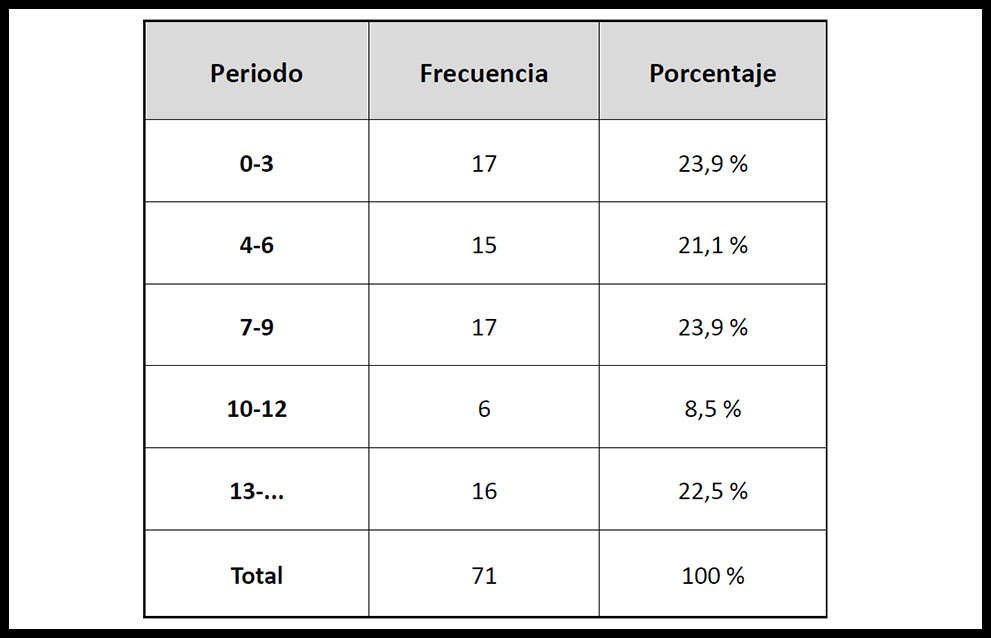
Los pacientes se agruparon según la fecha del control analítico tras la administración del fármaco (tabla II), encontrando una frecuencia similar (21,1%-23,9%) en todos los pacientes, a excepción de la franja de 10-12 días, con un menor porcentaje (8,5%).
Tabla II. Agrupación de los pacientes según la fecha del control analítico
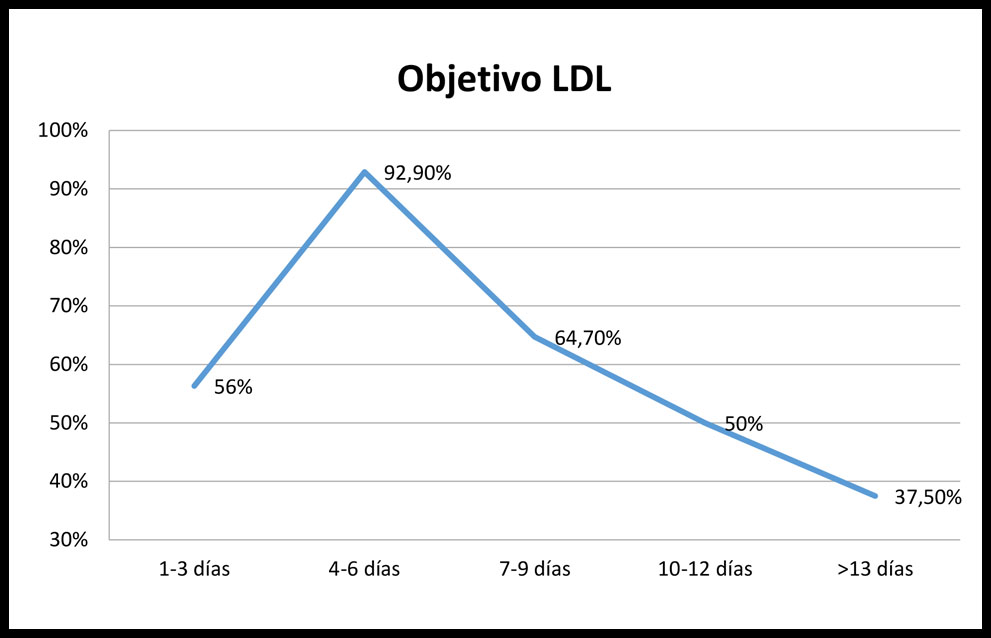
El 56,3% de los que realizaron control analítico en los 3 primeros días se encontraban en objetivo de cLDL, 92,9% en los días 4-6 días. A partir de la tercera franja, observamos un manifiesto descenso donde sólo el 64,7% entre 7-9 días se encontraba en objetivo LDL; el 50% entre 10-12 días y menos de la mitad de los pacientes (37,5%) de los que se realizaron la extracción a partir del día 13 post administración del fármaco. (Figura 1)
Figura 1. Pacientes en cifras objetivo según el periodo de extracción de la analítica
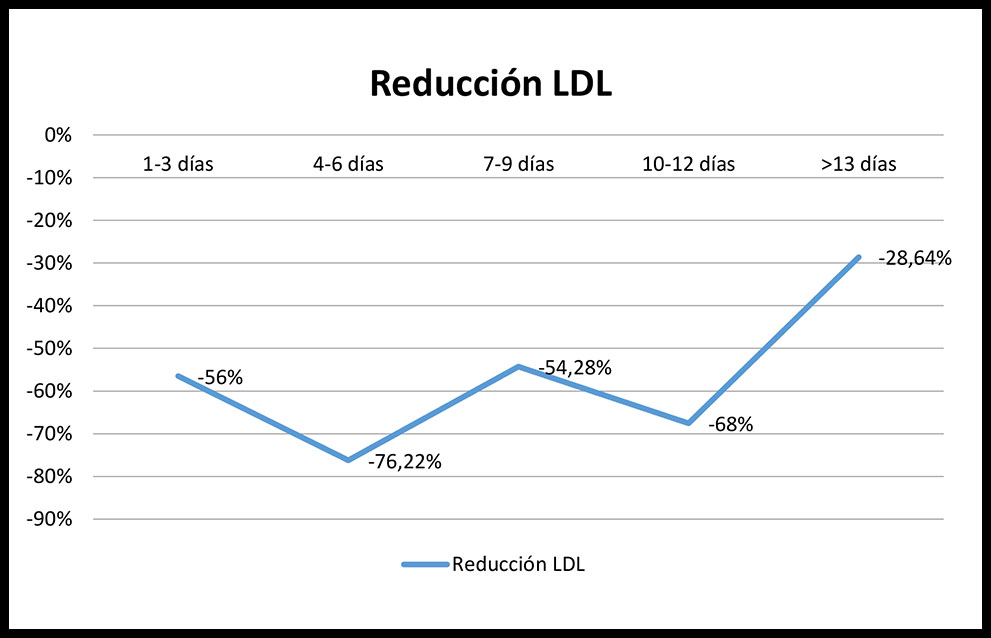
Si analizamos el porcentaje de reducción de los niveles de cLDL; estos se redujeron en un 56,48% respecto al basal en los 3 primeros días (p=0,004), llegando hasta un pico de 76,22% entre los días 4-6 (p<0,001), comenzando a descender a partir de esta fecha a un 54,28% entre 7-9 días (p<0,001) y un 67,57% 10-12 días (p=0,007) y alcanzando las cotas más bajas a partir del día 13 tras la administración del iPCSK9, con un escaso 28,64% (p=0,019). (Figura 2)
Figura 2. Reducción en porcentaje del LDL según el periodo de extracción de la analítica
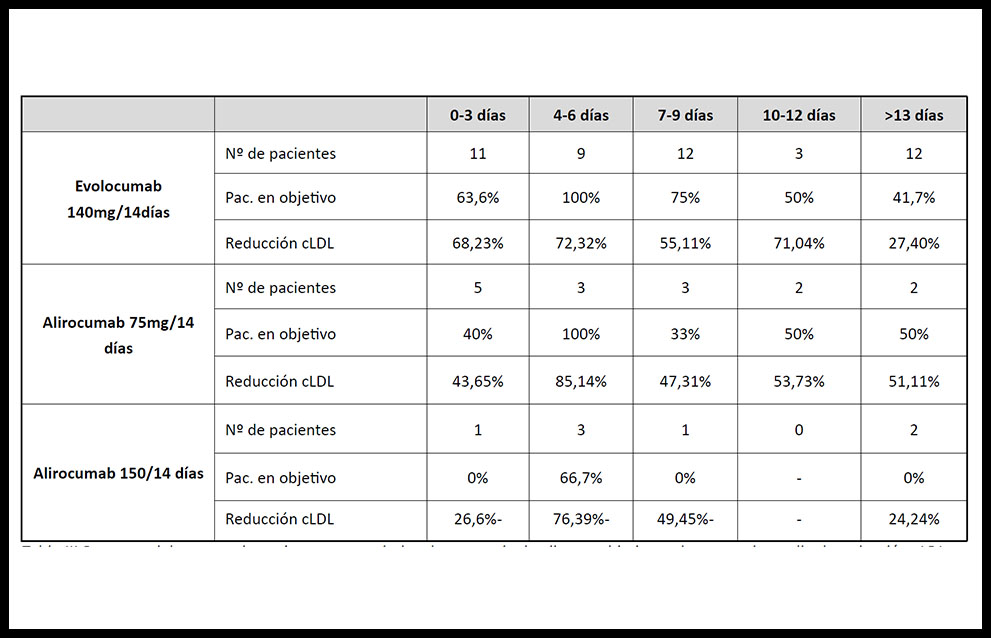
Si analizamos los datos según el tipo de fármaco utilizado (tabla III); Evolocumab 140mg/14días, presenta un alto porcentaje 100%-75% de pacientes en objetivo cLDL entre los días 4-9. Descendiendo al 40-50% en los periodos sucesivos. Alirocumab, con mucha menor n, en su dosificación de 75mg /bimensual, presenta una curva similar con un 100% de los pacientes en objetivo entre los días 4-7, descendiendo hasta el 41,7% en los últimos días; al igual que Alirocumab 150mg/bimensual, con apenas 6 pacientes, donde los únicos pacientes en objetivo se encuentran en los días 4-6.
Tabla III.Resumen del numero de pacientes por periodo, el porcentaje de ellos en objetivo y el porcentaje medio de reducción cLDL
Si analizamos la reducción en porcentaje de cLDL del Evolocumab 140mg/bimensual encontramos una curva semejante a la descrita anteriormente, con un pico en los días 4-7 del 72,32%, descendiendo al 27,4% en los últimos días. Mientras que Alirocumab 75 mg/14días, presenta una reducción del 85,14% en el período de 4-7 días, como ocurre con la dosis de 150 mg, con una reducción del 76,39%; descendiendo posteriormente a 51,1% y a 24,9%, respectivamente.
DISCUSIÓN
Tras varios años de experiencia en el uso de estos novedosos y esperanzadores fármacos, se ha observado que la prevención secundaria es la principal justificación para la prescripción de éstos y que, por lo tanto, Cardiología es el principal prescriptor en nuestro centro. Según los datos obtenidos, al igual que nos indicaban los estudios pivotales (2-4), los iPCSK9 reducen cLDL en más del 50%, permitiendo en un gran porcentaje de los pacientes alcanzar el objetivo lipídico, de forma segura. Tal y como adelantaban otros estudios (11), no se detectaron efectos secundarios destacables o alteración de las enzimas musculares ni hepáticas.
En nuestra cohorte, la disminución de cLDL fue de un 55%, ligeramente inferior a lo mostrado en los estudios FOURIER (59%)(4) y ODYSSEY (62%) (3) o los estudio presentados por Koren et al (68.4%) (11). En el primer caso, se describe que las evaluaciones de laboratorio estaban programadas en el día 1, semana 4, 12, 244; sin embargo no se hace mención al momento de esta evaluación respecto a la última dosis administrada.
Cuando analizamos en nuestra cohorte la reducción de cLDL en los periodos interdosis, hemos observado una variabilidad según el momento de extracción de la analítica, encontrando un mayor porcentaje de pacientes (92,9%) en objetivo cLDL entre los días 4-6 tras la administración del fármaco, similar al referenciado en el estudio de Koren et al (90%) (11) y un posterior descenso progresivo de pacientes en objetivo, datos concordantes con los descritos sobre el tiempo necesario para alcanzar la concentración máxima sérica (3-4 días). Sin embargo, estos niveles, descriptivamente, no son estables en el tiempo, produciéndose un descenso progresivo de actividad hasta que más del 62% de los pacientes no se encuentren en objetivo terapéutico en los días previos a la administración de la nueva dosis. El porcentaje de reducción de cLDL concuerda con los datos anteriores.
Análisis secundarios según el tipo de iPCSK9 utilizado no muestran variación alguna respecto a lo reflejado anteriormente y la n para estos casos es muy pequeña para poder analizarlos de forma aislada.
No obstante, este estudio es descriptivo y por lo tanto presenta limitaciones: desconocemos la variabilidad intrapaciente e interpaciente; para lo que se necesitaría hacer varias analíticas durante el periodo interdosis a los mismos pacientes. Así mismo es imposible extrapolar esta información a si estos datos pueden llegar a tener efecto sobre el riesgo cardiovascular. Por ello sería necesario plantear varios estudios que corroborasen estos resultados, así como otros diseñados para aclarar la repercusión clínica.
Hemos de recalcar que la importancia de estos datos radica en el descenso de la eficacia del fármaco a lo largo del periodo interdosis hasta la nueva administración del mismo, y la potencial repercusión que esto podría tener en la reducción de eventos cardiovasculares. Estos datos arrojan una serie de incógnitas difícil de responder con los datos actuales: ¿tienen importancia clínica estos datos? ¿Existiría una disminución mayor de los eventos cardiovasculares si los niveles fueran estables en el tiempo? De confirmarse estos datos con posteriores estudios, ¿sería posible aumentar la frecuencia de la administración del fármaco? ¿La administración del fármaco más continua en el tiempo, pero a menor dosis, conseguiría niveles adecuados más estables en el tiempo?
Por todo ello, concluimos que en nuestra cohorte hemos observado que la efectividad de los iPCSK9 no es estable durante el periodo interdosis. Se requieren nuevos estudios prospectivos con mayor número de extracciones para poder afirmar esta condición e interpretar su importancia clínica en la reducción de eventos cardiovasculares.
REFERENCIAS BIBLIOGRÁFICAS
- Millán J, Alegría E, Guijarro C, Lozano JV, Vitale GC, González-Timón B et al. Dyslipemia in diabetics treated with statins. Results of the DYSIS study in Spian. Med Clin (Barc). 2013; 141(10):430-6.
- Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015; 372(16):1500-9.
- Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015; 372(16):1489-99.
- Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017; 376(18):1713-1722.
- Kohli M, Patel K, MacMahon Z, Ramachandran R, Crook MA, Reynolds TM, Wierzbicki AS. Pro-protein subtilisin kexin-9 (PCSK9) inhibition in practice: lipid clinic experience in 2 contrasting UK centres. Int J Clin Pract. 2017; 71(11).
- Ogura M. PCSK9 inhibition in the management of familial hypercholesterolemia. J Cardiol. 2018; 71(1):1-7.
- Landmesser U, Chapman MJ, Stock JK, Amarenco P, Belch JJF, Borén J, et al. 2017 Update of ESC/EAS Task Force on practical clinical guidance for proprotein convertasesubtilisin/kexin type 9 inhibition in patients with atherosclerotic cardiovascular disease or in familial hypercholesterolaemia. Eur Heart J. 2018; 39(14):1131-1143.
- Page MM, Watts GF. PCSK9 in context: A contemporary review of an important biological target for the prevention and treatment of atherosclerotic cardiovascular Disease. Diabetes Obes Metab. 2018; 20(2):270-282.
- Di Bartolo B, Scherer DJ, Brown A, Psaltis PJ, Nicholls SJ. PCSK9 Inhibitors in Hyperlipidemia: Current Status and Clinical Outlook. BioDrugs. 2017; 31(3):167-174.
- Filippatos TD, Kei A, Rizos CV, Elisaf MS. Effects of PCSK9 Inhibitors on Other than Low-Density Lipoprotein Cholesterol Lipid Variables. J Cardiovasc Pharmacol Ther. 2018; 23(1):3-12
- Koren MJ, Roth EM, McKenney JM, Gipe D, Hanotin C, Ferrand AC, et al. Safety and efficacy of alirocumab 150 mg every 2 weeks, a fully human proprotein convertase subtilisin/kexin type 9 monoclonal antibody: A Phase II pooled analysis. Postgrad Med. 2015; 127(2):125-32. doi: 10.1080/00325481.2015.998987. Epub 2015 Jan 22.
- Endocrinology and metabolic drugs advisory committee (EMDAC) meeting june 10, FDA Briefing Documente. United Sates Food and Drug Administration website. Disponible en: https://www.fda.gov/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/ucm450071.htm
INFORMACIÓN DEL ARTÍCULO
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses. No se percibió financiación externa de ningún tipo para el desarrollo de este estudio.
AGRADECIMIENTOS
A los doctores Castillo Hernández, Gutiérrez Lara y Martínez Colmenero por su dedicación y correcciones.
Autor para la correspondencia:Miguel Ángel López Zúñiga. Medicina Interna, Complejo Hospitalario de Jaén. Dirección postal de correspondencia: Av. del Ejército Español, 10. Medicina Interna. E-Mail:: miguelangellopezzuniga@gmail.com Tlf.: +34 610206854