Revisión
Hidroxiapatita sustituida con estroncio: plataforma para regeneración ósea con actividad antimicrobiana
Strontium-doped hydroxyapatite: platform for bone regeneration with antimicrobial activity
Actual Med.2024;109(818): 20-38 DOI: 10.15568/am.2024.818.rev01
Recibido: 04/10/2023
Revisado: 01/11/2023
Aceptado: 13/12/2023
Resumen
La hidroxiapatita (HA) es un fosfato de calcio que por su analogía a la apatita biológica ha demostrado excelentes resultados en aplicaciones clínicas para la sustitución del tejido óseo. No obstante, existen ciertas patologías como la osteopenia o la osteoporosis donde está disminuida la capacidad natural de formación de nuevo hueso donde se requiere de un estímulo extra para acelerar y garantizar los procesos de osteointegración de los implantes óseos. En estos casos la inclusión de iones estroncio en la hidroxiapatita (Sr-HA) ha dado excelentes resultados. El ion Sr2+ participa en el metabolismo óseo de diversas maneras: a la vez que estimula la formación ósea inhibe en cierta medida la osteoclastia; lo que en su conjunto promueve la formación de nuevo hueso con mayor celeridad. Así, el desarrollo de implantes de Sr-HA ha evolucionado a no solo considerar sustitutos del tejido óseo con mayor velocidad de osteointegración, sino que ellos mismos se conviertan en plataformas para la liberación de otros principios activos que puedan también contrarrestar diferentes condiciones médicas. Este trabajo profundiza en la complejidad de los procesos sépticos asociados a prótesis, razón que justifica la diversidad de acercamientos a esta problemática clínica desde la ingeniería biomédica y realiza un recorrido por diferentes formulaciones a base de Sr-HA reportadas para erradicar procesos sépticos. En particular explora nuevos dispositivos portadores de antibióticos (Antb/Sr-HA) y nuevas plataformas que han sido conformadas a partir de la doble sustitución iónica de la HA donde uno de esos iones es el estroncio y el otro algún elemento metálico con actividad antibacteriana demostrada (M/Sr-HA).
Palabras clave: Hidroxiapatita sustituida con estroncio; Hidroxiapatita con antibióticos; Hidroxiapatita con doble sustitución metálica; Sustitutos óseos antibacterianos.
Abstract
Hydroxyapatite (HA) is a calcium phosphate with great analogy to biological apatite. Because of that it has demonstrated excellent results in clinical applications for bone tissue replacement. However, there are certain pathologies such as osteopenia or osteoporosis where the natural bone formation capacity is diminished and which may require an extra stimulus to accelerate and guarantee the osseointegration processes. In these cases, doping hydroxyapatite with strontium ions (Sr-HA) has given excellent results. This ion participates in bone metabolism in various ways and, while stimulating osteosynthesis, it inhibits osteoclast to a certain extent, which as a whole promotes the formation of new bone more quickly. Thus, the development of Sr-HA implants has evolved to not only consider substitutes for bone tissue with greater speed of osseointegration, but also to become platforms for the release of other active ingredients that can also counteract different medical conditions. This work delves into the complexity of septic processes associated with prostheses, which justifies the diversity of approaches to this clinical problem from biomedical engineering. In addition, review different formulations based on Sr-HA reported to eradicate septic processes. In particular, it explores new devices carrying antibiotics (Antb/Sr-HA) and new platforms that have been formed from the double ion doping of the HA where one of those ions is strontium and the other is some metallic element with demonstrated antibacterial activity (M/Sr-HA).
Keywords: Strontium-doped hydroxyapatite; Hydroxyapatite with antibiotics; Hydroxyapatite with double metal doping; Antibacterial bone substitutes
Leer Artículo Completo
INTRODUCCIÓN
El incremento del número de pacientes con lesiones óseas tributarias de intervenciones quirúrgicas que requieren de reemplazo o reconstrucción de los tejidos duros constituye en la actualidad un gran desafío para la comunidad científica. Ello justifica la avalancha de reportes a nivel internacional y por más de 50 años de numerosas formulaciones químicas y multiplicidad de estructuras de dispositivos implantables en la búsqueda de un biomaterial ideal (1).
Significativos han sido los avances de la Ingeniería de Tejidos o la Regeneración Tisular Guiada las que utilizan implantes personalizados según la patología y las características del defecto óseo del paciente. Entre las propiedades específicas que éstos dispositivos implantables deben cumplir, destacan: i) ser biocompatibles, osteoconductores, osteoinductores, bioactivos, bioestables o biodegradables según su composición química (1), ii) poseer estructura 3D y porosidad que les permita ser biofuncionales desde el punto de vista mecánico (2), y adicionalmente iii) que puedan liberar gradualmente al medio biológico: iones, moléculas, células o grupos de principios activos que aceleren los procesos de osteointegración, mejoren la biocompatibilidad celular o contrarresten patologías de diversa etiología (3).
Dentro de la amplia variedad de biomateriales que se evalúan hoy como sustitutos del tejido óseo han cobrado auge las investigaciones con la hidroxiapatita con sustituciones iónicas (X-HA) (4,5,6). Si bien a la fecha, los resultados de aplicaciones clínicas de la hidroxiapatita pura (HA) han sido más que efectivos en diversos campos de la biomedicina (7), la hidroxiapatita con sustituciones parciales de otros iones abre nuevas posibilidades de aplicaciones porque puede diseñarse para acelerar los diferentes procesos biológicos que intervienen en la curación del tejido u otorgarle nuevas funcionalidades (8).
En particular, la hidroxiapatita sustituida con iones estroncio (Sr-HA) ha llamado la atención de diferentes grupos de investigación dado que el ion Sr2+ participa de diferentes maneras en el metabolismo óseo y hasta ahora es el único que se reconoce que favorece la formación ósea a la par que inhibe en cierta medida la actividad osteoclástica (9,10,11,12).
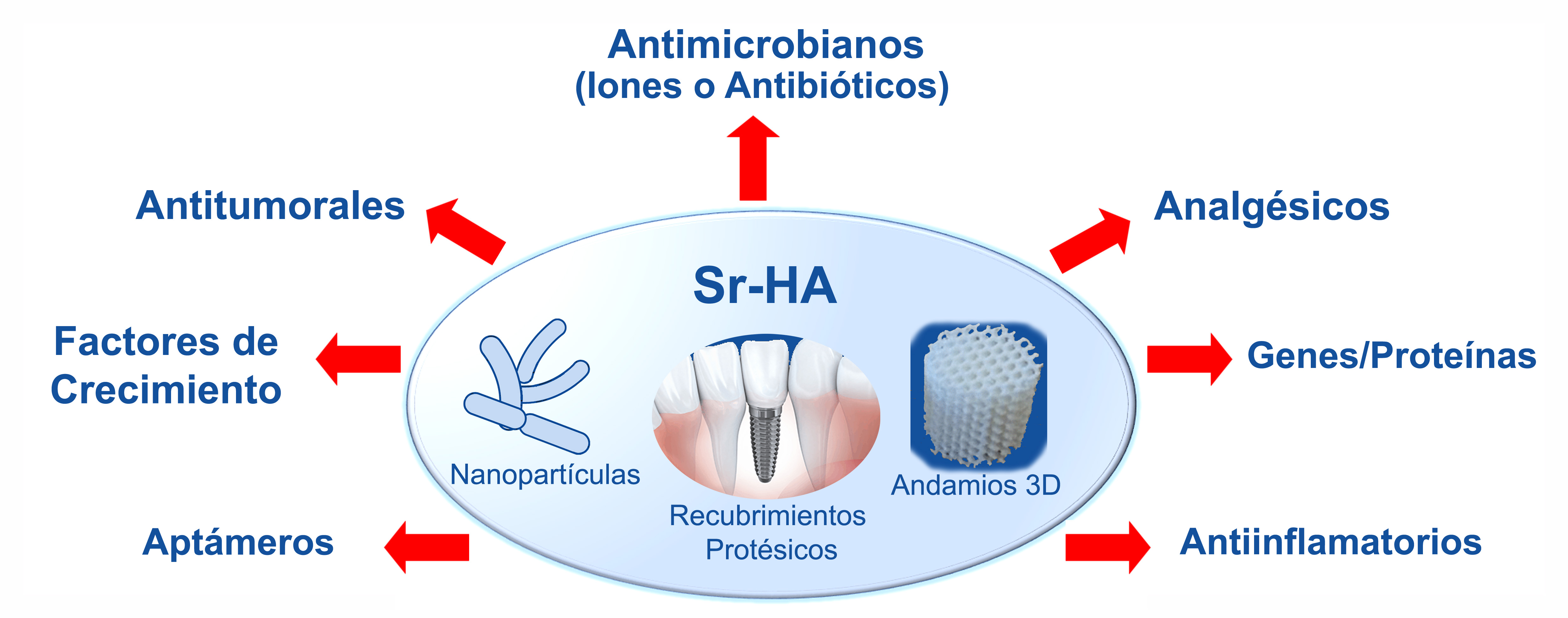
La literatura hoy día recoge diversas investigaciones asociadas a la evaluación de la efectividad de las metodologías de síntesis de Sr-HA, estudios sobre el efecto que ocasiona la presencia de este ion en la estructura de la red cristalina de la hidroxiapatita y en sus propiedades, así como, reportes de ensayos de su evaluación in vitro o in vivo. Más allá de que los resultados de las aplicaciones de las Sr-HA han sido muy alentadores (13,14), las investigaciones continúan, y han motivado que estos biomateriales también se hayan considerado como propuestas de plataformas para la liberación de diversos principios activos, Figura 1.
Figura 1. Representación esquemática de dispositivos de Sr-HA como plataformas para la liberación de principios activos
Las nuevas plataformas Sr-HA con acción farmacológica se valen de las modificaciones estructurales que ocasiona el Sr2+ en el cristal de HA, lo que permite partir de una hidroxiapatita nanométrica con alta área superficial, porosidad y/o mayor velocidad de degradación. El grado de sustitución iónica de Sr2+ se puede preseleccionar para obtener una cristalinidad y solubilidad específicas que permita un microambiente iónico que estimule la bioactividad, la adsorción de proteínas, el reclutamiento de células, los procesos de osteogénesis y angiogénesis, a la vez que disminuye la actividad osteoclástica y garantiza por mayor tiempo la liberación de la sustancia con actividad farmacológica (10). Así, diversos dispositivos a base de Sr-HA están siendo investigados para contrarrestar in situ tanto procesos sépticos, inflamatorios, tumorales o de toxicidad de los biomateriales, entre otros.
Este trabajo ofrece una panorámica de las complejidades asociadas a las infecciones periprotésicas que condicionan la búsqueda intensiva de nuevos sistemas para liberación in situ de sustancias antimicrobianas, y a la vez, aborda investigaciones relativas al desarrollo de nuevas plataformas de Sr-HA con actividad antimicrobiana a través de: i) la inclusión de antibióticos de diversa índole a los dispositivos (Antb/Sr-HA) y ii) la incorporación de doble sustitución iónica a la hidroxiapatita con algún co-ion con actividad antibacteriana (M/Sr-HA).
CUERPO DE LA REVISIÓN
Generalidades de las Infecciones Periprotésicas
Las afecciones sépticas músculo-esqueléticas tienen diferente etiología y en general resultan graves para los pacientes ya que ocasionan dolor intenso, abscesos, incapacidad y eventualmente pueden ocasionar amputaciones, sepsis generalizada o la muerte (15).
Estas complicaciones representan un gran desafío para el personal médico involucrado en su erradicación, y si están asociadas a prótesis articulares o implantes, muchas veces comprometen el éxito clínico de los implantes en sí mismos. Por ello, el análisis de esta problemática tiene múltiples aristas ya que diferentes factores inciden en la complejidad del cuadro clínico y en su resolución (16):
- Pueden ser multicausales ya que pueden deberse a multiplicidad de fuentes de contaminación, entre ellas: contaminación proveniente del propio salón quirúrgico por la calidad del aire, lavado de manos, deficiencias en la esterilización de la ropa, instrumental quirúrgico o implantes; también la contaminación puede depender del tipo de lesión o factores de riesgo del paciente.
- Pueden presentarse y diagnosticarse a diferentes tiempos después de la cirugía, desde el postoperatorio inmediato a incluso años después por diseminación de algún germen vía hematógena.
- Pueden deberse a gran variedad gérmenes, sean bacterias Gram (+), Gram (-), hongos, levaduras o combinación de ellos, los cuales pudieran ser susceptibles a los fármacos habituales o ser altamente resistentes.
- Además, las características de los materiales en sí mismos, o su acabado superficial, puede incidir en la colonización bacteriana dando lugar a la formación de Biofilms (17).
Esta combinación de factores hace que los protocolos de tratamiento sean complejos, los que van desde largos periodos de antibioticoterapia a la necesidad de múltiples intervenciones quirúrgicas con grandes costos hospitalarios y sufrimiento para el paciente. Así, a pesar de lo mucho que se ha avanzado en procederes que minimizan la contaminación, de la aplicación obligatoria de los principios básicos de asepsia, antisepsia o de la profilaxis antibiótica preoperatoria, el número de pacientes que son susceptibles de padecer sepsis en la actualidad sigue en ascenso y resulta sumamente alto ya que el número de intervenciones quirúrgicas a nivel global se incrementa continuamente (18,19,20).
Plataformas de Sr-HA con efectos antimicrobianos: incorporación de antibióticos (Antb/Sr-HA)
La complejidad de las infecciones periprotésicas conlleva a que resulte vital prevenir la adhesión bacteriana inicial a la superficie del implante y para ello es importante que el dispositivo en sí mismo sea antibacteriano. Se ha determinado que existe un periodo crítico de prevención de la infección postoperatoria (4-6 horas) luego de la colocación de implantes. Por ello la liberación de una alta concentración de fármaco en ese intervalo es imprescindible en aras de evitar la formación del Biofilm en la superficie del implante (21).
En la actualidad el empleo de nanopartículas, o de superficies nanoestructuradas con alta área superficial garantiza una alta eficiencia de carga del principio activo, en este caso de los antibióticos, que luego serán cedidos al medio. No obstante, garantizar la liberación a largo plazo a concentraciones superiores a las Concentraciones Mínimas Inhibitorias (CIM) para evitar la resistencia bacteriana se considera un gran reto aún no resuelto. Por ello, en ocasiones, es preciso recurrir a más de un principio activo en el biomaterial para combinar diferentes mecanismos de acción que contrarresten infecciones polimicrobianas o para evitar los procesos de adaptación bacteriana que conduzcan a resistencia.
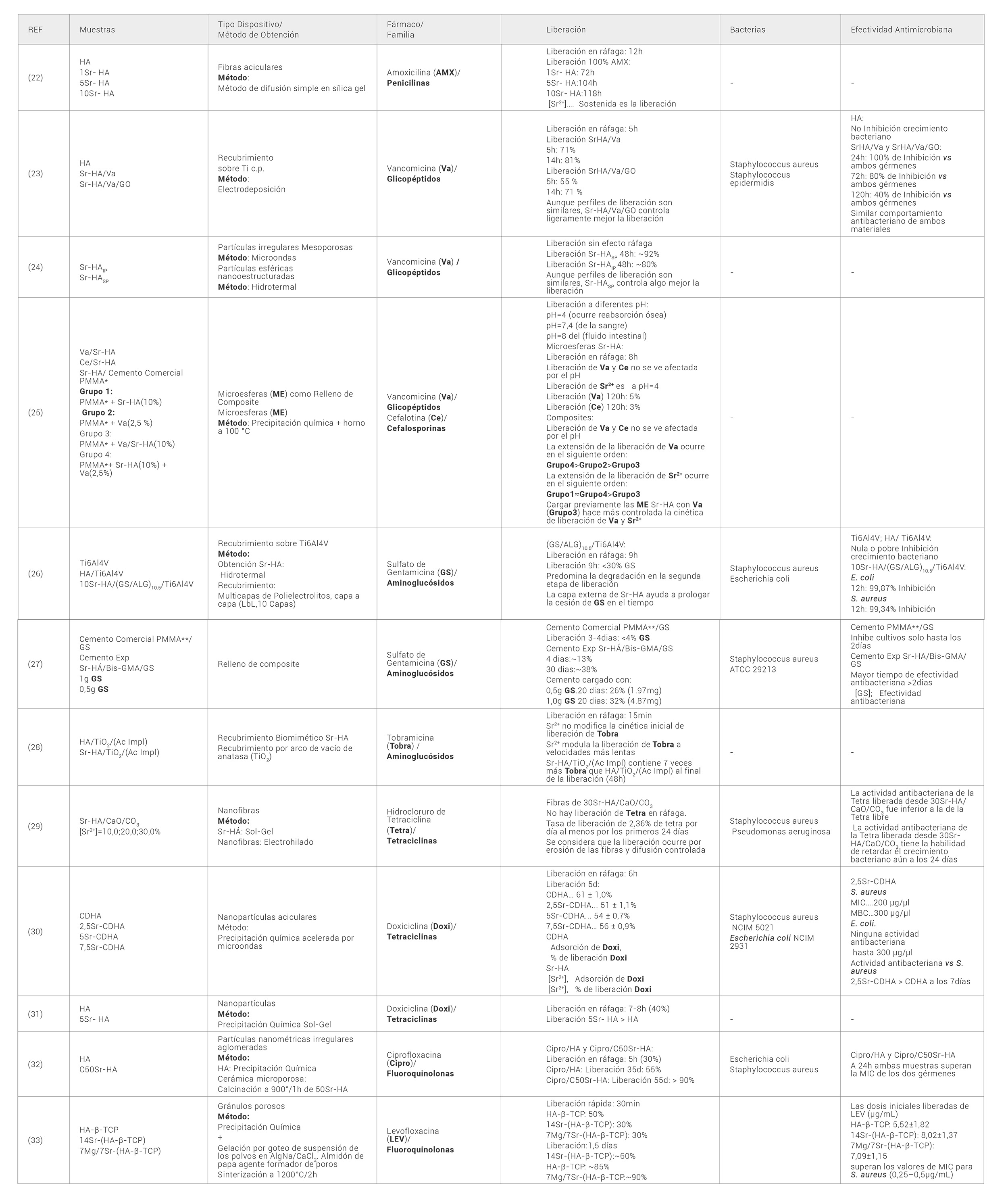
A la fecha, diversos son los dispositivos sustitutos de tejido óseo con actividad antimicrobiana a base de Antb/Sr-HA. Se han estudiado desde nanopartículas, microesferas, recubrimientos de metales, materiales compuestos u otros. Además, los antibióticos que se han considerado han sido de diferentes familias: Penicilinas, Glicopéptidos, Cefalosporinas, Aminoglucósidos, entre otros, lo que abarca diversos mecanismos de acción antibacteriana para contrarrestar diferentes tipos de gérmenes. La Tabla 1 es una muestra de la diversidad de propuestas que se han investigado.
Tabla 1. Biomateriales Antb/Sr-HA con propiedades antibacterianas
Materiales: HA: Hidroxiapatita; Sr-HA: Hidroxiapatita sustituida con estroncio; GO: Óxido de Grafeno; Cemento Comercial PMMA*: Cemento óseo comercial de poli(metacrilato de metilo) Osteopal V (Heraues Medical); ALG: Alginato de Sodio; Ac Impl: Implantes dentales de acero Inoxidable; Cemento Comercial (PMMA**/GS): Cemento óseo comercial de poli(metacrilato de metilo) con 1g Gentamicina (Depuy’s SmartSet EnduranceTM); Cemento Exp: Cemento Experimental con resina de bisfenol -A- glicidil éter metacrilato (Bis-GMA); CDHA: Hidroxiapatita deficiente en calcio; Susceptibilidad antimicrobiana: MIC: Concentración Mínima Inhibitoria; MBC: Concentración Mínima Bactericida
En general los estudios de estas nuevas estructuras comprenden ensayos que incluyen tanto la determinación de la eficiencia de adsorción del fármaco en el biomaterial, la evaluación de sus perfiles de liberación, así como la valoración de su actividad antimicrobiana tanto frente a gérmenes Gram (+) como Gram (-).
Con frecuencia, se describe que la liberación trascurre en dos etapas. La primera etapa se caracteriza por una liberación rápida del fármaco adsorbido en la superficie (liberación en ráfaga) y posteriormente prima una cesión lenta al medio de la porción que se encuentra ocluida. El análisis de los sistemas propuestos evidencia que la liberación rápida inicial abarca períodos muy variables: breves de 15-30 min (28,29), a más largos de 9 a 12h (22, 26). Encontrándose también que hay propuestas que no manifiestan el efecto ráfaga (29). De igual manera los dispositivos descargan la totalidad del fármaco liberable en tiempos muy heterogéneos, los que van desde 48h (24) a 55 días (32).
En la mayoría de los sistemas portadores de medicamentos, la interacción fármaco-sustrato se basa en la adsorción/absorción del principio activo donde solo priman interacciones débiles de tipo van der Waals o enlaces covalentes. Ello constituye una limitación ya que en la primera etapa se libera rápidamente gran cantidad del fármaco lo que pudiera causar toxicidad a las células y tejidos alrededor del implante (23), además de que se puede agotar gran parte del fármaco ocluido. El empleo de sistemas combinados (trifásicos) como por ejemplo: las propuestas con óxido de grafeno (GO) (23) ó anatasa (TiO2) (28) sobre implantes metálicos, resultan favorables ya que contribuyen a prolongar la cesión del fármaco en el tiempo, dado que las interacciones fármaco-sustrato comprende además la quimiosorción. Por su parte, el desarrollo de sistemas compuestos con fases poliméricas hidrófobas (ejemplo el PMMA) (25, 27) atenúa los procesos de difusión que ocurren a más largo plazo y conllevan a la liberación lenta del fármaco desde el interior de los dispositivos, por lo tanto, también constituye una alternativa para modular la liberación de los antibióticos.
Plataformas de Sr-HA con efectos antimicrobianos: doble sustitución a la hidroxiapatita (M/Sr-HA)
El empleo de co-sustituciones en la hidroxiapatita también ha resultado favorable para el desarrollo de plataformas Sr-HA con efectos antimicrobianos. Esta temática constituye hoy día un campo de investigación de extrema importancia y muy prolífico ya que los iones tienen varios mecanismos de acción antimicrobiana, los que al unísono conducen a la muerte de la célula bacteriana. Los efectos de los iones metálicos sobre las bacterias se reconocen como muy complejos y aún están bajo estudio (30). El hecho de que ellos actúen de diversas maneras sobre la célula bacteriana disminuye además la probabilidad de desarrollo de resistencia bacteriana (34). Sin embargo, las cantidades a incluir de iones metálicos en la estructura de la Sr-HA son limitadas ya que también pueden ser tóxicos al organismo humano por lo que debe existir un balance entre los beneficios que aportan y el riesgo asociado (34).
Otra de las razones de impulso de esta temática de investigación es el hecho de que la adsorción u oclusión de antibióticos en recubrimientos protésicos, composites o en nanopartículas para la preparación de otros tipos de dispositivos implantes trae la dificultad de la probable descomposición o inactivación del antimicrobiano (antibiótico) durante el proceso de esterilización del implante. Por ello el desarrollo de dispositivos de M/Sr-HA los que pueden ser esterilizados por varias metodologías sin cambiar su estructura y funcionalidad resulta trascendente. Estos biomateriales, además, al degradarse lentamente proporcionan mayor tiempo de liberación de los iones de la co-sustitución (35) con acción antibacteriana y a la vez también contribuyen a la presencia en el entorno biológico de los iones Sr2+, Ca2+ y PO43- que facilitan la osteointegración del implante.
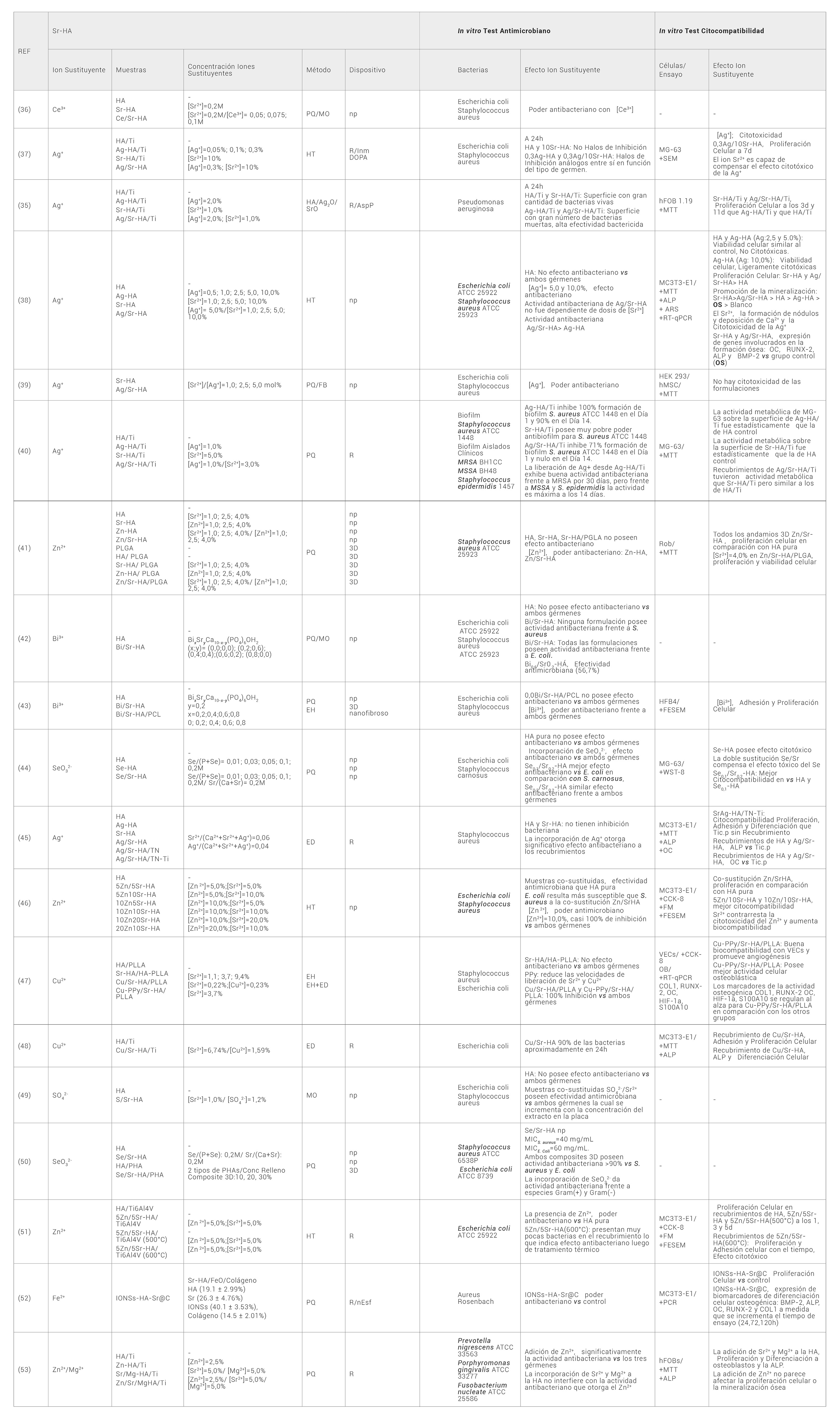
La Tabla 2 resume algunas propuestas de M/Sr-HA y los resultados obtenidos en cuanto efectividad antimicrobiana y biocompatibilidad celular de los biomateriales ensayados.
Tabla 2. Biomateriales con doble sustitución iónica M/Sr-HA con propiedades antibacterianas
Materiales: HA: Hidroxiapatita; PLGA: ácido (poli láctico-co-glicólico); Sr-HA: Hidroxiapatita sustituida con estroncio; OS: Medio de diferenciación osteogénico, PLLA: ácido (poli láctico); PPy: Polipirrol; PHAs: Poli(hidroxialcanoatos); IONSs-HA-Sr@C: nanoesferas de Fe2O3/Sr-HA/Colágeno; TN-Ti¨: Nanotubos de TiO2 sobre de Titanio c.p.
Método de síntesis: PQ: Precipitación Química; PQ/FB: Desde fuentes Biogénicas; MO: Microondas; HT: Método Hidrotermal; EH: Electrohilado; ED: Electrodeposición
Dispositivos: np: nanopartículas; 3D:andamios tridimensionales; R: Recubrimientos; R/Inm DOPA: Inmovilización asistida por dopamina; R/Asp P: Por aspersión de plasma; nEsf: Nanoesferas; ME: microesferas
Microorganismos: SARM: Staphylococcus aureus metilicina resistente; MSSA: Staphylococcus aureus metilicina sensible;
Líneas celulares: MG-63: Línea celular de osteosarcoma; hFOBs: Células osteoblásticas fetales humanas; VECs: Células vasculares endoteliales de riñón de rata; OB: Osteoblastos de cráneo de rata; MC3T3-E1: Línea celular preosteoblástica murina; HEK 293: células embrionarias de riñón humano; hMSC: células madre mesenquimales humanas; Rob: Línea celular primaria de osteoblastos de rata; HFB4: línea celular de fibroblastos humanos
Ensayos: SEM: Microscopia Electrónica de Barrido; MTT: mide actividad metabólica, indicador de viabilidad, proliferación y citotoxicidad (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio); ARS: tinción con Rojo de Alizarina, se utiliza para teñir depósitos de calcio en tejidos (Alizarin Red S); RT-qPCR: Análisis cuantitativo reacción en cadena de la polimerasa con transcriptasa inversa; FESEM: Microscopia Electrónica de Barrido con Emisión de Campo; WST-8 tinte de tetrazolio soluble en agua para mejorar la sensibilidad del ensayo basado en MTS convencional, ensayo de actividad mitocondrial; CCK-8: ensayo para detectar número de células viables en proliferación y citotoxicidad (Cell Counting kit-8); FM: Microscopia de Fluorescencia; PCR: Reacción en cadena de la polimerasa en tiempo real
Biomarcadores de diferenciación osteogénica: ALP: Fosfatasa alcalina producida por los osteoblastos, su producción está correlacionada positivamente con la tasa de formación de hueso; OC: Osteocalcina hormona peptídica producida por los osteoblastos juega un papel importante en la regulación metabólica, la mineralización ósea y la homeostasis de iones de calcio; RUNX-2: Factor de transcripción asociado a la diferenciación de osteoblastos; BMP-2: Proteínas morfogénicas óseas, pertenece a la familia de los factores de crecimiento transformantes, con capacidad de inducir la formación de nuevo hueso, cartílago y tejido conjuntivo; COL1 : Colágeno tipo I ; HIF-1a: Proteína que crece en hipoxia; S100A10: El aumento del complejo anexina2-S100A10 aumenta la concentración de Ca2+ intracelular y promueve la proliferación de osteoblastos y por lo tanto la osteogénesis.
Como se observa la incorporación de co-iones a la Sr-HA resulta efectiva tanto frente a gérmenes Gram (+) como el Staphylococcus aureus contaminante frecuente en Artroplastia Totales de Cadera, de Rodilla, Osteomielitis entre otras patologías y lesiones (16) , también frente a cepas de gérmenes Gram (-) como las Pseudomonas aeruginosa responsables de muchas de las infecciones nosocomiales (54) o la Escherichia coli mayor causante de infecciones periprotésicas tardías ante eventos de septicemia (55).
De la Tabla 2 se aprecia también la diversidad de propuestas a base de M/Sr-HA, desde las propias nanopartículas, hasta otros dispositivos biomédicos implantables como son los recubrimientos de prótesis metálicas, gránulos, andamios 3D o incluso propuestas de membranas composites para vendajes de heridas de la piel (33, 43, 47). Destacar que si bien existen reportes del desarrollo de Sr-HA con sustituciones 0-100% de Sr2+, las investigaciones con doble sustitución iónica en la HA por lo general son a bajas dosis de estroncio: hasta un 20%, según lo encontrado.
Asociado a los efectos “positivos” de estos elementos metálicos contra las bacterias patógenas, también existen estudios que evalúan los efectos citotóxicos que estos iones metálicos podrían provocar en células humanas al liberarse desde la HA pura. Por tanto, una estrategia actual es emplearlos como co-iones de la Sr-HA dado que el ion Sr2+ es un ion con múltiples efectos favorables en el metabolismo óseo y puede en cierta medida contrarrestar la toxicidad de estos iones con efecto antimicrobiano (35, 39, 43, 47).
En este sentido de la Tabla 2 se aprecia que estudios realizados comparando recubrimientos de HA pura, Ag-HA, Sr-HA y Ag/Sr-HA sobre sustratos de titanio (Ti) considerando el efecto de hasta un 0,3% de Ag+ y un contenido fijo del 10% de Sr2+, se detecta que la adición de Ag+ a la HA genera un impacto negativo significativo en la proliferación de células tipo osteoblastos humanos. Sin embargo, a igual contenido de plata de conjunto con la presencia del ion Sr2+ en el cristal de HA, se compensa el efecto perjudicial de la Ag+ (37).
De forma similar experimentos Ag-HA con un mayor contenido de Ag+ (hasta 2,0% Ag+) depositada sobre implantes de titanio revelaron que muestras que contenían como sustituyente Ag+ eran altamente efectivas contra la colonización bacteriana de Pseudomonas aeruginosa (35). No obstante, en la evaluación in vitro de las interacciones células de osteoblastos fetales humanos con el biomaterial: las células en la superficie de HA pura, Sr-HA y Ag/Sr-HA mostraban excelente salud, mientras que algunas células sobre Ag-HA mostraban características disfuncionales como apoptosis prematura, diferenciación retardada, además de una pérdida casi completa de la actividad de la fosfatasa alcalina (ALP) funcional.
De esta manera los autores concluían que la adición de Sr2+ a los recubrimientos de Ag-HA compensaba de manera efectiva los efectos citotóxicos negativos de la Ag+ y sugirieron que la compensación de la citotoxicidad se puede deber a que el Sr2+ actúa como un competidor de Ag+ por sitios de unión específicos para la función celular (35), Tabla 2.
Asimismo, en la Tabla 2 se reportan otros ejemplos de plataformas de M/Sr-HA con propiedades antibacterianas en los que la presencia de una pequeña concentración del ion Sr2+ en las hidroxiapatitas con dobles sustituciones puede compensar la toxicidad de otros iones como el Cu2+ (48) o el Zn2+ (46, 51).
Por otra parte, debe señalarse que a pesar de que en la mayoría de los estudios no se ha demostrado que las diferentes formulaciones Sr-HA en sí mismas puedan manifestar efecto antimicrobiano, algunos autores han reportado que nanopartículas de hidroxiapatita deficiente en calcio (CDHA) sustituidas con estroncio sí tienen efecto bactericida según la concentración de iones en el medio (56).
La CDHA de fórmula [Ca10-x(HPO4)x(PO4)6-x(OH)2-x]; posee una relación Ca/P que va desde 1,3-1,66, por lo que al contener otros iones en su estructura, sus características de mayor área superficial, mayor bioactividad y mayor biodegradabilidad en comparación con la hidroxiapatita estequiométrica Ca/P=1,7 [Ca10(PO4)6(OH)2] ofrece ventajas para aplicaciones como sistemas de liberación de fármacos ya que se degrada en mayor extensión y proporciona mayor cantidad de iones al medio en menor tiempo.
Específicamente Ravi y colab. obtuvieron por síntesis acelerada con microondas, CDHA sustituidas en bajas concentraciones con estroncio (5% ó 10% del ion Sr2+) y demostraron que poseían efecto bactericida asociado al ion estroncio por sí mismo (56). Ellos detectaron que las colonias bacterianas disminuían significativamente en densidad para las Sr-CDHA. Específicamente en muestras de 5%Sr-CDHA la reducción microbiana era de un 25 % contra E. coli y de 13 % para S. aureus y en muestras 10%Sr-CDHA de ~56 % para E. coli y de 35 % para S. aureus. Ellos relacionaron esta actividad bactericida al potencial zeta altamente negativo en comparación con la CDHA pura (56).
De forma similar Kumar y colb utilizaron un procedimiento equivalente de síntesis y obtuvieron nanopartículas de CDHA con sustituciones de Ag+ (0,25Ag-CDHA), Zn2+ (6Zn-CDHA) y Sr2+ (2,5Sr-CDHA) (30). Los resultados de los ensayos de efectividad antibacteriana frente a S. aureus y E. Coli a 24h dieron resultados muy positivos para la sustitución con plata y zinc y en menor proporción para la Sr-CDHA. No obstante, las muestras de 2,5Sr-CDHA sí demostraron actividad bactericida a partir de los 2 días de ensayo. Estos autores destacaron que la presencia del estroncio en el cristal en la CDHA disminuye generalmente la cristalinidad y este efecto tiene una repercusión importante en la solubilidad. En su trabajo, las muestras de Sr-CDHA fueron las que se disolvieron en mayor proporción en PBS, de forma que, a los 21 días, las muestras de 2,5Sr-CDHA se habían degradado en un 90%. El orden de degradación detectado fue el siguiente: Sr-CDHA > CDHA > Zn-CDHA > Ag-CDHA, por lo que concluyeron que la elevada concentración de iones Sr2+ en solución fue lo que posibilitó el efecto antibacteriano a mayor plazo (30).
Estos autores adicionalmente al efecto antibacteriano detectado por la inclusión de un ion metálico en la CDHA evaluaron la inclusión de Doxiciclina en el sistema como vía para la obtención de un efecto dual en las propiedades antimicrobianas (metal plus antibiótico) y anular la posibilidad del surgimiento de resistencia bacteriana. Así, el objetivo de su estudio era garantizar que la actividad antibacteriana inicial fuera proporcionada fundamentalmente por el antibiótico adsorbido superficialmente y posteriormente prevaleciera la cesión lenta al medio del fármaco ocluido y de los otros iones liberados (Ag+, Zn2+ ó Sr2+) como consecuencia de la degradación del biomaterial (30). Los resultados que obtuvieron demostraron su hipótesis, dado que, si bien la adsorción de Doxiciclina estuvo ligeramente disminuida para todas las CDHA con sustituciones iónicas en comparación con la CDHA pura, la actividad antibacteriana a las 24 horas tanto para la CDHA como para la CDHA con bajo contenido de estroncio (2,5%) resultó superior al 90% frente a S. aureus. Además, las muestras 2,5Sr-CDHA poseían en sí mismas mayor actividad antibacteriana frente a S. aureus en comparación con la CDHA pura de acuerdo a las curvas de muerte de ese germen a los 7 días. Este hecho se asoció a la presencia de los iones Sr2+ liberados al medio por degradación. La presencia del ion estroncio además de una actividad antibacteriana extra, posibilita que el biomaterial resulte más biocompatible y con efectos positivos adicionales para la regeneración ósea.
CONCLUSIONES
Los biomateriales implantables a base de Sr-HA han sido evaluados en los últimos años de forma intensiva como materiales sustitutivos del tejido óseo con resultados promisorios. Adicionalmente a la demostración de los efectos positivos del Sr2+ en la remodelación ósea, estos sistemas se han considerado como plataformas para la liberación de principios activos con actividad antimicrobiana. Dada la complejidad de las infecciones periprotésicas asociadas a los implantes óseos, dos rutas fundamentales han sido exploradas: i) la adición de antibióticos a la Sr-HA (Antb/Sr-HA) y ii) la incorporación de dobles sustituciones en la Sr-HA (M/Sr-HA). Los resultados de ambos sistemas han indicado grandes potencialidades de estos nuevos biomateriales con efectividad frente a gérmenes Gram (+) y Gram (-), con perfiles de liberación que garantizan en una primera etapa alta concentración del antimicrobiano para contrarrestar la formación del Biofilm y de liberaciones que se pueden modular a mayores plazos de tiempo con concentraciones superiores a la CIM.
Asimismo, ha quedado demostrado que la presencia del ion Sr2+ puede per se tener efecto antimicrobiano in situ en dependencia de si se parte de una hidroxiapatita deficiente en calcio (CDHA) que posibilite una alta concentración de iones en el medio como consecuencia de su biodegradación. También que la liberación del ion Sr2+ compensa en cierta medida la toxicidad de los iones metálicos en los sistemas M/Sr-HA. Ello permite una multiplicidad de opciones en el desarrollo de nuevos biomateriales con empleo de metales capaces de incluirse en la red cristalina de la HA, los que, si bien tienen efectividad antibacteriana probada, también toxicidad asociada. Esta alternativa además de favorecer actividad antimicrobiana en la misma medida que persiste la biodegradación del implante, facilita los imprescindibles procesos de esterilización de los implantes para poder llevar en un futuro la metodología del laboratorio a la práctica clínica.
Así, la combinación en un mismo dispositivo de ambas rutas i) Antb/Sr-HA y ii) M/Sr-HA abre un nuevo camino hacia la generación de biomateriales más complejos, pero también más efectivos para lograr implantes osteointegrables y no susceptibles a sepsis.
Agradecimientos
Los autores agradecen el apoyo de la Oficina de Gestión de Fondos y Proyectos Internacionales del Ministerio de Ciencia, Tecnología y Medio Ambiente, Cuba; a través del Proyecto: Desarrollo de biomateriales nanoestructurados a partir de nanopartículas de fosfato de calcio (npCaP), del Programa Nacional de Nanociencia y Nanotecnologías, Cuba, Código PN211LH008-034.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Xue N, Ding X, Huang R, Jiang R, Huang H, Pan X, et al. Bone tissue engineering in the treatment of bone defects. Pharmaceuticals. 2022;15(7):879. doi: 10.3390/ph15070879
- ↑Collins MN, Ren G, Young K, Pina S, Reis RL, Oliveira JM. Scaffold fabrication technologies and structure/function properties in bone tissue engineering. Advanced functional materials. 2021;31(21):2010609. doi: 10.1002/adfm.202010609
- ↑Zhao C, Liu W, Zhu M, Wu C, Zhu Y. Bioceramic-based scaffolds with antibacterial function for bone tissue engineering: A review. Bioactive materials. 2022. doi: 10.1016/j.bioactmat.2022.02.010
- ↑Ressler A, Žužić A, Ivanišević I, Kamboj N, Ivanković H. Ionic substituted hydroxyapatite for bone regeneration applications: A review. Open Ceramics. 2021;6:100122. doi: 10.1016/j.oceram.2021.100122
- ↑Lodoso-Torrecilla I, Gunnewiek RK, Grosfeld E-C, de Vries RB, Habibović P, Jansen JA, et al. Bioinorganic supplementation of calcium phosphate-based bone substitutes to improve in vivo performance: a systematic review and meta-analysis of animal studies. Biomaterials Science. 2020;8(17):4792-809. doi: 10.1039/d0bm00599a
- ↑Tite T, Popa A-C, Balescu LM, Bogdan IM, Pasuk I, Ferreira JM, et al. Cationic substitutions in hydroxyapatite: Current status of the derived biofunctional effects and their in vitro interrogation methods. Materials. 2018;11(11):2081. doi: 10.3390/ma11112081
- ↑Fiume E, Magnaterra G, Rahdar A, Verné E, Baino F. Hydroxyapatite for biomedical applications: A short overview. Ceramics. 2021;4(4):542-63. doi: 10.3390/ceramics4040039
- ↑Yilmaz B, Alshemary AZ, Evis Z. Co-doped hydroxyapatites as potential materials for biomedical applications. Microchemical Journal. 2019;144:443-53. doi: 10.1016/j.microc.2018.10.007
- ↑Ren W-H, Xin S, Yang K, Yu Y-B, Li S-M, Zheng J-J, et al. Strontium‐Doped Hydroxyapatite Promotes Osteogenic Differentiation of Bone Marrow Mesenchymal Stem Cells in Osteoporotic Rats through the CaSR‐JAK2/STAT3 Signaling Pathway. Advanced NanoBiomed Research. 2022;2(9):2200018. doi: 10.1002/anbr.202200018
- ↑Wan B, Wang R, Sun Y, Cao J, Wang H, Guo J, et al. Building osteogenic microenvironments with strontium-substituted calcium phosphate ceramics. Frontiers in Bioengineering and Biotechnology. 2020;8:591467. doi: 10.3389/fbioe.2020.59146
- ↑Yan M-D, Ou Y-J, Lin Y-J, Liu R-M, Fang Y, Wu W-L, et al. Does the incorporation of strontium into calcium phosphate improve bone repair? A meta-analysis. BMC Oral Health. 2022;22(1):1-21. doi: 10.1186/s12903-022-02092-7
- ↑Lourenco AH, Torres AL, Vasconcelos DP, Ribeiro-Machado C, Barbosa JN, Barbosa MA, et al. Osteogenic, anti-osteoclastogenic and immunomodulatory properties of a strontium-releasing hybrid scaffold for bone repair. Materials Science and Engineering: C. 2019;99:1289-303. doi: 10.1016/j.msec.2019.02.053
- ↑Alyousef NI, Almaimouni YK, Benrahed MA, Khan AS, Shahid S. Effects of strontium substitution in synthetic apatites for biomedical applications. Handbook of Ionic Substituted Hydroxyapatites: Elsevier; 2020. p. 307-25. doi: 10.1016/B978-0-08-102834-6.00013-6
- ↑Moradi K, Sabbagh Alvani A. First-principles study on Sr-doped hydroxyapatite as a biocompatible filler for photo-cured dental composites. Journal of the Australian Ceramic Society. 2020;56(2):591-8. doi: 10.1007/s41779-019-00369-9
- ↑Sandiford NA, Franceschini M, Kendoff D. The burden of prosthetic joint infection (PJI). Annals of Joint. 2021;6. doi: 10.21037/aoj-2020-pji-11
- ↑Pietrocola G, Campoccia D, Motta C, Montanaro L, Arciola CR, Speziale P. Colonization and Infection of Indwelling Medical Devices by Staphylococcus aureus with an Emphasis on Orthopedic Implants. International journal of molecular sciences. 2022;23(11):5958. doi: 10.3390/ijms23115958
- ↑Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nature reviews microbiology. 2018;16(7):397-409. doi: 10.1038/s41579-018-0019-y
- ↑Kurtz SM, Lau EC, Son M-S, Chang ET, Zimmerli W, Parvizi J. Are we winning or losing the battle with periprosthetic joint infection: trends in periprosthetic joint infection and mortality risk for the medicare population. The Journal of arthroplasty. 2018;33(10):3238-45. doi: 10.1016/j.arth.2018.05.042
- ↑Kim HS, Park JW, Moon S-Y, Lee Y-K, Ha Y-C, Koo K-H. Current and future burden of periprosthetic joint infection from national claim database. Journal of Korean Medical Science. 2020;35(49):e410. doi: 10.3346/jkms.2020.35.e410
- ↑Lenguerrand E, Whitehouse MR, Beswick AD, Toms AD, Porter ML, Blom AW. Description of the rates, trends and surgical burden associated with revision for prosthetic joint infection following primary and revision knee replacements in England and Wales: an analysis of the National Joint Registry for England, Wales, Northern Ireland and the Isle of Man. BMJ open. 2017;7(7):e014056. doi: 10.1136/bmjopen-2016-014056
- ↑Wang G, Zhang H, He Q, Tong D, Ding C, Liu P, et al. Micro-patterned titanium coatings with a grid-like structure doped with vancomycin against bacteria and affecting osteogenic differentiation. RSC advances. 2017;7(32):19565-75. doi: 10.1039/c6ra27996a
- ↑Suganthi R, Elayaraja K, Joshy MA, Chandra VS, Girija E, Kalkura SN. Fibrous growth of strontium substituted hydroxyapatite and its drug release. Materials Science and Engineering: C. 2011;31(3):593-9. doi: 10.1016/j.msec.2010.11.025
- ↑Zhang X, Song G, Qiao H, Lan J, Wang B, Yang H, et al. Novel ternary vancomycin/strontium doped hydroxyapatite/graphene oxide bioactive composite coatings electrodeposited on titanium substrate for orthopedic applications. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2020;603:125223. doi: 10.1016/j.colsurfa.2020.125223
- ↑Singh RP, Singh G, Singh H. Sub-micrometric mesoporous strontium substituted hydroxyapatite particles for sustained delivery of vancomycin drug. Journal of the Australian Ceramic Society. 2019;55:405-14 .doi: 10.1007/s41779-018-0248-6
- ↑Zarazua Mujo M. In-vitro study of antibiotic and strontium release from hydroxyapatite spheres and its PMMA composite. 2011. Department of Engineering Sciences; Applied Materials Science, Uppsala University.
- ↑Yang K, Xin S-S, Qu H-Y, An G, Wu X-F, Li S-Q, et al. Gentamicin loaded polyelectrolyte multilayers and strontium doped hydroxyapatite composite coating on Ti-6Al-4V alloy: antibacterial ability and biocompatibility. Materials Technology. 2022;37(10):1478-85. doi: 10.1080/10667857.2021.1956850
- ↑Liu W, Wong C, Fong M, Cheung W, Kao R, Luk K, et al. Gentamicin‐loaded strontium‐containing hydroxyapatite bioactive bone cement—An efficient bioactive antibiotic drug delivery system. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2010;95(2):397-406. doi: 10.1002/jbm.b.31730
- ↑Wang B, Lilja M, Ma T, Sörensen J, Steckel H, Ahuja R, et al. Theoretical and experimental study of the incorporation of tobramycin and strontium-ions into hydroxyapatite by means of co-precipitation. Applied Surface Science. 2014;314:376-83. doi: 10.1016/j.apsusc.2014.06.193
- ↑Tsai S-W, Yu W-X, Hwang P-A, Huang S-S, Lin H-M, Hsu Y-W, et al. Fabrication and characterization of strontium-substituted hydroxyapatite-CaO-CaCO3 nanofibers with a mesoporous structure as drug delivery carriers. Pharmaceutics. 2018;10(4):179. doi: 10.3390/polym11111761
- ↑Sampath Kumar T, Madhumathi K, Rubaiya Y, Doble M. Dual mode antibacterial activity of ion substituted calcium phosphate nanocarriers for bone infections. Frontiers in Bioengineering and Biotechnology. 2015;3:59. doi: 10.3389/fbioe.2015.00059
- Sundarabharathi L, Chinnaswamy M, Parangusan H, Ponnamma D, Al-Maadeed MAA. Cytocompatibility and dielectric properties of Sr2+ substituted nano-hydroxyapatite for triggered drug release. Front Adv Mater Res. 2019;1:18-24.
- ↑Sangeetha K, Ashok M, Girija E, Vidhya G, Vasugi G. Strontium and ciprofloxacin modified hydroxyapatites as functional grafts for bone prostheses. Ceramics International. 2018;44(12):13782-9. doi: 10.1016/j.ceramint.2018.04.221
- ↑Marques C, Lemos A, Vieira S, e Silva OdC, Bettencourt A, Ferreira J. Antibiotic-loaded Sr-doped porous calcium phosphate granules as multifunctional bone grafts. Ceramics International. 2016;42(2):2706-16. doi: 10.1016/j.ceramint.2015.11.001
- ↑Godoy-Gallardo M, Eckhard U, Delgado LM, de Roo Puente YJ, Hoyos-Nogués M, Gil FJ, et al. Antibacterial approaches in tissue engineering using metal ions and nanoparticles: From mechanisms to applications. Bioactive Materials. 2021;6(12):4470-90. doi: 10.1016/j.bioactmat.2021.04.033
- ↑Fielding GA, Roy M, Bandyopadhyay A, Bose S. Antibacterial and biological characteristics of silver containing and strontium doped plasma sprayed hydroxyapatite coatings. Acta biomaterialia. 2012;8(8):3144-52. doi: 10.1016/j.actbio.2012.04.004
- Gopi D, Ramya S, Rajeswari D, Karthikeyan P, Kavitha L. Strontium, cerium co-substituted hydroxyapatite nanoparticles: Synthesis, characterization, antibacterial activity towards prokaryotic strains and in vitro studies. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2014;451:172-80. doi: 10.1016/j.colsurfa.2014.03.035
- ↑Geng Z, Cui Z, Li Z, Zhu S, Liang Y, Liu Y, et al. Strontium incorporation to optimize the antibacterial and biological characteristics of silver-substituted hydroxyapatite coating. Materials Science and Engineering: C. 2016;58:467-77. doi: 10.1016/j.msec.2015.08.061
- Li Y, Wang W, Han J, Li Z, Wang Q, Lin X, et al. Synthesis of silver-and strontium-substituted hydroxyapatite with combined osteogenic and antibacterial activities. Biological Trace Element Research. 2022:1-12. doi: 10.1007/s12011-021-02697-z
- ↑Ressler A, Ivanković T, Polak B, Ivanišević I, Kovačić M, Urlić I, et al. A multifunctional strontium/silver-co-substituted hydroxyapatite derived from biogenic source as antibacterial biomaterial. Ceramics International. 2022;48(13):18361-73. doi: 10.1016/j.ceramint.2022.03.095
- O’Sullivan C, O’Neill L, O’Leary ND, O’Gara JP, Crean AM, Ryan KB. Osteointegration, antimicrobial and antibiofilm activity of orthopaedic titanium surfaces coated with silver and strontium-doped hydroxyapatite using a novel blasting process. Drug Delivery and Translational Research. 2021;11:702-16. doi: 10.1007/s13346-021-00946-1
- Hassan M, Khaleel A, Karam SM, Al-Marzouqi AH, Ur Rehman I, Mohsin S. Bacterial Inhibition and Osteogenic Potentials of Sr/Zn Co-Doped Nano-Hydroxyapatite-PLGA Composite Scaffold for Bone Tissue Engineering Applications. Polymers. 2023;15(6):1370. doi: 10.3390/polym15061370
- Ahmed M, Mansour S, Mostafa MS, Darwesh R, El-Dek S. Structural, mechanical and thermal features of Bi and Sr co-substituted hydroxyapatite. Journal of Materials Science. 2019;54:1977-91. doi: 10.1007/s10853-018-2999-4
- ↑Ahmed M, Mansour S, Al-Wafi R, Abdel-Fattah E. Nanofibers scaffolds of co-doped Bi/Sr-hydroxyapatite encapsulated into polycaprolactone for biomedical applications. Journal of Materials Research and Technology. 2021;13:2297-309. doi: 10.1016/j.jmrt.2021.05.074
- Maqbool M, Nawaz Q, Atiq Ur Rehman M, Cresswell M, Jackson P, Hurle K, et al. Synthesis, characterization, antibacterial properties, and in vitro studies of selenium and strontium co-substituted hydroxyapatite. International Journal of Molecular Sciences. 2021;22(8):4246. doi : 10.3390/ijms2208424
- ↑Huang Y, Zhang X, Zhang H, Qiao H, Zhang X, Jia T, et al. Fabrication of silver-and strontium-doped hydroxyapatite/TiO2 nanotube bilayer coatings for enhancing bactericidal effect and osteoinductivity. Ceramics International. 2017;43(1):992-1007. doi: 10.1016/j.ceramint.2016.10.031
- ↑Ullah I, Siddiqui MA, Kolawole SK, Liu H, Zhang J, Ren L, et al. Synthesis, characterization and in vitro evaluation of zinc and strontium binary doped hydroxyapatite for biomedical application. Ceramics International. 2020;46(10):14448-59. doi: 10.1016/j.ceramint.2020.02.242
- ↑Liu Y, Zhang B, Liu F, Qiu Y, Mu W, Chen L, et al. Strontium doped electrospinning fiber membrane with antibacterial and osteogenic properties prepared by pulse electrochemical method. Engineered Regeneration. 2022;3(4):339-51. doi: 10.1016/j.engreg.2022.07.005
- ↑Huang Y, Hao M, Nian X, Qiao H, Zhang X, Zhang X, et al. Strontium and copper co-substituted hydroxyapatite-based coatings with improved antibacterial activity and cytocompatibility fabricated by electrodeposition. Ceramics International. 2016;42(10):11876-88. doi: 10.1016/j.ceramint.2016.04.110
- Singh G, Singh RP. Multifunctional strontium-sulphate co-substituted hydroxyapatite nanopowders. Journal of Drug Delivery Science and Technology. 2021;65:102755. doi: 10.1016/j.jddst.2021.102755
- Marcello E, Maqbool M, Nigmatullin R, Cresswell M, Jackson PR, Basnett P, et al. Antibacterial composite materials based on the combination of polyhydroxyalkanoates with selenium and strontium co-substituted hydroxyapatite for bone regeneration. Frontiers in Bioengineering and Biotechnology. 2021;9:647007. doi: 10.3389/fbioe.2021.647007
- ↑Ullah I, Siddiqui MA, Liu H, Kolawole SK, Zhang J, Zhang S, et al. Mechanical, biological, and antibacterial characteristics of plasma-sprayed (Sr, Zn) substituted hydroxyapatite coating. ACS Biomaterials Science & Engineering. 2020;6(3):1355-66. doi: 10.1021/acsbiomaterials.9b01396
- Wei X, Zhang X, Yang Z, Li L, Sui H. Osteoinductive potential and antibacterial characteristics of collagen coated iron oxide nanosphere containing strontium and hydroxyapatite in long term bone fractures. Arabian Journal of Chemistry. 2021;14(3):102984. doi: 10.1016/j.arabjc.2020.102984
- Liu Y-C, Lee Y-T, Huang T-C, Lin G-S, Chen Y-W, Lee B-S, et al. In vitro bioactivity and antibacterial activity of strontium-, magnesium-, and zinc-multidoped hydroxyapatite porous coatings applied via atmospheric plasma spraying. ACS Applied Bio Materials. 2021;4(3):2523-33. doi: 10.1021/acsabm.0c01535
- ↑Shah NB, Osmon DR, Steckelberg JM, Sierra RJ, Walker RC, Tande AJ, et al. Pseudomonas prosthetic joint infections: a review of 102 episodes. Journal of Bone and Joint Infection. 2016;1(1):25-30. doi: 10.7150/jbji.15722
- ↑Honkanen M, Jämsen E, Karppelin M, Huttunen R, Eskelinen A, Syrjänen J, editors. Periprosthetic joint infections as a consequence of bacteremia. Open forum infectious diseases; 2019: Oxford University Press US. doi: 10.1093/ofid/ofz218
- ↑Ravi ND, Balu R, Sampath Kumar T. Strontium substituted calcium deficient hydroxyapatite nanoparticles: synthesis, characterization, and antibacterial properties. Journal of the American Ceramic Society. 2012;95(9):2700-8. doi: 10.1111/j.1551-2916.2012.05262.x
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Lizette Morejón Alonso. Centro de Biomateriales, Universidad de La Habana. Avda. Universidad, e/ Ronda y G, Vedado · 10400 La Habana, Cuba. E-mail: lizette@biomat.uh.cu