Original
Estudio de factores de riesgo en la recidiva bioquímica precoz y persistencia de PSA en pacientes sometidos a prostatectomía radical por cáncer de próstata
Study of risk factors for early biochemical recurrence and PSA persistence in patients undergoing radical prostatectomy for prostate cancer
Actual Med.2024;109(820):154-160 DOI: 10.15568/am.2024.820.or02
Recibido: 24/11/2024
Revisado: 12/12/2024
Aceptado: 15/12/2024
Resumen
Objetivos: Evaluar los factores de riesgo asociados con la recidiva bioquímica precoz y la persistencia del PSA en pacientes sometidos a prostatectomía radical.
Métodos: Se realizó un estudio retrospectivo en 126 pacientes intervenidos mediante prostatectomía radical (enero 2022 – julio 2023). Se incluyeron variables como el tipo de cirugía, márgenes quirúrgicos, PSA preoperatorio, grado de Gleason y resultados de la resonancia magnética. La recidiva bioquímica se definió como PSA ≥ 0,2 ng/ml y la persistencia del PSA como PSA detectable > 0,1 ng/ml. Se realizó estudio estadístico con SPSS 22.0, considerando significación estadística p≤0,05.
Resultados: De los 126 pacientes, el 17,5% presentó persistencia de PSA, asociada significativamente con márgenes quirúrgicos positivos (p=0,006) y cirugía abierta (p=0,040). La recidiva bioquímica precoz ocurrió en el 21% de los pacientes, mostrando una relación significativa con márgenes positivos (p=0,006), tipo de cirugía abierta (p=0,040), y un grado de Gleason elevado (p=0,040). No se encontró asociación concluyente entre la resonancia magnética y la persistencia del PSA o la RB (p=0,600).
Conclusiones: Los márgenes quirúrgicos positivos y la cirugía abierta son factores clave asociados con la persistencia del PSA y recidiva bioquímica precoz tras la prostatectomía radical. El grado del Gleason solo ha mostrado relación con la recidiva bioquímica precoz. Estos resultados sugieren la necesidad de un seguimiento más prolongado en pacientes de alto riesgo y una mayor atención a los márgenes quirúrgicos.
Palabras clave: Cáncer de próstata; Persistencia PSA; Recidiva bioquímica.
ABSTRACT
Objective: To evaluate risk factors associated with early biochemical recurrence and PSA persistence in patients undergoing radical prostatectomy.
Methods: A retrospective study was performed on 126 patients who underwent radical prostatectomy between January 2022 and July 2023. Variables such as the type of surgery, surgical margins, preoperative PSA levels, Gleason grade, and magnetic resonance imaging (MRI) results were included. Biochemical recurrence was defined as a PSA level ≥ 0.2 ng/ml, and PSA persistence was defined as a detectable PSA > 0.1 ng/ml after surgery. Statistical analysis was performed using SPSS 22.0, with statistical significance set at p ≤ 0.05.
Results: Of the 126 patients, 17.5% presented PSA persistence, which was significantly associated with positive surgical margins (p = 0.006) and open surgery (p = 0.04). Early biochemical recurrence occurred in 21% of patients and was significantly associated with positive surgical margins (p = 0.006), open surgery (p = 0.040), and a high Gleason grade (p = 0.040). No significant association was found between MRI findings and PSA persistence or biochemical recurrence (p = 0.600).
Conclusions: Positive surgical margins and open surgery are key factors associated with PSA persistence and early biochemical recurrence after radical prostatectomy. Additionally, a high Gleason grade has been shown to be associated with early biochemical recurrence. These findings suggest the need for longer follow-up in high-risk patients and greater attention to achieving negative surgical margins.
Keywords: Prostate cancer; PSA Persistance; Biochemical recurrence.
Leer Artículo Completo
INTRODUCCIÓN
El cáncer de próstata es una de las neoplasias más frecuentes a nivel mundial, representando el 7,3% de todos los casos de cáncer diagnosticados en 2022. Se posiciona como el cuarto tipo de cáncer más diagnosticado globalmente. En la población masculina, es el segundo tumor más frecuente, con una incidencia del 14,2%, solo superado por el cáncer de pulmón.
A nivel mundial, el cáncer de próstata sigue siendo una causa importante de mortalidad, con más de 400.000 muertes reportadas en 2022. Con el envejecimiento de la población, se espera un aumento en la incidencia de esta enfermedad (1), lo que subraya la necesidad urgente de mejorar tanto los enfoques preventivos como terapéuticos.
Aproximadamente entre el 15% y el 45% de los pacientes sometidos a una prostatectomía radical (PR) desarrollan recidiva bioquímica (RB), y de estos, entre el 20% y el 30% progresarán hacia una recurrencia clínica o metástasis (2,3). La mayoría de las recidivas ocurren en los primeros años después de la cirugía. Según Walz et al., el 58,5% de las recidivas bioquímicas suceden dentro de los primeros dos años tras la PR (4), mientras que otro estudio reporta que el 90% de las RB ocurrieron en los primeros cinco años (5).
A pesar de los avances en el tratamiento quirúrgico del cáncer de próstata, persiste una importante variabilidad en las tasas de RB tras la PR, lo que afecta significativamente el pronóstico a largo plazo. Factores como el PSA preoperatorio, el grado Gleason y los márgenes quirúrgicos se han identificado como predictores claves para la RB. Además, el tipo de cirugía (abierta o robótica) puede influir en las tasas de persistencia del PSA, siendo la cirugía abierta frecuentemente asociada con mayores tasas de RB y persistencia del PSA (3,6,7,8).
No obstante, algunos estudios recientes, como el de Chad R. Ritch et al., no encontraron diferencias significativas en las tasas de recidiva bioquímica cuando los pacientes fueron ajustados por factores clínico-patológicos (9). Sin embargo, otros estudios han indicado que la cirugía robótica presenta menores tasas de márgenes quirúrgicos positivos y una menor tasa de recidiva en pacientes de alto riesgo en comparación con la cirugía abierta(6). Esto sugiere que, aunque los resultados oncológicos a largo plazo pueden ser similares en términos globales, la cirugía robótica podría ofrecer ventajas en pacientes con mayor riesgo de recidiva.
Este estudio tiene como objetivo principal evaluar los factores de riesgo asociados a la recidiva bioquímica y la persistencia del PSA en pacientes sometidos a prostatectomía radical. Nos centraremos en variables clave como el PSA preoperatorio, la puntuación de Gleason, resultado RMN y los márgenes quirúrgicos.
MATERIAL Y MÉTODOS
Se llevó a cabo un estudio retrospectivo de los pacientes intervenidos mediante prostatectomía radical abierta y robótica, en nuestro centro, diagnosticados de cáncer de próstata mediante biopsia transperineal, desde enero de 2022 hasta julio de 2023. Se incluyeron aquellos con seguimiento completo tras la intervención. Se excluyeron los que recibieron tratamiento adyuvante, aquellos con metástasis o ganglios linfáticos positivos (N positivos) de inicio, y aquellos que no contaban con datos de seguimiento.
A los pacientes se les realizó linfadenectomía si el riesgo estimado de afectación ganglionar era superior o igual al 7%, según el nomograma de Briganti de 2018.
Las variables recogidas incluyeron: edad al momento de la cirugía, tipo de cirugía (abierta o robótica), márgenes quirúrgicos (positivos o negativos), PSA en la biopsia, PSA postoperatorio, fecha y ultimo PSA, grado de Gleason de la pieza quirúrgica, resultados de la RMN preoperatoria.
La recidiva bioquímica precoz (RB) se definió como un nivel confirmado de PSA ≥ 0,2 ng/ml en al menos dos determinaciones sucesivas, en el primer año postoperatorio. La persistencia del PSA se definió como un nivel de PSA detectable que no disminuye por debajo de 0,1 ng/ml tras la cirugía. El seguimiento de los pacientes incluyó mediciones de PSA cada 3-6 meses durante el primer año postoperatorio, cada 6 meses en los dos años siguientes, y posteriormente, anualmente.
Para determinar los factores de riesgo asociados a la recidiva bioquímica precoz y la persistencia del PSA tras la cirugía, se realizaron análisis estadísticos mediante modelos de regresión univariable. Se incluyeron en los modelos aquellas variables con una significación estadística en el análisis univariable (p < 0,05). Las variables analizadas en los modelos fueron: edad, tipo de cirugía (abierta o robótica), márgenes quirúrgicos (positivos o negativos), PSA preoperatorio, puntuación de Gleason de la pieza quirúrgica, y los resultados de la resonancia magnética preoperatoria (incluyendo las clasificaciones Pi-Rads).
Los análisis se realizaron con el software SPSS v.22 utilizando un valor de p < 0,05 como umbral para la significación estadística.
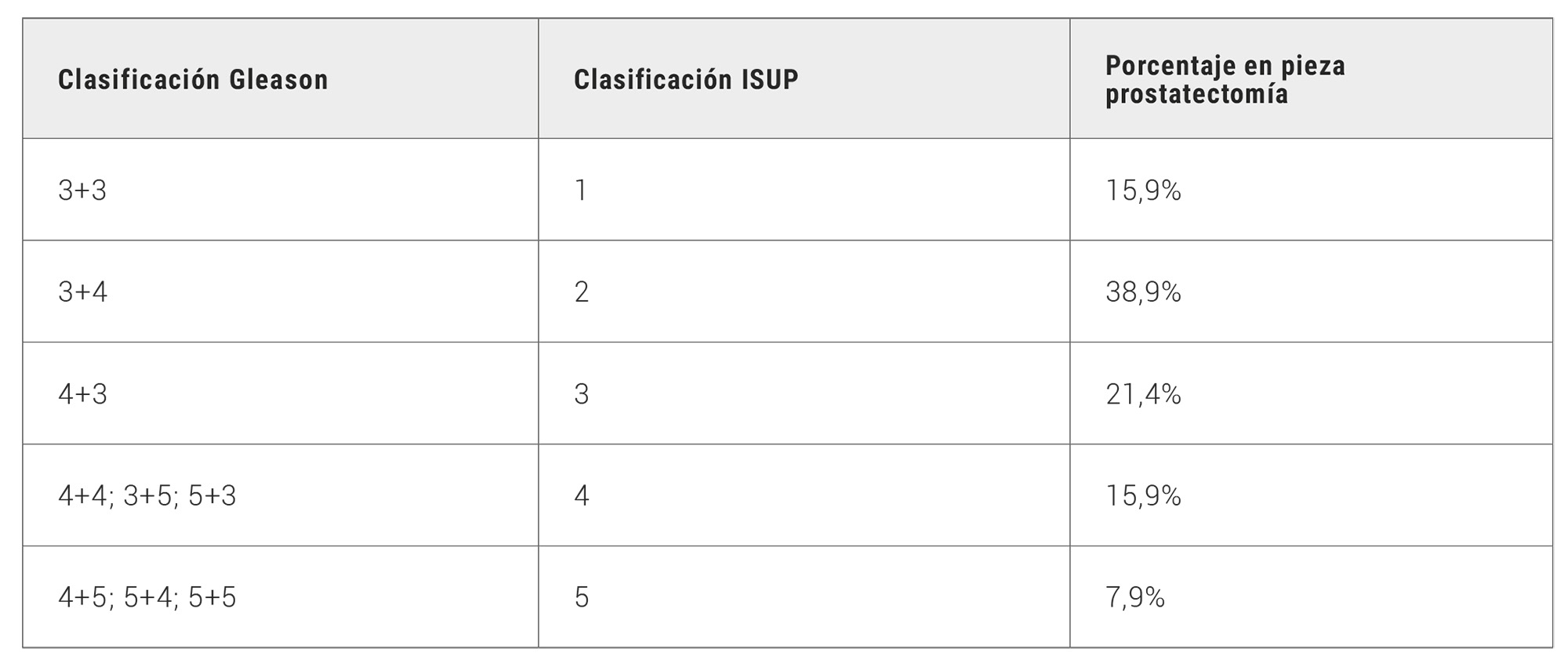
RESULTADOS
Se incluyeron en el estudio 126 pacientes diagnosticados de cáncer de próstata mediante biopsia transperineal. La edad media fue de 66,46 ± 6,95 años. PSA medio al diagnóstico de 6,31 ± 3,98 ng/dl. En relación con el resultado histológico tras la prostatectomía radical, 15,9% ISUP 1, 38,9% ISUP 2, 21,4% ISUP 3, 15,9% ISUP 4 y 7,9% ISUP 5 (Tabla 1). Todos los pacientes incluidos para cirugía tenían realizada resonancia nuclear magnética previa a la biopsia prostática aportando los siguientes resultados: T2 72,2%; T3a 15,8%; T3b 1,6%. En relación con las lesiones Pi-Rads descritas en RNM se observa que el 18,9% no presentaban Pi-Rads significativo (1 y 2), 35,5% Pi-Rads 3; 24,6% Pi-Rads 4 y 21% Pi-Rads 5. En relación con los márgenes tras la cirugía (abierta o robótica), se observan márgenes positivos en un 42,1% de los pacientes. Se realizó linfadenectomía en el 38% de los pacientes, observándose afectación ganglionar únicamente en 5 pacientes.
Tabla 1. Distribución del grado Gleason y grado ISUP en la pieza de prostatectomía radical en los pacientes incluidos en el estudio.
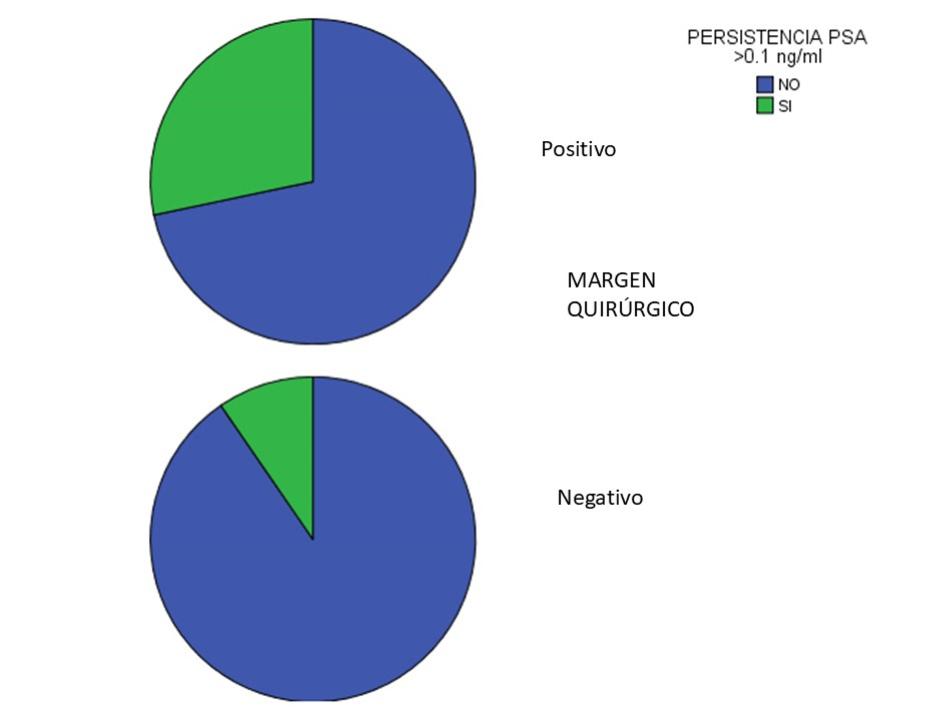
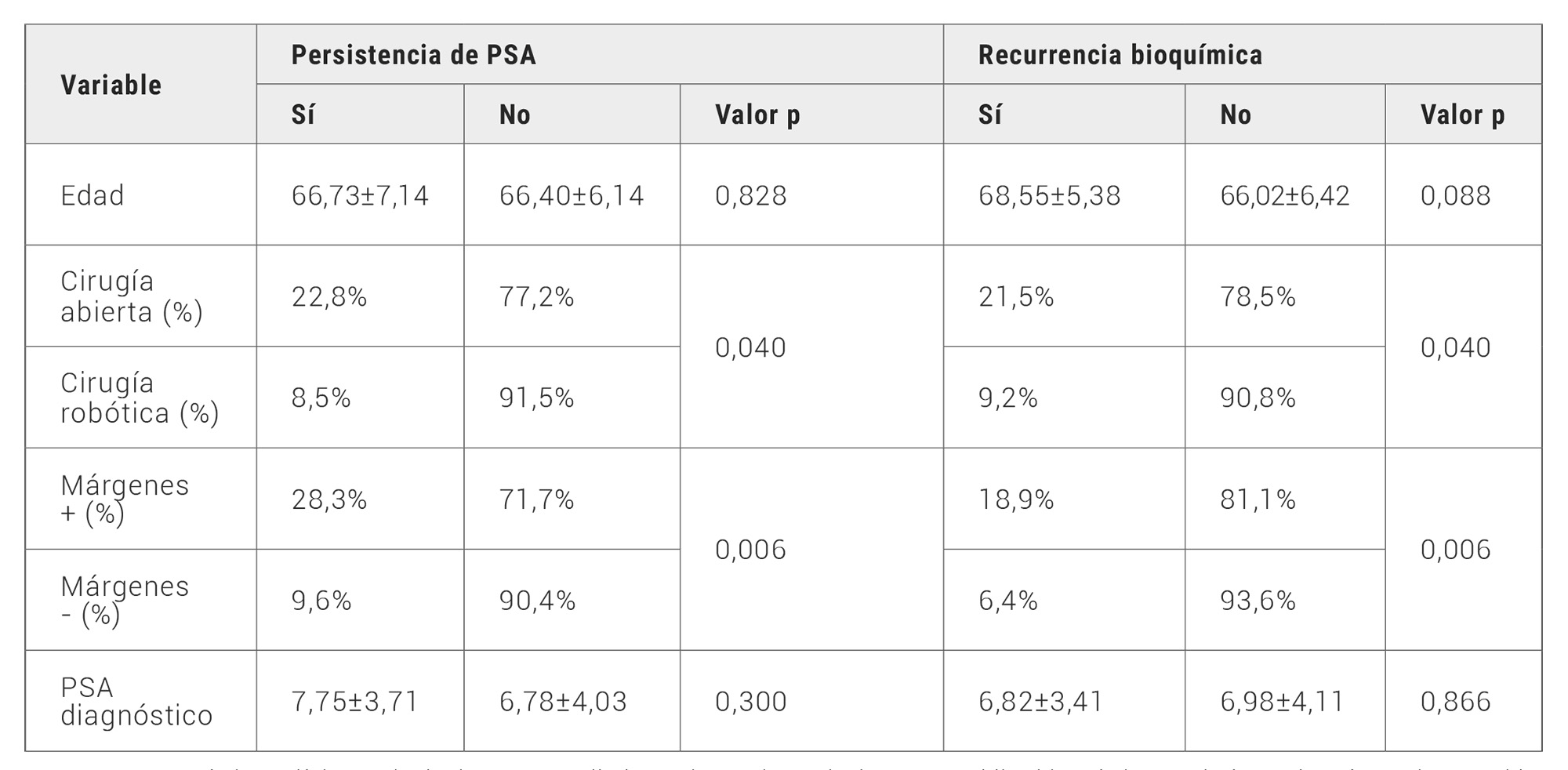
Se ha observado persistencia de PSA a los 3 meses de la cirugía (niveles de PSA >0,1 ng/dl) en el 17,5% de los pacientes. Se analizan diferentes factores implicados en la persistencia (edad, tipo de cirugía, niveles de PSA, Grado Gleason, márgenes y resultados de resonancia magnética). La edad y el PSA al diagnóstico no están relacionados con la persistencia de la enfermedad (p=0,800 y p=0,300 respectivamente). Existe relación estadísticamente significativa en la persistencia del PSA con los márgenes quirúrgicos positivos (p=0,006) (Figura 1), y con el tipo de cirugía, siendo más frecuente en la cirugía abierta (p=0,040) (Tabla 2). No encontramos relación estadísticamente significativa con el grado Gleason ni con el resultado de la resonancia magnética en la persistencia.
Figura 1. Persistencia de niveles de PSA según el resultado del margen quirúrgico
Tabla 2. Características clínicas principalmente estudiadas en la persistencia de PSA y recidiva bioquímica en el cáncer de próstata intervenido.
En relación con la recidiva bioquímica (presente en el 21%), valorada al año tras la cirugía, considerando niveles de PSA >0,2 ng/dl y analizando las mismas variables, observamos que: No hay relación con la edad o el PSA (p=0,088 y p=0,866 respectivamente). Si hay relación con el tipo de cirugía, siendo más frecuente en la cirugía abierta (p=0,040), con los márgenes positivos (p=0,006) (Tabla 2) y con el grado Gleason (p=0,040) (Figura 2). No encontramos relación significativa con los resultados de la resonancia magnética (p=0,600).
Figura 2. Persistencia de niveles de PSA según el resultado del margen quirúrgico
DISCUSIÓN
En nuestro estudio, se incluyeron 126 pacientes diagnosticados de cáncer de próstata, lo que permitió analizar diversos factores asociados a la persistencia del PSA y a la recidiva bioquímica (RB). Los hallazgos principales destacan que los márgenes quirúrgicos positivos y el tipo de cirugía fueron los predictores más relevantes de la persistencia del PSA, mientras que el grado de Gleason se asoció exclusivamente con la recidiva bioquímica.
Los márgenes quirúrgicos positivos se asociaron significativamente tanto a la persistencia del PSA (p=0,006) como a la recidiva bioquímica (p=0,006), lo que está en línea con estudios previos que han identificado los márgenes afectados como un factor crítico en la evolución postoperatoria de los pacientes(7,8,10). Shahabi et al. también observaron que los márgenes positivos y el estadio ≥ pT3a son predictores consistentes de recidiva temprana (11), sobre todo si se analiza el Gleason del margen positivo como menciona Ivan Lysenko et al. (12) Estos hallazgos refuerzan la idea de que la calidad de la resección quirúrgica, reflejada en los márgenes, juega un papel fundamental en el pronóstico de nuestros pacientes, tanto a corto como a largo plazo(8).
Nuestros resultados están en línea con los estudios que sugieren que la cirugía robótica puede ofrecer mejores resultados oncológicos especialmente en términos de márgenes quirúrgicos positivos y tasas de RB en pacientes de alto riesgo (6,11,13). En nuestro estudio, la cirugía abierta se asoció a una mayor tasa de persistencia del PSA(p=0,040) y recidiva bioquímica (p=0,040) en comparación con la cirugía robótica. No obstante, otros estudios, como el de Chad R. Ritch et al., no encontraron diferencias significativas entre las técnicas quirúrgicas cuando se ajustaron los pacientes por factores clínico-patológicos (9). Este contraste en los hallazgos podría estar relacionado con las características específicas de las cohortes de estudio, como la experiencia del cirujano o el volumen de casos tratados.
El grado Gleason (GG) también solo mostró una relación significativa con la RB (p=0,040), reforzando su valor como uno de los principales predictores del pronóstico oncológico. Estos hallazgos coinciden con la evidencia que sugiere que un Gleason elevado está asociado a un mayor riesgo de recidiva y progresión de la enfermedad, relacionado con la agresividad de la neoplasia(7,8,14).
Uniendo estas dos ideas, Lysenko et al. realizaron un análisis sistemático sobre la relación entre el grado de Gleason en los márgenes quirúrgicos positivos y el riesgo de recidiva bioquímica (RB), encontrando que un grado de Gleason más alto en el margen quirúrgico se asocia con un mayor riesgo de RB. En particular, los pacientes con un Gleason GG4 en los márgenes quirúrgicos positivos mostraron casi el doble de riesgo de desarrollar RB en comparación con aquellos con un GG3 (HR 1,87; IC 95% 1,53-2,28)(12) Esta es una característica que no evaluamos rutinariamente en nuestra práctica clínica, pero podría ser relevante para considerar en el futuro, dado que su inclusión en los informes patológicos podría ayudar a estratificar mejor el riesgo de recidiva y optimizar las decisiones terapéuticas.
Clásicamente se ha considerado un PSA elevado preoperatorio como factor de riesgo, alineándose con la clasificación de D’Amico (15), que considera un PSA preoperatorio ≥ 20 ng/mL como un factor de alto riesgo. Sin embargo, nuestros hallazgos no respaldan esta asociación de manera concluyente. Esta discrepancia se alinea con el estudio de Kattan et al , quienes ya señalaban que “no está claro por qué el PSA no mostró un efecto más fuerte tras ajustar por otros predictores”(2). Además, en el estudio de Nkengurutse et al., se observó que la dicotomización del PSA preoperatorio (<20 vs. ≥20 ng/mL) no fue un predictor significativo de la supervivencia libre de recidiva bioquímica (BCR)(16), lo que está en línea con nuestros propios resultados. Este contraste con la literatura podría reflejar la complejidad de los factores clínico-patológicos implicados y la necesidad de considerar un enfoque multidimensional para predecir con mayor precisión el riesgo de RB en pacientes con cáncer de próstata.
No observamos una relación significativa entre los resultados de la resonancia magnética (RMN) y la persistencia del PSA o la recidiva bioquímica (RB) (p=0,600). Aunque estudios previos han señalado el valor de la RMN en la predicción de la extensión tumoral y otros factores asociados a la RB (15,17,18), nuestros hallazgos no apoyan esta relación de manera concluyente. Es posible que la precisión de la RMN en predecir estos desenlaces esté limitada por las técnicas actuales. Nuevas tecnologías, como la radiómica (19,20), podrían ofrecer un análisis más profundo de las imágenes médicas, permitiendo identificar patrones mediante que no son visibles con las técnicas convencionales, mediante el empleo algoritmos computacionales. Sin embargo, se necesitan estudios adicionales para evaluar su implementación clínica y su impacto en el manejo del cáncer de próstata.
Los puntos fuertes de nuestro estudio son; en primer lugar, todos los pacientes fueron diagnosticados y tratados siguiendo protocolos estrictos en el mismo centro, lo que reduce la variabilidad en los resultados. Además, el uso de biopsia transperineal y resonancia magnética preoperatoria permitió una caracterización precisa del estadio tumoral, mejorando la identificación de pacientes de riesgo y la planificación quirúrgica.
Sin embargo, nuestro estudio no está exento de limitaciones. No se realiza análisis multivariante. El tamaño de la muestra es relativamente pequeño en comparación con otras cohortes reportadas en la literatura lo que podría limitar la generalización de los resultados, además de ser un único centro. No se han incluido variables sociodemográficas y de estilo de vida que podrían influir en la recidiva bioquímica. Además, el seguimiento a un año podría ser insuficiente para capturar completamente las tasas de recidiva tardía, dado que estudios previos sugieren que una proporción significativa de las recidivas bioquímicas (RB) ocurren después de los dos primeros años.
CONCLUSIONES
Nuestros resultados sugieren que los márgenes quirúrgicos positivos y el tipo de cirugía son factores clave en la persistencia del PSA y la recidiva bioquímica (RB) tras la prostatectomía radical, mientras que el grado de Gleason elevado se asocia únicamente con la RB. La cirugía abierta se asoció con mayores tasas de RB en comparación con la cirugía robótica, lo que sugiere que esta última podría ofrecer ventajas en pacientes de alto riesgo.
Aunque no observamos una asociación concluyente entre el PSA preoperatorio y la RB, el grado de Gleason parece mantener una relación importante con el pronóstico, en línea con estudios previos. Además, la falta de correlación significativa entre la RMN y la RB refuerza la necesidad de explorar tecnologías más avanzadas, como la radiómica, que podrían mejorar la capacidad predictiva.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63.
- ↑Kattan MW, Cuzick J, Fisher G, Berney DM, Oliver T, Foster CS, et al. Nomogram incorporating PSA level to predict cancer-specific survival for men with clinically localized prostate cancer managed without curative intent. Cancer. 2008;112(1):69-74.
- ↑Liesenfeld L, Kron M, Gschwend JE, Herkommer K. Prognostic Factors for Biochemical Recurrence More than 10 Years after Radical Prostatectomy. J Urol. 2017;197(1):143-8.
- ↑Walz J, Chun FKH, Klein EA, Reuther A, Saad F, Graefen M, et al. Nomogram Predicting the Probability of Early Recurrence After Radical Prostatectomy for Prostate Cancer. J Urol. 2009;181(2):601-8.
- ↑Caire AA, Sun L, Ode O, Stackhouse DA, Maloney K, Donatucci C, et al. Delayed Prostate-specific Antigen Recurrence After Radical Prostatectomy: How to Identify and What Are Their Clinical Outcomes? Urology. 2009;74(3):643-7.
- ↑Lantz A, Bock D, Akre O, Angenete E, Bjartell A, Carlsson S, et al. Functional and Oncological Outcomes After Open Versus Robot-assisted Laparoscopic Radical Prostatectomy for Localised Prostate Cancer: 8-Year Follow-up. Eur Urol. 2021;80(5):650-60.
- ↑Mithal P, Howard LE, Aronson WJ, Kane CJ, Cooperberg MR, Terris MK, et al. Prostate-specific antigen level, stage or Gleason score: Which is best for predicting outcomes after radical prostatectomy, and does it vary by the outcome being measured? Results from Shared Equal Access Regional Cancer Hospital database. Int J Urol. 2015;22(4):362-6.
- ↑García-Barreras S, Nunes I, Srougi V, Secin F, Baghdadi M, Sánchez-Salas R, et al. Factores predictivos de recidiva bioquímica temprana, intermedia y tardía tras prostatectomía radical mínimamente invasiva en una cohorte unicéntrica con seguimiento medio de 8 años. Actas Urol Esp. 2018;42(8):516-23.
- ↑Ritch CR, You C, May AT, Herrell SD, Clark PE, Penson DF, et al. Biochemical Recurrence–free Survival After Robotic-assisted Laparoscopic vs Open Radical Prostatectomy for Intermediate- and High-risk Prostate Cancer. Urology. 2014;83(6):1309-15.
- ↑Ojea Calvo A, González Piñeiro A, Domínguez Freire F, Alonso Rodrigo A, Rodríguez Iglesias B, Benavente Delgado J. Implicaciones pronósticas de los márgenes positivos de las piezas de prostatectomía radical. Actas Urol Esp. 2005;29(7):641-56.
- ↑Adhyam M, Gupta AK. A Review on the Clinical Utility of PSA in Cancer Prostate. Indian J Surg Oncol. 2012;3(2):120-9.
- ↑Lysenko I, Mori K, Mostafaei H, Enikeev DV, Karakiewicz PI, Briganti A, et al. Prognostic Value of Gleason Score at Positive Surgical Margin in Prostate Cancer: A Systematic Review and Meta-analysis. Clin Genitourin Cancer. 2020;18(5):e517-22.
- ↑Gettman MT, Blute ML. Critical comparison of laparoscopic, robotic, and open radical prostatectomy: techniques, outcomes, and cost. Curr Urol Rep. 2006;7(3):193-9.
- ↑Herranz-Amo F, Molina-Escudero R, Ogaya-Pinies G, Ramírez-Martín D, Verdú-Tartajo F, Hernández-Fernández C. Predicción de recidiva bioquímica tras prostatectomía radical. Nueva herramienta para la selección de candidatos a radioterapia adyuvante. Actas Urol Esp. 2016;40(2):82-7.
- ↑Algarra R, Zudaire B, Tienza A, Velis JM, Rincón A, Pascual I, et al. Optimización de los grupos de riesgo de D́Amico en prostatectomía radical añadiendo la información de la resonancia nuclear magnética. Actas Urol Esp. 2014;38(9):594-9.
- ↑Nkengurutse G, Tian F, Jiang S, Wang Y, Sun W. Preoperative Predictors of Biochemical Recurrence-Free Survival in High-Risk Prostate Cancer Following Radical Prostatectomy. Front Oncol. 2020;10:1761.
- ↑Gandaglia G, Ploussard G, Valerio M, Marra G, Moschini M, Martini A, et al. Prognostic Implications of Multiparametric Magnetic Resonance Imaging and Concomitant Systematic Biopsy in Predicting Biochemical Recurrence After Radical Prostatectomy in Prostate Cancer Patients Diagnosed with Magnetic Resonance Imaging–targeted Biopsy. Eur Urol Oncol. 2020;3(6):739-47.
- ↑Manceau C, Beauval JB, Lesourd M, Almeras C, Aziza R, Gautier JR, et al. MRI Characteristics Accurately Predict Biochemical Recurrence after Radical Prostatectomy. J Clin Med. 2020;9(12):3841.
- ↑Zheng H, Miao Q, Liu Y, Mirak SA, Hosseiny M, Scalzo F, et al. Multiparametric MRI-based radiomics model to predict pelvic lymph node invasion for patients with prostate cancer. Eur Radiol. 2022;32(8):5688-99.
- ↑Luining WI, Oprea-Lager DE, Vis AN, Van Moorselaar RJA, Knol RJJ, Wondergem M, et al. Optimization and validation of 18F-DCFPyL PET radiomics-based machine learning models in intermediate- to high-risk primary prostate cancer. Bauckneht M, editor. PLOS ONE. 2023;18(11):e0293672.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Miguel Ángel Arrabal-Polo. Hospital Universitario Clínico San Cecilio. Granada. España. E-mail: Arrabalp29@gmail.com.