Original
Evaluación de la viabilidad celular en constructos tisulares. Estudio preliminar
Cell viability evaluation in tissue constructs. A preliminary study
Actual. Med. 2016; 101: (797): 13-17 DOI: 10.15568/am.2016.797.or02
Enviado: 30-03-2016
Revisado: 24-04-2016
Aceptado: 24-04-2016
Resumen
Objetivo: Aplicar la microscopia electrónica analítica por energía dispersiva de rayos X a la evaluación de la viabilidad celular en constructos tisulares de fibrina agarosa y determinar la viabilidad celular en el seno del constructo.
Material y Métodos: Se evalúan fibroblastos aislados y fibroblastos en el seno del constructo a los 7 y 21 días con la técnica de Live/Dead y de microscopia electrónica analítica por energía dispersiva de rayos X Resultados: El estudio demuestra que la aplicación de la técnica es factible y que la viabilidad es elevada en los constructos a los 21 días sin que existan signo de apoptosis en la población celular.
Conclusión: La microscopia electrónica analítica por energía dispersiva de rayos X permite evaluar la viabilidad celular en los constructos tisulares y establecer un control de calidad más exigente para su aplicación terapéutica.
Palabras clave: Viabilidad celular, constructo, microanálisis
ABSTRACT
Objective: Apply X-ray microanalytical electron microscopy to evaluate cell viability in fibrin agarose tissue constructs and determine cell viability within the construct.
Material and Methods: Isolated fibroblasts and fibroblasts within the construct are evaluated at 7 and 21 days with the technique of Live/Dead and with X-ray microanalytical electron microscopy.
Results: The study shows that the application of the technique is feasible that viability is high in the constructs at 21 days without sign of apoptosis in the cell population.
Conclusion: X-ray microanalytical electron microscopy allows the evaluation of cell viability in tissue constructs and establish a more demanding quality control for therapeutic application
Keywords: Cell viability, construct, microanalysis
Leer Artículo Completo
INTRODUCCIÓN
La elaboración en el laboratorio de constructos tisulares artificiales útiles para la terapéutica constituye el reto más importante de la ingeniería tisular. En las últimas décadas se han elaborado en este sentido constructos tisulares de muy distinta naturaleza con el objeto de reparar o sustituir los tejidos lesionados (1).
Los componentes fundamentales de los constructos tisulares son las células madres y los biomateriales, elementos ambos que deben cumplir exhaustivos criterios de calidad antes de que el constructo resultante sea autorizado para su aplicación a la clínica. La viabilidad de las células que participan en los constructos es uno de los criterios básicos a cumplir ya que solo una viabilidad elevada asegura la eficacia terapéutica del medicamento tisular y por tanto su aprobación como medicamento de terapia avanzada (2, 3).
La viabilidad de las células que participan en los constructos se realiza habitualmente con carácter previo a la generación de los mismos sin que, hasta el momento, existan estudios significativos que evalúen la viabilidad celular una vez que las células forman ya parte del constructo y, por tanto, se encuentran inmersas en el seno del biomaterial y sometidas a sus efectos. La razón de la falta de estudios estriba básicamente en la carencia de métodos idóneos para evaluar la viabilidad en tales circunstancias.
Entre los métodos que más se utilizan para evaluar la viabilidad celular destacan técnicas que permiten identificar las alteraciones de la membrana y del estado metabólico de las células. Dichas técnicas, sin embargo, no son lo suficientemente precisas como para identificar los estadios iniciales de la muerte celular. Por el contrario una de las técnicas más sensibles para lograr dicho propósito es la microscopia electrónica analítica por emisión de rayos X, que permite cuantificar las concentraciones intracelulares de los principales elementos químicos vinculados a la viabilidad celular como el potasio, el sodio y el cloro. La utilización de esta técnica ha permitido cuantificar la viabilidad celular en cultivo de tipos celulares muy diversos (4-8). Uno de los retos existentes en el momento presente consiste precisamente en adaptar esta técnica para su utilización en los constructos ya elaborados al objeto de poder evaluar la viabilidad de las células que lo componen.
En el presente trabajo se realiza un estudio preliminar sobre la adaptación y aplicación de dicha técnica a los constructos tisulares de fibrina agarosa, cuya versatilidad y ventajas biomiméticas han sido ampliamente demostradas (9-11), con el objeto de disponer en el futuro de una metodología idónea para evaluar la viabilidad de las células insertas en el mismo. Ello podría conducir a un control de calidad más exigente de acuerdo con los requerimientos que demanda este nuevo tipo de terapia.
MATERIALES Y MÉTODOS
1. GENERACIÓN DE CONSTRUCTOS TISULARES
Los fibroblastos, procedentes de mucosa oral de cinco sujetos sanos, según el protocolo previamente descrito (8, 12, 13), fueron introducidas DMEM (Sigma-Aldrich) suplementado con antibióticos (500 U/ml de penicilina G y 500 µg/ml de estreptomicina) y antimicóticos (1,25 µg/ml de anfotericina B) (Sigma-Aldrich). Tras el lavado en una solución estéril de PBS con penicilina, estreptomicina y anfotericina B (500 U/ml, 500 µg/ml y 1,25 µg/ml, respectivamente) las muestras fueron incubadas a 37ºC en una solución estéril de colagenasa tipo I de Clostridium hystoliticum (Gibco BRL Life Technologies Ref. 17100-017, Karlsruhe, Alemania) al 2% en medio de cultivo DMEM durante 10-12 horas. Para los cultivos primarios se utilizó DMEM enriquecido en glucosa (Sigma-Aldrich) suplementado con antibióticos y antimicóticos (100 U/ml de penicilina G y 100 µg/ml de estreptomicina y 0,25 µg/ml de anfotericina B; Sigma-Aldrich) y suero bovino fetal (SBF) (Sigma-Aldrich) al 10%. Las células fueron incubadas a 37ºC y 5% de dióxido de carbono, en condiciones estándar de cultivo celular. Los cultivos de fibroblastos se expandieron hasta el cuarto subcultivo, en nuevos frascos de cultivo, antes de su uso para la fabricación los constructos tisulares.
Para la generación de biomateriales de fibrina humana y agarosa tipo VII (Sigma-Aldrich) al 0,1%, se utilizó plasma sanguíneo humano siguiendo las normas y recomendaciones de la Asociación Española de Bancos de Tejidos (AEBT). Como agente inhibidor de la fibrinolisis del biomaterial utilizamos ácido tranexámico (Amchafibrín®, Fides Ecofarma, Valencia, España) y Cl2Ca 1% (p/v) para inducir la polimerización del plasma y la conversión del fibrinógeno en fibrina. Se realiza el control microscópico de la elaboración del biomaterial mediante microscopía electrónica de barrido en un microscopio PHILIPS Quanta 200, siguiendo procedimientos estandarizados (9).
La elaboración del constructo, se lleva a cabo utilizando el protocolo descrito para la generación constructos de córnea, mucosa oral y piel (8, 12, 14, 15). Para ello, 500.000 fibroblastos fueron resuspendidos en 2 ml de medio de cultivo DMEM, y añadidos al biomaterial de fibrina agarosa elaborado según se ha indicado previamente. Se realiza el control microscópico mediante microscopía electrónica de barrido en un microscopio PHILIPS Quanta 200, siguiendo los procedimientos estandarizados (9).
2. DETERMINACION DE LA VIABILIDAD CELULAR EN LOS FIBROBLASTOS AISLADOS Y DEL CONSTRUCTO TISULAR
La determinación de la viabilidad mediante la técnica de LIVE/DEAD nos permite realizar un ensayo funcional, en base a la integridad de su membrana plasmática. Para la realización de este ensayo de viabilidad en células aisladas se cultivaron 10000 fibroblastos en placa estéril, de cultivo celular, de 96 pocillos (Lab-Tek II, Nunc, Rochester, NY, USA), durante 7 y 21 días respectivamente. Se utilizaron los fluorocromos del kit comercial LIVE/DEAD Viability/citotoxicity kit for mammalian cells (Invitrogen, Oregon, USA) diluidos en PBS. Se añadió a cada pocillo 100 µl de solución con fluorocromos y se dejó incubar durante 10 minutos. Inmediatamente después se procedió a la toma de imágenes con un microscopio de fluorescencia Nikon Eclipse Ti-U (Nikon Instruments Inc, NY, USA). Las longitudes de onda de excitación de los fluorocromos fueron 494 nm para la calceína y 528 nm para el bromuro de etidio, respectivamente. Posteriormente, los recuentos celulares se efectuaron con ayuda del software ImageJ.
Para la determinar la viabilidad en los constructos tisulares se tomaron pequeños fragmentos de los constructos cultivados durante 7 y 21 días y se depositaron en unos portas. Posteriormente, se añadió 100µl de una disolución de acetometoxi-calceína y compuesto de etidio y se dejó incubar durante 10 minutos. Inmediatamente después se procedió a la toma de imágenes con un microscopio de fluorescencia Nikon Eclipse Ti-U (Nikon Instruments Inc, NY, USA), siguiendo el protocolo arriba indicado.
Para realizar el estudio de la viabilidad con Microscopia electrónica analítica por energía dispersiva de Rayos X en los fibroblastos aislados se siguió el siguiente protocolo: tras cubrir las rejillas de oro con pieloformo (SPI-CHEM ref. 2466) las células mantenidas en cultivo se tripsinizaron y se cultivaron sobre dichas rejillas. Se procedió posteriormente al lavado de las rejillas, conteniendo las células, de acuerdo con los criterios establecidos previamente por diferentes autores (4, 16-18) eligiendo como solución lavadora agua destilada a una temperatura de 4ºC, durante 5 segundos. La solución lavadora se mantiene en movimiento constante por agitación magnética (16). Las rejillas fueron criofijadas mediante inmersión rápida en nitrógeno líquido. Las rejillas con las células criofijadas se introdujeron en un portamuestras de aluminio preenfriado a -196ºC. Las células criofijadas y en el interior del portamuestras fueron posteriormente criodesecadas de forma inmediata en un sistema de criodesecación de alto vacio Emitech K775 (Emitech, Watford, UK) durante un total de 17 horas a una presión de vacío de 10-5 mbar de acuerdo con los criterios de Warley y Skepper (24). Tras la criodesecación las rejillas criodesecadas y montadas sobre portamuestras de aluminio fueron recubiertas con una capa de carbón, durante 30 segundos, en una unidad de recubrimiento sputtering Emitech K775 Watford, UK empleándose argón (P=10-5 mbar) (20). El análisis microscópico y microanalítico de las muestras se realizó en un microscopio electrónico de barrido ambiental PHILIPS Quanta 200 provisto de un detector de energía dispersiva de rayos X (EDAX-DX4). Las constantes utilizadas para realizar el estudio microanalítico fueron las siguientes: voltaje 10 kV, aumentos 10000, ángulo de superficie 0º, cuentas por segundo (CPS) registradas por el detector 500, tiempo de acumulación de cuentas 200 segundos, tamaño del haz de electrones (spot size) 5, distancia de trabajo 10mm. La determinación de la viabilidad se realiza a los 7 y 21 días de cultivo.
Para determinar la viabilidad de los fibroblastos en los constructos tisulares de fibrina agarosa se procede al lavado de los mismos siguiendo el protocolo arriba indicado y posteriormente se criofijan mediante inmersión rápida en nitrógeno líquido. Las muestras criofijadas fueron depositadas sobre papel de filtro y colocadas en un portamuestras de aluminio preenfriado a -196ºC. La criodesecación, el montaje y el recubrimiento sigue asimismo las pautas previamente descritas. El análisis microscópico y microanalítico de las muestras se realizó en un microscopio electrónico de barrido ambiental PHILIPS Quanta 200 provisto de un detector de energía dispersiva de rayos X (EDAX-DX4) con los mismos parámetros y condiciones indicados con anterioridad.
Para la realización de los estudios microanalíticos cuantitativos se sigue el protocolo previamente descrito para fibroblastos de mucosa oral por Sánchez Quevedo et al., 2007 (8) que utiliza el método de la razón Pico/fondo (4, 21, 22) y estándares elaborados con concentraciones conocidas de sales inorgánicas en 20% de dextrano (16).
RESULTADOS
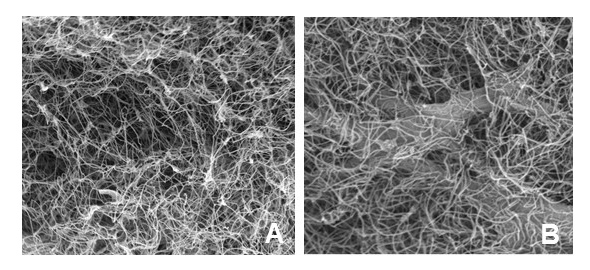
El cultivo primario de fibroblastos mostró un crecimiento celular muy rápido a partir de los primeros días. A las 24h la mayor parte de las células se encontraban adheridas al fondo del frasco de cultivo y emitían pequeñas prolongaciones a modo de pseudópodos. El crecimiento de los fibroblastos se evidenció entre las 48 y 72 horas de cultivo, configurándose al quinto día, una trama celular, constituida por células con largas prolongaciones, que a partir del séptimo día, se convierte en una masa de células fusiformes que ocupaba toda la superficie del cultivo. Por otra parte la observación con microscopía electrónica de barrido del biomaterial de fibrina agarosa elaborado puso de relieve que el biomaterial está constituido en todo su espesor por una red filamentosa homogénea (Fig. 1a). Los fibroblastos incluidos en los geles de fibrina y agarosa mostraron una morfología alargada o estrellada y una distribución homogénea en la trama reticular de fibrina. En ninguno de los casos se apreció contracción o pérdida de volumen de los geles de fibrina y agarosa después de generar los constructos (Fig. 1b).
Figura 1. Microfotografía con microscopia electrónica de barrido del biomaterial de fibrina agarosa (A) (3000x) y del constructo de fibrina agarosa con células (B) (5000x).
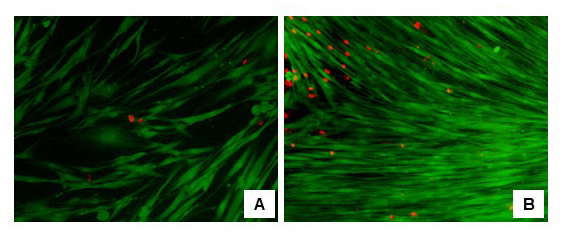
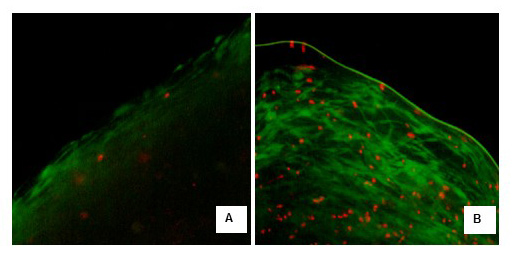
Los resultados del ensayo de fluorescencia LIVE/DEAD realizados en los fibroblastos en cultivo mostraron siempre un porcentaje de viabilidad superior al 85%. Para los fibroblastos cultivados durante 7 días, las células vivas presentaron un porcentaje promedio de 92,01 ± 4,66 y para los fibroblastos cultivados durante 21 días 91,68 ± 3,90 (Fig. 2a y 2b). Los resultados del ensayo de fluorescencia Live/Dead en los constructos tisulares mostraron un porcentaje de viabilidad del 87% y del 61,4% respectivamente para los constructos cultivados durante 7 y 21 días respectivamente (Fig. 3a y 3b).
Figura 2. Microfotografía con microscopio óptico invertido de fibroblastos tras el ensayo Live/Dead. En verde (calceina) marcadas las células vivas con actividad esterasa. En rojo (bromuro de etidio) marcados los núcleos de células muertas y con membranas alteradas. A) Fibroblastos cultivados durante 7 días (10x). B) Fibroblastos cultivados durante 21 días (10x).
Figura 3. Microfotografía con microscopio óptico invertido de constructos tisulares tras el ensayo Live/Dead. En verde (calceina) marcadas las células vivas con actividad esterasa. En rojo (bromuro de etidio) marcados los núcleos de células muertas y con membranas alteradas. A) Constructos tisulares de 7 días (10x). B) Constructos tisulares de 21 días (10x).
Para cada una de las células, objeto de estudio, en los ensayos de viabilidad con microscopia electrónica analítica por energía dispersiva de rayos-X (10 en cada ensayo), se obtuvieron espectros individualizados. En cada espectro se observaron los picos correspondientes a los diferentes elementos existentes a nivel intracelular, así como el fondo o background, correspondiente a la emisión de la radiación no característica.
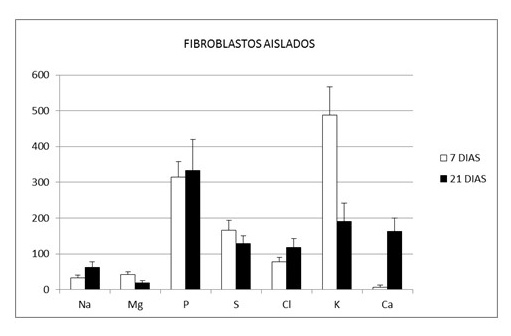
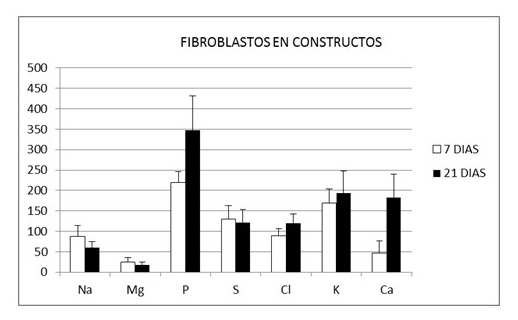
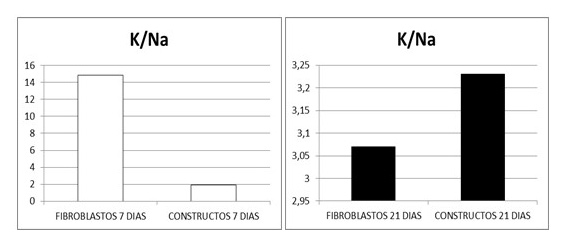
La concentración media en mmoles/kg de peso en seco y la desviación estándar de los elementos químicos intracelulares en los fibroblastos cultivados en rejillas durante 7 y 21 días fueron respectivamente: Na (32, 91 ± 7,75 y 61,87 ± 15,74), Mg (42,02 ± 7,79 y 18,40 ± 6,51), P (314,13 ± 43,81 y 333,82 ± 85,98), S (165,83 ± 27,40 y 129,24 ± 20,78), Cl (77,66 ± 13.09 y 118,20 ± 24,02), K (488,07 ± 78,22 y 190,49 ± 50,78) y Ca (5,95 ± 6.08 y 162,08 ± 38,37). La concentración media en los fibroblastos presentes en el interior de los constructos a los 7 y 21 días fue respectivamente la siguiente: Na (87,87 ± 26,10 y 59,96 ± 14,91 ), Mg (24,24 ± 12,17 y 18,24 ± 6,46), P (219,01 ± 27,07 y 347,94 ± 83,97), S (130,66 ± 31,57 y 121,33 ± 32,73), Cl (88,92 ± 17,80 y 119,75 ± 23,51), K (169,84 ± 33,30 y 193,71 ± 53,85) y Ca (47,00 ± 28,92 y 182,23 ± 57,57). En las Figs. 4 y 5 se expresa el perfil iónico promedio de los ensayos realizados a los 7 y 21 días. Finalmente los índices de viabilidad celular K/Na en las células en cultivo y en las células del constructo tisular alcanzaron respectivamente los siguientes valores 14,83 y 1,93 a los 7 días y de 3,07 y 3,23 a los 21 días (Fig. 6).
Figura 4. Concentración media y desviación estándar de Na, Mg, P, S, Cl, K y Ca en fibroblastos cultivados en rejillas durante 7 días y 21 días.
Figura 5. Concentración media y desviación estándar de Na, Mg, P, S, Cl, K y Ca en constructos tisulares a los 7 y 21 días.
Figura 6. Indice K/Na en fibroblastos aislados y constructos tisulares a los 7 y 21 días.
DISCUSIÓN
La eficacia terapéutica de los constructos elaborados por ingeniería tisular depende de factores muy diversos como por ejemplo la naturaleza del biomaterial utilizado y las propiedades reológicas del mismo o del tipo de célula seleccionado. En relación con estas últimas es importante señalar que solo el uso de poblaciones celulares con un grado elevado de viabilidad puede garantizar el éxito y la eficacia terapéutica (5, 6, 23-25).
La evaluación de los perfiles de viabilidad de las células a utilizar en los constructos generados por ingeniería tisular constituye por tanto uno de los objetivos fundamentales en los protocolos de control de calidad a la hora de autorizar su traslación a la clínica. Como se ha indicado en la introducción los métodos habituales de evaluación de viabilidad basados en la identificación de las alteraciones de la membrana celular y del estado metabólico celular presentan limitaciones importantes que la utilización de la microscopia electrónica analítica por dispersión de Rayos X ha comenzado recientemente a superar (5, 6, 23-26). La evaluación de la viabilidad en los protocolos actualmente existentes se realiza sin embargo en las células aisladas con anterioridad a su utilización en el constructo sin que existan datos fidedignos sobre las variaciones en el grado de viabilidad que pueden sufrir las células en seno del constructo.
Entre los biomateriales que recientemente han demostrado una mayor eficacia en la construcción de nuevos tejidos aptos para la terapéutica está la fibrina (27, 28). Se trata de un polímero natural biodegradable que participa de los procesos naturales de reparación tisular y que posee cadenas fibrilares largas que permiten flexibilidad y una elevada fuerza mecánica (29). Recientemente se ha descrito además que la unión de la fibrina con la agarosa, que es un extracto de alga marina, refuerza las propiedades mecánicas del conjunto y que regulando la hidratación y la presión el biomaterial formado puede adquirir, en un amplio espectro, las propiedades biomecánicas deseadas (9, 14, 30). Los constructos elaborados con fibrina agarosa y fibrobastos han demostrado asimismo una gran capacidad para constituir estromas artificiales biomiméticos para distintos tipos de tejidos y órganos (8, 10, 12, 14, 15, 31).
En el presente trabajo se ha aplicado un protocolo de evaluación microanalítica celular con el objeto de cuantificar el perfil iónico de los fibroblastos inmersos en el material de fibrina agarosa de los constructos. A tal efecto la evaluación de la viabilidad de los mismos se llevó a cabo a los 7 y 21 días y se utilizaron como controles para la evaluación los fibroblastos aislados cultivados en el mismo periodo de tiempo. Además se utilizó otra técnica clásica para evaluar viabilidad -la técnica de Live Dead- que constituye una metodología básica utilizada habitualmente para determinar la viabilidad de los elementos celulares aislados.
Los resultados obtenidos con la utilización de la técnica de Live/Dead demuestran que la viabilidad de los fibroblastos orales aislados supera a los 7 y 21 días el 90% y que cuando se aplica a la evaluación de las células que forman parte de los constructos tisulares de fibrina agarosa la viabilidad se reduce a los 21 días a un 61,4%. De acuerdo con estos datos los constructos tisulares de fibrina agarosa tendrían una elevada viabilidad en su componente celular lo que garantizaría en gran medida su eficacia biológica.
Cuando se evalúan los fibroblastos aislados aplicando el protocolo de microscopia electrónica a analítica se observa un elevado índice K/Na a los 7 días y una disminución significativa a los 21 días aunque alcanza sin embargo un valor de 3,07. El índice K/Na se considera el marcador más importante para determinar la viabilidad celular al reflejar la relación del potasio intracelular con el sodio, que posee baja concentración intracelular en las células viables y elevada concentración intracelular en las células no viables (32).
En los constructos de fibrina agarosa el índice K/Na asciende desde 1.93 a los 7 días hasta 3.23 a los 21 días con cifras de viabilidad similares a las de los fibroblastos aislados. El hecho de que los fibroblastos tengan un índice de viabilidad semejante a los 21 días, tanto en aislamiento como en el seno de los constructos, refleja, con independencia de los medios de cultivo, que en el seno del biomaterial de fibrina agarosa los fibroblastos en ambos casos alcanzan una viabilidad elevada. La existencia de una elevada concentración de fósforo en los fibroblastos aislados y en los de los constructos tisulares, tanto a los 7 días como a los 21 días, es otro signo importante de viabilidad al correlacionarse dicho elemento con el componente orgánico de la célula (32).
Los resultados obtenidos por otra parte en relación con el cloro son importantes en nuestro estudio porque demuestran que las concentraciones de dicho elementos se mantienen elevadas y similares en los fibroblastos aislados y los existentes en el seno de los constructos, tanto a los 7 como a los 21 días. El mantenimiento elevado de la concentración de cloro significa que la población celular en ambos casos no se encuentra en apoptosis ya que la disminución de cloro junto a la bajada de potasio constituye el perfil microanalítico de dicho proceso, lo que se asocia también a una pérdida de volumen celular (33, 34). Ninguna de las dos circunstancias se da en los ensayos realizados.
CONCLUSIÓN
En consecuencia nuestro estudio demuestra que la evaluación de la viabilidad celular en constructos tisulares con microscopia electrónica analítica por dispersión de rayos-X es factible y que los resultados preliminares indican que las células en los constructos de fibrina agarosa poseen una viabilidad elevada a las tres semanas de su elaboración sin signos microanalíticos de apoptosis. Futuros estudios deben determinar si estos resultados pueden generalizarse a constructos elaborados con otros biomateriales o pueden variar en constructos de fibrina agarosa elaborados con protocolos diferentes .
AGRADECIMIENTO
Los autores agradecen a las Profesoras Allice Warley (King’s College, London) y María del Carmen Sánchez-Quevedo (Universidad de Granada) por el asesoramiento recibido en el desarrollo de las técnicas de microscopía electrónica analítica por energía dispersiva de rayos-X.
REFERENCIAS BIBLIOGRÁFICAS
- Lee N, Robinson J, Lu H. Biomimetic strategies for engineering composite tissues. Curr Opin Biotechnol. 2016; 21; 40: 64-74.
- Cuende N, Izeta, A. Clinical translation of stem cell therapies: a bridgeable gap. Cell Stem Cell. 2010; 6: 508-512.
- Cuende N, Rico L, Herrera C. Concise review: bone marrow mononuclear cells for the treatment of ischemic syndromes: medicinal product or cell transplantation? Stem Cells Transl Med. 2012; 5: 403-408.
- Fernández-Segura E, Cañizares FJ, Cubero MA, Revelles F, Campos A. Electron probe X-ray microanalysis of cultured epithelial tumour cells with scanning electron microscopy. Cell Biol Int. 1997; 21(10): 665-669.
- Garzón I, Perez-Kohler B, Garrido-Gómez J, Carriel V, Nieto-Aguilar R, Martín-Piedra MA, García-Honduvilla N, Buján J, Campos A. Alaminos M. Evaluation of the cell viability of human Wharton’s jelly stem cells for use in cell therapy. Tissue Eng. Part C Methods. 2012; 18:408-419.
- Martín-Piedra MA, Garzón I, Oliveira AC, Alfonso-Rodríguez CA, Carriel V, Scionti G. y Alaminos M. Cell viability and proliferation capability of long-term human dental pulp stem cell cultures. Cytotherapy. 2014; 16: 266-277.
- Salido M, Vilches J, y Roomans GM. Changes in elemental concentrations in LNCaP cells are associated with a protective effect of neuropeptides on etoposide-induced apoptosis. Cell Biol Int. 2004; 28(5): 397-402.
- Sánchez-Quevedo MC, Alaminos M, Capitan LM, Moreu G, Garzón I, Crespo PV, y Campos A. Histological and histochemical evaluation of human oral mucosa constructs developed by tissue engineering. Histol Histopathol. 2007; 22(6): 631-640.
- Scionti G, Moral M, Toledano M, Osorio R, Durán JD, Alaminos M, Campos A, López-López MT. Effect of the hydration on the biomechanical properties in a fibrin-agarose tissue-like model. J Biomed Mater Res. 2014; 102(8): 2573-2582.
- San Martin S, Alaminos M, Zorn TM, Sánchez-Quevedo MC, Garzón I, Rodriguez IA, Campos A. The effects of fibrin and fibrin-agarose on the extracellular matrix profile of bioengineered oral mucosa. J Tissue Eng Regen Med. 2013; 7(1): 10-19.
- Rodríguez IA, López-López MT, Oliveira AC, Sánchez-Quevedo MC, Campos A, Alaminos M, Durán JD. Rheological characterization of human fibrin and fibrin-agarose oral mucosa substitutes generated by tissue engineering. J Tissue Eng Regen Med. 2012; 6(8): 636-644.
- Alaminos M, Garzón I, Sánchez-Quevedo MC, Moreu G, González-Andrades M, Fernández-Montoya A, Campos A. Time-course study of histological and genetic patterns of differentiation in human engineered oral mucosa. J Tissue Eng. Regen Med. 2007; 1(5): 350-359.
- Garzon I, Serrato D, Roda O, Del Carmen Sanchez-Quevedo M, Gonzales-Jaranay M, Moreu G, Nieto-Aguilar R, Alaminos M, Campos A. In vitro cytokeratin expression profiling of human oral mucosa substitutes developed by tissue engineering. Int J Artif Organs. 2009; 32(10): 711-719.
- Alaminos M, Del Carmen Sánchez-Quevedo M, Muñoz-Avila JI, Serrano D, Medialdea S, Carreras I, Campos A. Construction of a complete rabbit cornea substitute using a fibrin-agarose scaffold. Invest Ophthalmol Vis Sci. 2006; 47(8): 3311-3317.
- Carriel V, Garzón I, Jiménez JM, Oliveira AC, Arias-Santiago S, Campos A, Sánchez-Quevedo MC, Alaminos M. Epithelial and stromal developmental patterns in a novel substitute of the human skin generated with fibrin-agarose biomaterials. Cells Tissues Organs. 2012; 196(1): 1-12.
- Warley A. Development and comparison of the methods for quantitative electron probe X-ray microanalysis analysis of thin specimens and their application to biological material. J Microsc. 2016; 261(2): 177-84.
- Von Euler A, Wroblewski R, Roomans GM. Correction for extraneous background in X-ray microanalysis of cell cultures. Scanning Microsc. 1992; 6(2): 451-456.
- Zierold K, Schäfer D. Preparation of cultured and isolated cells for X-ray microanalysis. Scanning Microsc. 1988; 2(3):1775-1790.
- Warley A, Skepper JN. Long freeze-drying times are not necessary during the preparation of thin sections for X-ray microanalysis. J Microsc. 2000; 198(Pt 2): 116-123.
- Sánchez-Quevedo MC, Nieto-Albano OH, García JM, Gómez de Ferraris ME, Campos A. Electron probe microanalysis of permanent human enamel and dentine. A methodological and quantitative study. Histol Histopathol. 1998; 13: 109-113.
- Statham PJ, Pawley JB. A new method for particle X-ray microanalysis on peak to background measurements. Scanning Electron Microsc. 1978; 1: 469-478.
- Boekestein A, Stols AL, Stadhouders AM. Quantitation in x ray microanalysis of biological bulk specimens. Scan Electron Microsc. 1980; (Pt 2): 321-334.
- Alaminos M, Sánchez-Quevedo MC, Muñoz-Avila JI, García JM, Crespo PV, González-Andrades M, Campos A. Evaluation of the viability of cultured corneal endothelial cells by quantitative electron probe X-ray microanalysis. J Cell Physiol. 2007; 211: 692-698.
- Rodríguez-Morata A, Garzón I, Alaminos M, Garcia-Honduvilla N, Sánchez-Quevedo MC, Bujan J, Campos A. Cell viability and prostacyclin release in cultured human umbilical vein endothelial cells. Ann Vasc Surg. 2008; 22(3): 440-448.
- Garzón I, Carriel V, Marín-Fernández AB, Oliveira AC, Garrido-Gómez J, Campos A, Sánchez-Quevedo MC, Alaminos M. A Combined Approach for the Assessment of Cell Viability and Cell Functionality of Human Fibrochondrocytes for Use in Tissue Engineering. PLoS ONE. 2012: 7: e51961.
- Martín Piedra MA, Garzón I, Sánchez-Quevedo MC, Alaminos M. Evaluación de la viabilidad celular y patrones apoptóticos en células madre aisladas de la pulpa dental humana Actual Med. 2012; 97: 006- 012.
- Ahmed TA, Dare EV, Hincke M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Eng Part B Rev. 2008; 14(2): 199-215.
- De la Puente P, Ludeña D. Cell culture in autologous fibrin scaffolds for applications in tissue engineering. Exp Cell Res. 2014; 322(1): 1-11.
- Mosesson MW, Siebenlist KR, Meh DA. The structure and biological features of fibrinogen and fibrin. Annals of the New York Academy of Sciences. 2001; 936: 11-30.
- Ionescu AM, Alaminos M, de la Cruz Cardona J, de Dios García-López Durán J, González-Andrades M, Ghinea R, Campos A, Hita E, del Mar Pérez M. Investigating a novel nanostructured fibrin-agarose biomaterial for human cornea tissue engineering: rheological properties. J Mech Behav Biomed Mater. 2011; 4(8): 1963-1973.
- Carriel V, Garzón I, Alaminos M, Cornelissen M. Histological assessment in peripheral nerve tissue engineering. Neural Regen Res. 2014; 9(18):1657-1660.
- Roomans GM. X-ray microanalysis of epithelial cells in culture. Methods Mol. Biol. 2002; 188: 273-289.
- Fernández-Segura E, Warley A. Electron probe X-ray microanalysis for the study of cell physiology. En Allen T. Methods Cell Biol. Elsevier: UK; 2008. Fernández-Segura E, Cañizares FJ, Cubero MA, Warley A, Campos A. Changes in elemental content during apoptotic cell death studied by electron probe X-ray microanálisis. Exp Cell Res. 1999; 253: 454-462.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Fernando Campos. E-mail: fcampos@ugr.es