Original
Validación del sistema automatizado Bact/Alert en el control microbiológico de productos celulares de Terapias Avanzadas
Validation of Bact/Alert automathic system in the microbiological control of cell medicinal products of Advanced Therapies
Actual. Med. 2016; 101: (797): 24-29 DOI: 10.15568/am.2016.797.or04
Enviado: 30-03-2016
Revisado:15-04-2016
Aceptado: 27-04-2016
RESUMEN
Objetivo. El Control de calidad para demostrar que un producto está libre de agentes microbianos adventicios es un aspecto clave de control de procesos y evaluación de la calidad de todas las preparaciones medicinales celulares y en la ingeniería tisular. El objetivo de este estudio es validar el sistema de detección por hemocultivo BacT / ALERT para el control microbiológico de las células mesenquimales para terapia celular, según la Farmacopea Europea (EU.PH), 2.6.27. “Control microbiológico de productos celulares” (1).
Método. Para el cálculo del límite de detección las botellas de hemocultivo fueron inoculadas e incubadas con 4 réplicas de 30 UFC, 5 réplicas de 15 UFC y 5 réplicas de 6 UFC de los microorganismos en ausencia de producto celular. Se llevaron a cabo también experimentos en presencia de producto con 400.000 células mesenquimales. Este método se ha comparado con el método de referencia de Esterilidad de la EU.PH (2). La especificidad se ensayó inoculando 5 réplicas con 400.000 células mesenquimales sin microorganismos.
Resultados. Todas las botellas inoculadas con células mesenquimales sin microorganismos permanecieron negativas después de 7 días de incubación. Todas las botellas inoculadas con cepas bacterianas aerobias y anaerobias fueron detectadas como positivas por el sistema, en el caso del límite inferior (6 UFC) en menos de 36 horas. Se detectaron como positivas las botellas inoculadas con Candida albicans (6 UFC) en menos de 48 horas y con Aspergillus niger (6 UFC) en menos de 72 horas. No hubo diferencias notables en el tiempo de detección entre botellas inoculadas con y sin la presencia de células mesenquimales.
Conclusión: El sistema de detección de hemocultivos Bact/Alert es un método fiable para la detección de la contaminación microbiana de medicamentos a base de células mesenquimales y cumple los requisitos de la UE PH, 2.6.27, para el control microbiológico de productos celulares.
Palabras clave: esterilidad, control microbiológico, terapias avanzadas.
ABSTRACT
Objective. Quality control to demonstrate that a product is free from adventitious microbial agents is a key aspect of process control and quality evaluation of all cell medicinal preparations and in tisular engineering. Evaluate the validation of the BacT/ALERT Blood Culture System for the microbial control of mesenchymal cells for cell therapy according European Pharmacopoeia (EU.PH), 2.6.27. “Microbiological control of cellular products” (1).
Method. Blood culture bottles were challenged with 4 replica of 30 cfu, 5 replica of 15 cfu and 5 replica of 6 cfu of the test microorganisms. Test were also carried out in the presence in each contaminated culture bottle of 400.000 mesenchymal cells. This method has been compared with the reference method for Sterility of the EU.PH (2). Specificity was tested inoculating 5 replicas of broth culture media with 400.000 cells without microorganisms.
Results. All bottles challenged with mesenchymal cells without microorganisms remained negative after 7 days of incubation. All inoculated bottles with aerobic and anaerobic bacterial strains were flagged as positive for the system, in case of low inoculum (6 cfu) in less than 36 hours. Candida inoculated bottles (6 cfu) were detected in less than 48 hours and Aspergillus (6 cfu) in less than 72 hours. There were no significant differences in the detection time between bottles inoculated with and without the presence of mesenchymal cells.
Conclusion: The BacT/ALERT blood culture detection system and is a reliable method for detection of microbial contamination of mesenchymal cells medicinal products that fulfils the requirements of the EU PH, 2.6.27, for the microbiological control of cellular products.
Keywords: sterility, microbiological control, advanced therapies.
Leer Artículo Completo
INTRODUCCIÓN
El control de calidad para demostrar que un producto está libre de agentes microbianos adventicios es un aspecto clave de control de procesos y evaluación de la calidad de todas las preparaciones medicinales celulares, tanto para terapia celular como para ingeniería tisular.
El método clásico para la detección de agentes microbianos es el Test de Esterilidad de la Farmacopea Europea (2), que para productos celulares se lleva a cabo mediante inoculación directa en medios de cultivo líquidos (Thioglicolato y TSB) y que tiene un periodo de incubación de 14 días a 32 ± 2ºC en el caso del Thioglicolato y a 22 ± 2ºC en el caso del TSB. Uno de los inconvenientes es por tanto el tiempo de incubación, que el caso de productos celulares en muchos casos es inviable, y otra es que la detección se hace de forma visual, con lo que está sujeta a la subjetividad del individuo.
Existen nuevos métodos disponibles que aportan resultados más rápidamente con la posibilidad de tomar antes acciones correctivas en caso necesario.
Los sistemas de detección por hemocultivo han demostrado ser métodos robustos, fiables y además están automatizados, por lo que ahora se incorporan a la Farmacopea Europea para el control microbiológico de productos celulares.
Sin embargo, estos métodos tienen que ser validados en la presencia del tipo de preparación para ser examinado con respecto a la especificidad (ausencia de falsos positivos), la sensibilidad (límite de detección) y la reproducibilidad. Se debe comprobar por tanto que el método es adecuado para controlar la presencia de agentes microbianos en el producto, y que éste no interfiere en el crecimiento de microorganismos.
Por tanto el objetivo de este estudio es demostrar que el método de detección por hemocultivo Bact/Alert (3) es válido para el control microbiológico del producto celular “Células mesenquimales troncales de tejido adiposo (CMTTAd)”
MATERIAL Y MÉTODOS
Los materiales y equipos utilizados son:
Medios de cultivo: BacT/ALERT® botellas de hemocultivo para industria aerobios (iFA) y anaerobios (iFN). Tubos de Thioglicolato y TSB.
Sistema de deteccion: BacT/ALERT 3D60®, tiempo de incubación 7 días a 35-37 ºC.
Producto celular: Suspensión de células mesenquimales obtenidas de tejido adiposo a 2.000.000 células /ml en Lactacto de Ringer y Albumina al 1%.
Cepas de microorganismos: Staphylococcus aureus. Bacillus subtilis. Pseudomonas aeruginosa. Candida albicans. Aspergillus niger y Clostridium sporogenes.
Los inóculos se preparan a partir del preparado comercial BioBall® (4) soluble en agua que contienen 30 ± 2 microorganismos/bola.
Para verificar y documentar la capacidad de los medios de cultivo para detectar microorganismos aerobios, anaerobios, levaduras y hongos filamentosos en presencia del material a ensayar, se ha llevado a cabo la validación del control microbiológico, según indicaciones de European Pharmacopoeia 2.6.27. “Microbiological control of cellular products”.
Los frascos de hemocultivos aerobios y anaerobios contienen un medio líquido y carbón activo, capaces de neutralizar de antibióticos y otras sustancias inhibidoras, que permiten el crecimiento de microorganismos. El crecimiento microbiano se detecta mediante un sistema incubador/lector automático.
Fig. 1 Sistema automatizado BacT/Alert 3D60®.
La validación se realiza respecto a esterilidad de los medios (frascos sin inocular) especificidad (ausencia de falsos positivos), sensibilidad (límite de detección), idoneidad del ensayo con las muestras y reproducibilidad. Adicionalmente, debido a que el sistema automatizado permite determinar el tiempo de detección de los microorganismos, se ha calculado la media de los tiempos de detección en presencia o no de del medicamento.
Para verificar y documentar la esterilidad de los medios y la especificidad de los medios de cultivo utilizados en el ensayo de control microbiológico de productos celulares, se ha comprobado que los frascos no inoculados e inoculados con el producto celular sin microorganismos no dan resultados falsamente positivos.
Para verificar y documentar la sensibilidad o límite de detección, es decir, la capacidad de los medios de cultivo para detectar pequeñas cargas de microorganismos aerobios, anaerobios, levaduras y hongos filamentosos, así como comprobar esta capacidad en presencia del material a ensayar, se ha llevado a cabo el ensayo añadiendo a los frascos de cultivo un inóculo de microorganismos viables, conteniendo 30, 15 y 6 unidades formadoras de colonias (UFC) respectivamente de las cepas a estudiar. Estos inóculos son inferiores al señalado en la Farmacopea (Eu Ph 2.6.27), que indica que los medios de cultivo utilizados para el control microbiológico de productos celulares, han de superar el ensayo de promoción de crecimiento cuando se inoculan con menos de 100 microorganismos viables de las cepas de referencia.
El inóculo de microorganismos viables se prepara a partir de BioBall® SingleShot (Biomerieux), de las cepas patrón de microorganismos recomendadas por la Farmacopea. Las BioBall® son unas esferas hidrosolubles que contienen 30 ± 2 UFC (SingleShot) de microorganismos viables, envasadas en viales individuales, lo que disminuye la variabilidad del inóculo y la posibilidad de contaminación con otras cepas. Estas esferas se reconstituyen en 1 ml de solución salina estéril, de modo que en 1- 0,5 – 0,2 mL de suspensión bacteriana habría exactamente las 30 – 15 – 6 UFC necesarias para grupo del ensayo.
Se han comprobado los inóculos de cada cepa utilizada, sembrando una Bioball® en una placa de agar sangre.
Para verificar y documentar la idoneidad se han inoculado estos microorganismos en botellas de hemocultivo en presencia y en ausencia del producto celular a ensayar, de manera que se compruebe que el producto no interfiere significativamente en el ensayo.
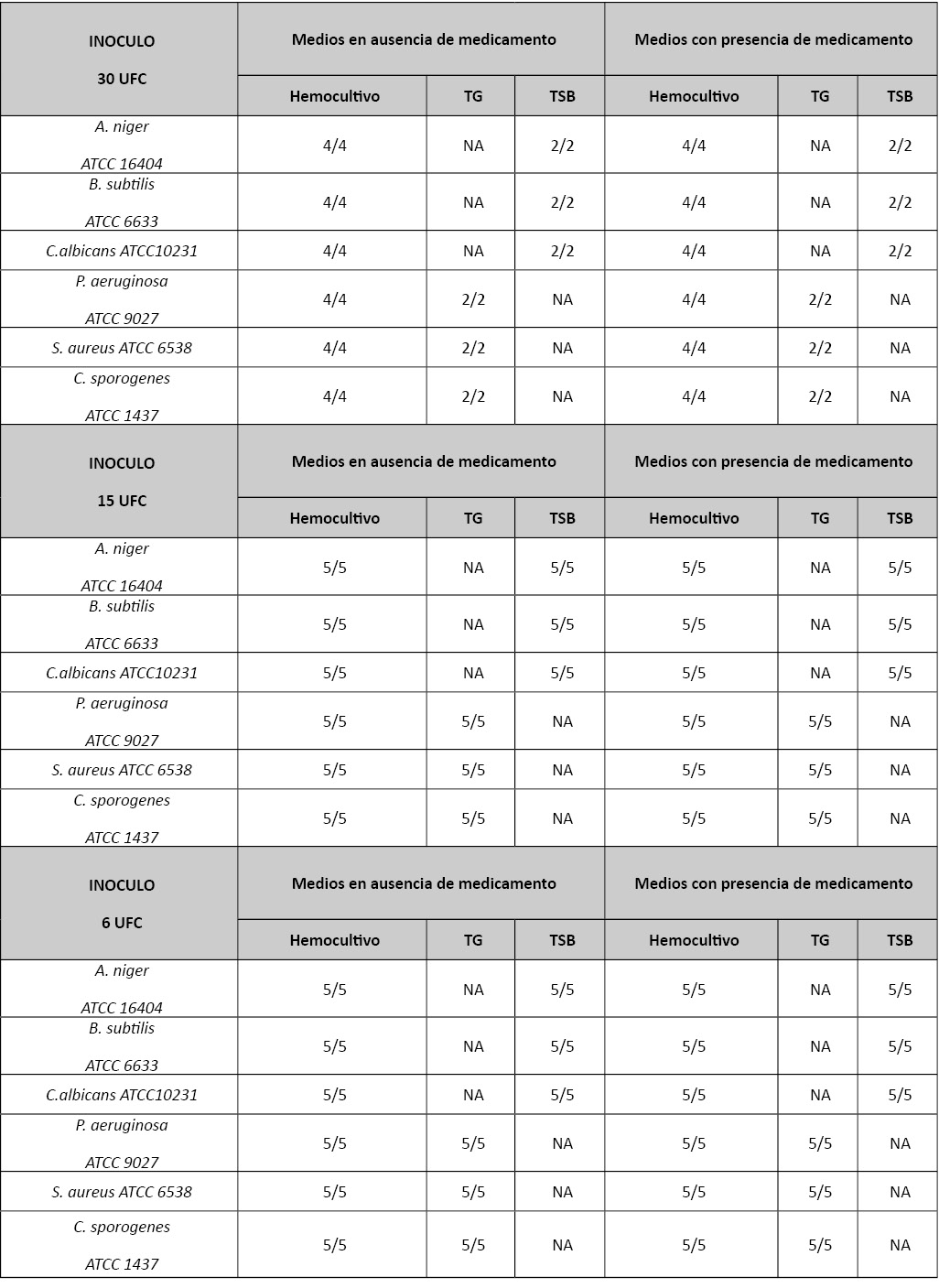
Para verificar y documentar la reproducibilidad de la técnica se han realizado cuatro réplicas de 30 UFC, cinco réplicas de 15 UFC y cinco réplicas de 6 UFC de cada una de las determinaciones (con y sin producto celular a ensayar). Se han realizado 4 réplicas de los frascos inoculados sólo con el producto a ensayar (especificidad) o sin inocular (esterilidad).
Como comparador de referencia se han realizado dos réplicas de 30 UFC y 5 de 15 y 6 UFC respectivamente siguiendo el método de inoculación directa en medio de cultivo descrito en la Eu Ph 2.6.1 para el ensayo de esterilidad. Se han utilizado 5 réplicas con un inóculo de 15 y 6 UFC para minimizar la variabilidad de Poisson que establece para una probabilidad de resultado negativo debido al azar (siembra de menos de 1 UFC, del orden 1/ e-6) de aproximadamente 0.25.
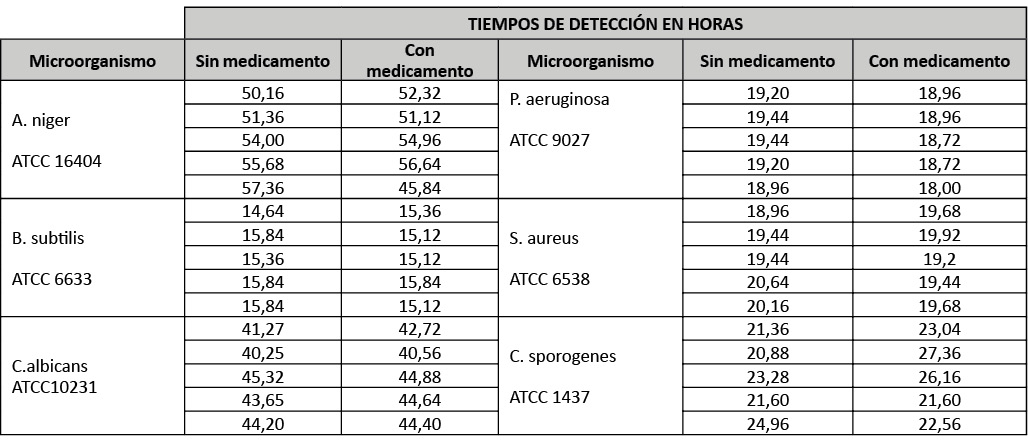
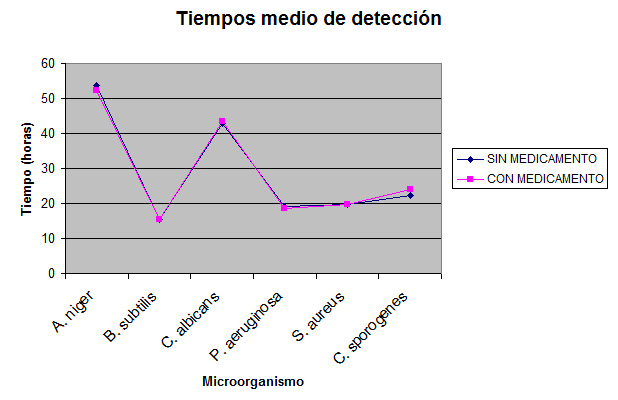
Se han analizado los tiempos de detección de los microorganismos en el caso del inóculo menor (6 UFC) considerado como peor caso, comparando los datos obtenidos en las botellas con y sin medicamento.
RESULTADOS
Comprobación de esterilidad de los medios de cultivo microbiológicos.
Se ha verificado la esterilidad de los medios de cultivo microbiológicos utilizados en este estudio de validación (botellas de hemocultivo aerobios y anaerobios, tubos de tioglicolato y TSB), incubando 4 frascos o tubos de cada medio y comprobando que no hay detección ni crecimiento microbiano durante el periodo de incubación.
En ninguna de las botellas de hemocultivo incubados se detectó crecimiento microbiano tras siete días de incubación a 35-37ºC.
En ninguno de los tubos de tioglicolato y TSB incubados se detectó crecimiento microbiano tras 14 días de incubación a 32,5ºC ó 22,5ºC respectivamente.
Especificidad de los medios de cultivo microbiológicos
Se ha realizado por cuadriplicado la prueba de especificidad (ausencia de falsos positivos) inoculando 4 botellas de cada uno de los medios (frascos de hemocultivo aerobios y anaerobios, tioglicolato y TSB) con el producto a ensayar (medicamento: CMMTAd en lactato de Ringer con albúmina) y comprobando que no hay detección ni crecimiento microbiano durante el periodo de incubación.
En ninguno de los frascos de inoculados con el producto a ensayar se detectó crecimiento microbiano tras siete días de incubación a 35-37ºC.
En ninguno de los tubos de tioglicolato y TSB inoculados con el producto a ensayar se detectó crecimiento microbiano tras 14 días de incubación a 32,5ºC ó 22,5ºC respectivamente.
Límite de detección y reproducibilidad de la técnica
Se ha calculado el límite de detección añadiendo a los mediosde cultivo (frascos de hemocultivo, tioglicolato y/o TSB) un inóculo de microorganismos viables conteniendo 30, 15 y 6 UFC respectivamente de cada una de las cepas a estudiar (Aspergillus niger ATCC 16404, Bacillus subtilis ATCC 6633, Candida albicans ATCC 10231, Clostridium sporogenes ATCC 1437, Pseudomonas aeruginosa ATCC 9027, Staphylococcus aureus ATCC 6538).
Se han inoculado cuatro botellas de hemocultivo con 30 UFC, cinco con 15 UFC y cinco con 6 UFC (aerobio o anaerobio según la cepa inoculada) y 2 tubos de medios de cultivo del ensayo clásico de esterilidad (TSB o Tioglicolato según la cepa inoculada) con 30 UFC, dos con 15 UFC y cinco con 6 UFC. Se han comprobado los inóculos de cada una de las cepas sembrando una Bioball® en placa de agar sangre y haciendo recuento visual de las UFC.
Así mismo, se ha realizado el límite de detección en presencia del material a ensayar, en nuestro caso con el medicamento (suspensión de CMMTAd en lactato de Ringer con albúmina). La técnica es la misma que la anteriormente descrita con la única diferencia de que se han inoculado los frascos y tubos con los microorganismos en presencia del medicamento.
Tabla 1: Resultados medio tradicional Vs sistema de hemocultivo.
Tiempos de detección
Para cada cepa en el caso del inóculo inferior (6UFC) en el sistema automatizado se han determinado los tiempos de detección en presencia o no de la suspensión celular.
Tabla 2: Tiempos de detección de microorganismos en Bact/Alert.
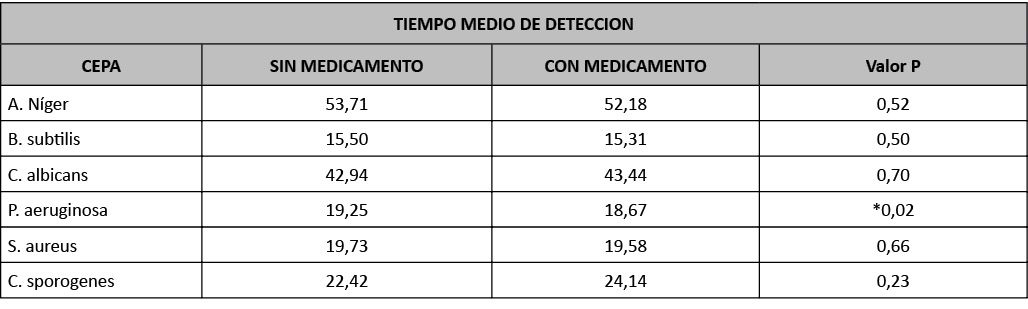
Tabla 3: Tiempos medios de detección en Bact/Alert.
Fig. 2 Comparativa de tiempos medios de detección en presencia y ausencia de medicamento.
DISCUSIÓN
El uso de un sistema automatizado de detección de contaminación microbiana es de una gran utilidad en el control microbiológico de productos celulares, por lo que resulta de gran aplicación en el campo de las Terapias Avanzadas. Actualmente se utiliza en el control microbiológico de médula ósea, sangre de cordón y otros tejidos (8), en el control de condrocitos para terapia celular (9) y otros medicamentos inyectables (6).
Una de las características de los medicamentos de terapias avanzadas es su corta vida, por lo que es necesario disponer de un sistema que aporte resultados en el menor tiempo posible.
En nuestro estudio hemos demostrado que el sistema es adecuado para el control microbiológico de un medicamento de terapias avanzadas elaborado a partir de células madre mesenquimales de tejido adiposo.
A la vista de los resultados del valor P, no existen diferencias significativas entre el tiempo de detección de los microorganismos en presencia del producto a ensayar o en ausencia del mismo, por lo que podemos concluir que el medicamento no produce interferencias en el ensayo.
Comparando éste método automatizado con el método clásico de esterilidad de la Farmacopea Europea, se observa que son equivalentes en cuanto a la obtención de resultados, si bien el sistema automatizado proporciona resultados con mayor rapidez y no es necesario esperar 14 días como en el método clásico para considerar que un producto es estéril ya que con 7 días es suficiente. Otra ventaja del sistema automatizado es la temperatura única de incubación para bacterias, hongos y levaduras a 35-37 ºC, mientras que el método clásico requiere temperaturas de 30-35 ºC para bacterias y de 20-25 ºC para hongos y levaduras. Esto permite obtener resultados en menor tiempo en consonancia con otros estudios (5, 7, 10)
También es un método más fiable ya que no depende de la pericia del ojo humano para detectar la turbidez en los medios, si no que lo detecta el equipo automáticamente por un cambio de color en un reactivo colorimétrico que se encuentra en la parte inferior de la botella y que es detectado por una célula fotoeléctrica, por lo tanto el equipo es susceptible de ser calibrado y cualificado, aspecto no realizable en un método manual.
Otra ventaja es que el equipo emite una alerta visual en la pantalla de control que avisa en caso de que exista una botella positiva, incluso alerta previamente de que hay botellas que son susceptibles o próximas a ser positivas, por lo que en caso de que sea necesario tomar acciones correctivas, éstas puedan ser más inmediatas.
Como conclusión, el sistema de detección por hemocultivo BacT / ALERT es un método válido para el control microbiológico de las células mesenquimales para terapia celular, según la Farmacopea Europea (EU.PH), 2.6.27. Control microbiológico de productos celulares. Los productos celulares a ensayar no alteran el límite de detección de los sistema de cultivo automatizados BacT/Alert para las seis cepas ensayadas, que es ≤ 6 UFC”. La técnica es reproducible ya que se obtienen los mismos resultados en las réplicas realizadas del ensayo.
REFERENCIAS BIBLIOGRÁFICAS
- European Pharmacopoeia 7.0 01/2008 2/6/27 Microbiological control of cellular products.
- European Pharmacopoeia 7.0 01/2008:20601 2.6.1. Sterility test
- Literatura técnica e instrucciones de uso del incubador lector de frascos de hemocultivo Bact/Alert
- Literatura técnica e instrucciones de uso de BioBall®, (BioMerieux, Francia).
- Almuhayawi M, Altun O, Abdulmajeed AD, Ullberg M, Özenci V. The Performance of the Four Anaerobic Blood Culture Bottles BacT/ALERT FN, -FN Plus, BACTEC-Plus and -Lytic in Detection of Anaerobic Bacteria and Identification by Direct MALDI-TOF MS. PLoS ONE. 2015; 10(11): e0142398.
- Bugno A, Lira RS, Oliveira WA, Almodovar AAB, Saes DPS, de Jesus Andreoli Pinto T. Application of the BacT/ALERTR 3D system for sterility testing of injectable products. Brazilian Journal of Microbiology. 2015; 46(3):743-747.
- Ericson EL, Klingspor L, Ulbberg M, Özenci V. Clinical comparison of the Bactec Mycosis IC/F, BacT/Alert FA, and BacT/Alert FN blood cultures vials for the detection of candidemia. Diagnostic Microbiology and Infect Disease. 2012; 73:153-156.
- Khuu HM, Patel N, Carter CS, Murray PR, Read EJ. Sterility testing of cell therapy products: parallel comparison of automated methods with a CFR-compliant method. Transfusion. 2006; 46: 2071–2082.
- Kielpinski G, Prinzzi J, Duguid J, du MoulinG. Roadmap to approval: use of an automated sterility test method as a lot release test for CarticelR, autologous cultured chondrocytes. Chemotherapy. 2005; 7:531-541
- Parveen S, Kaur S, David SA, Kenney JL, McCormick WM, Gupta RK. Evaluation of growth based rapid microbiological methods for sterility testing of vaccines and other biological products. Vaccine. 2011; 29:8012- 8023
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia:Antonio Ruiz García. Unidad de Producción Celular e Ingeniería Tisular. Instituto Biosanitario de Granada. Hospital Universitario Virgen de las Nieves. Av. Fuerzas Armadas nº 2, 4ª Planta Edificio de Gobierno. 18014 – Granada. Tlf: 958 020 401 / 652 812 160. E-mail: antonio.ruiz.exts@juntadeandalucia.es