Original
Novedades en la cirugía en paciente despierto
Novel Aspects For Awake Neurosurgery
Actual. Med. 2018; 103: (803). Supl. 18-40
RESUMEN
Objetivo. Presentar las novedades implantadas durante el último año en el protocolo consensuado para la “Cirugía en paciente despierto” (CPD) en el HUPM de Cádiz.
Material y métodos. Se analizan las novedades surgidas, a raíz de la puesta en marcha en 2016, en la CPD en base a la experiencia obtenida con los 5 pacientes intervenidos durante el año 2017 siguiendo el protocolo inicial y que abarcan aspectos en la Neuroimagen funcional, evaluación neuro-psicológica, monitorización neurofisiológica, neuro-anestesia y neurocirugía.
Resultados. En la Neuroimagen funcional y evaluación neuro-psicológica se evidencia que los pacientes consumidores de cannabis, presentan una RM funcional muy artefactada y con patrón de distribución de las áreas de lenguaje muy distintas a la de pacientes no consumidores. En la monitorización neurofisiológica, se establece el periodo y forma sobre cómo establecer el umbral cortical motor, del área de lenguaje, interactuando con el neuropsicólogo con el paradigma seleccionado “a priori”. En la neuro-anestesia, el uso de drogas como la dexmetomidina para llevar a cabo toda la cirugía despierto y diversos aspectos acerca de la técnica neuroquirúrgica.
Discusión y Conclusiones. Presentamos y discutimos cada uno de estos aspectos novedosos, así como el empleo de la hipnosis en la acomodación del paciente para la técnica CPD.
Palabras clave: cirugía en paciente despierto, neurocirugía, novedades
ABSTRACT
Objective. Present the novelties implanted during the last year in the consensual protocol for “Surgery in awake patients” (CPD) in the HUPM of Cádiz.
Material and methods. We analyze novel aspects arising from the implementation in 2016 of our protocol in the CPD, based on the experience gained with five patients operated during 2017, following the initial protocol and covering aspects in the Functional neuroimaging, neuro-psychological evaluation, neurophysiological monitoring, neuro-anesthesia and neurosurgery.
Results. In the functional Neuroimaging and neuro-psychological evaluation it is evident that cannabis-consuming patients have a very artifactually functional MRI with a distribution pattern of language areas very different from non-consumer patients. In the neurophysiological monitoring, the period and form are established on how to establish the motor cortical threshold, of the language area, interacting with the neuropsychologist with the paradigm selected “a priori”. In neuro-anesthesia, the use of drugs such as dexmetomidine to perform all awake surgery and various aspects of the neurosurgical technique, are discussing.
Discussion and Conclusions. We present and discuss each of these novel aspects, as well as the use of hypnosis in the patient’s accommodation for the CPD technique.
Keywords: awake patients, neurosurgery, novel aspects
Leer Artículo Completo
INTRODUCCIÓN
La craneotomía en paciente despierto (CPD) bajo monitorización neurofisiológica para la resección de tumores cerebrales o patología vascular situadas en áreas elocuentes, se ha convertido en un procedimiento habitual para pacientes que se presume tienen una de estas patologías en la vecindad de las áreas de lenguaje y del córtex motor. La evidencia muestra mejores resultados que incluyen un mayor grado de resección, menos déficits neurológicos tardíos, una estancia hospitalaria más corta y una supervivencia más prolongada, después de las intervenciones neuroquirúrgicas llevadas a cabo bajo estas condiciones, en comparación con las llevadas a cabo bajo anestesia general. La capacidad del neurocirujano para maximizar la resección tumoral, preservando la función neurológica, mediante el mapeo neurofisiológico y la estimulación cortico-subcortical intraoperatoria en un paciente despierto, se acredita por los resultados mencionados1.
Indudablemente la primera consideración para tener en cuenta una vez diagnosticado el paciente y propuesto el método neuroquirúrgico más indicado, es contar con la colaboración y el visto bueno de este. Ante el recelo propio de un procedimiento que puede implicar dolor, ansiedad, falta de colaboración, etc. El mismo paciente nos interroga acerca de los medios de que disponemos para evitarle sufrimiento mientras lo llevamos a cabo. Además de la propia experiencia del equipo multidisciplinar, numerosos artículos pretenden poner de manifiesto que se puede hacer para lograr un mejor control del dolor y la incomodidad percibida por los pacientes sometidos a craneotomía mientras están despiertos2,3.
El equipo multidisciplinar que lleva a cabo estos procedimientos, encabezados por los neurocirujanos responsables de la cirugía propuesta, se maneja en base siempre a protocolos adaptados para su propio entorno y que han sido suficientemente validados previamente por otros autores y centros4,5.
No obstante, en base a la experiencia previamente adquirida por autores y centros con una larga trayectoria, así como a la propia que vamos adquiriendo conforme llevamos a cabo más cirugías, estos protocolos de manejo pre- intra y postquirúrgico, van moldeándose y vamos incorporando nuevas aportaciones que son muy interesantes, para nosotros mismos y para el resto, de tener en cuenta para determinadas situaciones6.
MATERIAL Y MÉTODO
Desde que en septiembre de 2016 elaboramos a cabo un protocolo consensuado para llevar a cabo la CPD con las máximas garantías, hasta la actualidad, marzo 2018, un total de 5 procedimientos quirúrgicos se han llevado a cabo, así como otros 8 pacientes sometidos a mapeo cerebral completo bajo anestesia general. De esta experiencia se han renovado y editado hasta 6 revisiones actualizadas del protocolo inicial.
Se han tenido en cuenta aspectos fundamentales y publicados en los protocolos previamente consensuados por las distintas especialidades participantes7,8, así como hemos participado directamente en la elaboración de documentos de consenso para llevar a cabo estos procedimientos9.
RESULTADOS
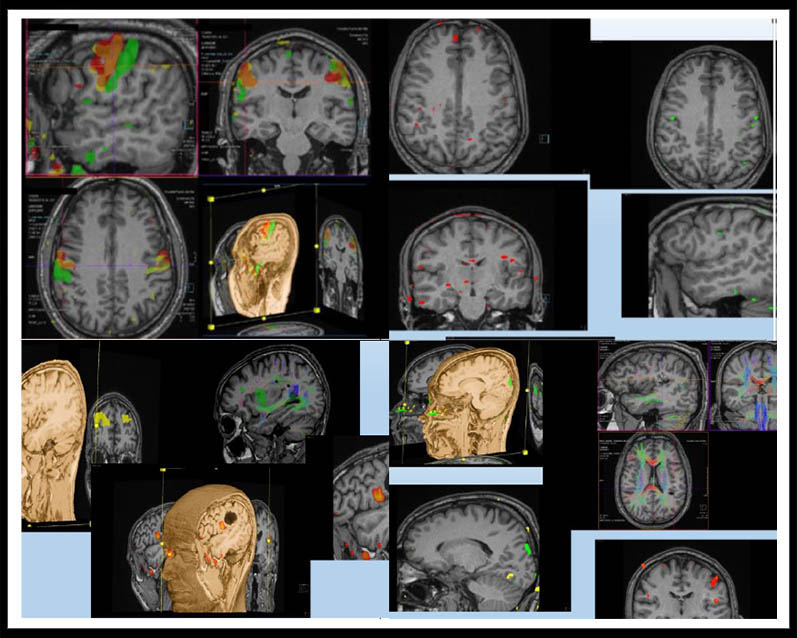
En relación a la adquisición de las imágenes preoperatorias de Resonancia Magnética funcional (RMf), hemos observado que los pacientes consumidores de cannabis en cualquiera de sus formas, presentan un menor efecto BOLD en relación con la activación de áreas cerebrales de los paradigmas relacionados con el lenguaje y el procesamiento verbal, así como una menor activación en las áreas del cerebro asociadas al control general de los recursos cognitivos. Esto, que pudimos establecerlo al encontrarnos a un paciente que padecía de un cavernoma y era consumidor diario de cannabis, al compararlo con nuestros otros pacientes no consumidores, también lo corroboramos introduciendo para la RMf, junto al neuropsicólogo responsable de la selección de los paradigmas, a dos individuos controles, sanos, de semejante nivel intelectual y edad, siendo uno consumidor diario de cannabis y otro que no lo era (Figura 1).
Figura 1.
Imagen superior izqda.: Control no consumidor;
Imagen superior derecha: Control consumidor;
Imagen inferior izqda.: Paciente no consumidor;
Imagen inferior derecha: Paciente consumidor.
Paradigma FAS (Broca) en rojo; paradigma palabra-verbo en amarillo; paradigma números en verde.
En relación con la preparación neuropsicológica de los individuos, hemos introducido por parte de los neuropsicólogos del equipo, una semana antes de la intervención, la realización de pruebas de sugestionabilidad para valorar la posibilidad de incorporar la hipnosis clínica durante la intervención quirúrgica. Si el paciente es buen candidato, se ha realizado la sesión de hipnosis clínica y se han adecuado tanto la inducción como las sugestiones seleccionadas en base a la historia personal del paciente. En tres pacientes, un día antes de la intervención quirúrgica, se ha llevado a cabo la sesión de hipnosis y reafirmación de las sugestiones, para el día de la misma, realizar la inducción hipnótica para adaptarlo/a al entorno quirúrgico.
En tercer lugar, hemos modificado el protocolo inicial que llevábamos a cabo: dormido-despierto-dormido o despierto, por llevar a cabo todo el procedimiento despierto en los 2 últimos casos. Esto ha sido posible gracias a la incorporación por los neuro-anestesistas de la dexmedetomidina (DEX), un agonista selectivo de los receptores alfa-2 adrenérgicos, que posee un efecto sedante y ansiolítico mediante la estimulación presináptica de dichos receptores y confiere al paciente la capacidad de abrir los ojos a la estimulación verbal y obedecer órdenes sencillas, sin causar depresión respiratoria, sólo disminuyendo la frecuencia respiratoria. La mayoría de los fármacos influyen sobre los potenciales evocados, no así con el uso de la DEX, no provoca nauseas ni vómitos, tampoco inestabilidad hemodinámica y confiere analgesia suficiente desde el inicio del procedimiento. Transcurridos 13 minutos desde su suspensión, el paciente es capaz de realizar todos los tests cognitivos y verbales, y la mayoría de los pacientes coinciden en que sólo la postura es lo que peor soportan y recuerdan.
Finalmente, en cuarto y último lugar, es importante establecer el umbral de estimulación a nivel cortical del área del lenguaje o paradigma que seleccionemos para que, mediante estimulación cortical bipolar (separación 5 mm; intensidad 1-8 mAmp; subiendo de 0.5; duración 1 msg y frecuencia 50-60 Hz) podamos durante la cirugía llevar a cabo el procedimiento con la mayor diligencia posible. Hemos acordado que el contaje de números del 1 al 20 o al revés, o citar los meses del año/ días de la semana, como paradigmas para establecer el umbral de estimulación cortical de área del lenguaje, parece ser el que mejor resultado nos aporta.
DISCUSIÓN Y CONCLUSIONES
En relación con los consumidores de cannabis en el momento de llevar a cabo una RMf, parece existir una hipersensibilidad y especificidad de la respuesta cerebral a las señales externas en los consumidores de cannabis a largo plazo, que están por encima de la respuesta a las señales de recompensa natural. Estas observaciones son concordantes con los modelos de sensibilización de incentivos que sugieren la sensibilización de las regiones mesocortico-límbicas y la alteración de los procesos de recompensa naturales después del uso de drogas10. Sin embargo, en nuestros pacientes y controles hemos encontrado de forma global una hipoactivación especialmente en el giro frontal superior, en general en el córtex prefrontal, que provocan una menor activación de las áreas asociadas al control general de los recursos cognitivos (Figura 1).
Cuando queremos que el paciente colabore durante el procedimiento, para poder llevar a cabo el desarrollo de los paradigmas seleccionados en la RMf previamente, además de la medicación empleada, los neuropsicólogos deben llevar a cabo un papel fundamental. Algunos autores reconocen que el funcionamiento cognitivo preoperatorio de los pacientes se relaciona con su somnolencia durante el procedimiento durante la CPD, y que los pacientes que exhibieron somnolencia durante una CPD habían experimentado previamente un funcionamiento reducido a nivel parietal11. Sin embargo ya algunos autores han propuesto un nuevo procedimiento de hipnosedación para aquellos pacientes sometidos a CPD en cirugía de gliomas de bajo grado. La efectividad de la técnica, que en todos los casos permitió la resección del tumor hasta los límites funcionales, y el impacto psicológico positivo de la misma en la mayoría de los pacientes la avalan12,13. No obstante, cuando se va a llevar a cabo una CPD con el paciente todo el tiempo despierto, el proceso de hipnosis es distinto, ya que en este caso se provocan e incorporan “script” relacionados con los ruidos de la craneotomía y con la reducción del dolor para la fijación del cabezal. En el otro caso, dormido-despierto, se trabajan los “script” sobre ruidos en general, sobre la estancia en quirófano y sobre el hecho de despertar con la cabeza sujeta, sin movilidad14.
Es cierto también, que en los últimos años, los avances en la farmacología han permitido realizar CPD que, hasta hace 5 años, no pensábamos fuera posible. Así por ejemplo, Goettel y cols. muestran como la calidad del mapeo cerebral intraoperatorio y la eficacia de la sedación con DEX fueron similares al propofol-remifentanilo durante la CPD para los pacientes sometidos a cirugía de tumores supratentoriales . La DEX se asoció con menos eventos adversos respiratorios15. Inclusive prolonga el efecto de los bloqueos anestésicos cuando se emplea simultáeamente con bupivacaina16.
En relación al umbral de estimulación cortical con la bipolar, la elección del paradigma adecuado, nos permitirá acelerar el procedimiento y ser cautos en no llevar a cabo una estimulación cortical perjudicial para el paciente. No existe un consenso en la literatura de las tareas a realizar durante la cirugía para establecer este umbral, ya que depende de la metodología de cada centro, de la topografía lesional. Nosotros, siguiendo al documento de consenso antes mencionado9 creemos en el recuento de números y la nominación de meses del año o días de la semana, pero no se debe olvidar que existen otras tareas que se pueden realizar durante la cirugía: repetición de palabras, lectura, generación de verbos, test de Token, etc. Indudablemente el mapeo eléctrico intraoperatorio se acepta como el mejor método para obtener información sobre la funcionalidad del tejido subyacente cuando se realiza una cirugía neuro-oncológica17.
Al evaluar las funciones del lenguaje de los pacientes durante la craneotomía con el paciente despierto, dada la diversidad de factores a tener en cuenta, es necesario seleccionar cuidadosamente las tareas o paradigmas que se realizarán, llevar a cabo rápidamente todos los exámenes y evaluar los resultados a la luz de las condiciones de cada individuo y cada centro18.
BIBLIOGRAFÍA
- Meng L, Berger MS, Gelb AW. The Potential Benefits of Awake Craniotomy for Brain Tumor Resection: An Anesthesiologist’s Perspective. J Neurosurg Anesthesiol. 2015;27(4):310-7.
- Milian M, Tatagiba M, Feigl GC. Patient response to awake craniotomy – a summary overview. Acta Neurochir (Wien). 2014;156(6):1063-70.
- Bajunaid KM, Ajlan AM. Awake craniotomy. A patient´s perspective. Neurosciences (Riyadh). 2015;20(3):248-52.
- Surbeck W, Hildebrandt G, Duffau H. The evolution of brain surgery on awake patients. Acta Neurochir (Wien). 2015;157(1):77-84.
- Howe KL, Zhou G, July J, Totimeh T, Dakurah T, Malomo AO, Mahmud MR, Ismail NJ, Bernstein MA. Teaching and sustainably implementing awake craniotomy in resource-poor settings. World Neurosurg. 2013;80(6):171-4.
- Ibrahim GM, Bernstein M. Awake craniotomy for supratentorial gliomas: why, when and how?. CNS Oncol. 2012;1(1):71-83.
- Hervey-Jumper SL, Berger MS. Technical nuances of awake brain tumor surgery and the role of maximum safe resection. J Neurosurg Sci. 2015;59(4):351-60.
- Duffau H. Awake surgery for brain gliomas: plea for an increased involvement of anesthesiologists. Ann Fr Anesth Reanim. 2012;31(6):81-6.
- de Quintana-Schmidt C, Lladó-Carbob E, Cortés-Doñate VE; Grupo de trabajo de Neuroncología (GTNO) y Sociedad Española de Neurofisiología Clínica (SENFC). Opciones de monitorización neurofisiológica en la resección de tumoraciones cerebrales. Documento de consenso entre el Grupo de Trabajo de Neurooncología de la Sociedad Española de Neurocirugía (SENEC) y la Sociedad Española de Neurofisiología Clínica (SENFC). Neurocirugía. 2018;29(1):25–38.
- Filbey FM, Dunlop J, Ketcherside A, Baine J, Rhinehardt T, Kuhn B, DeWitt S, Alvi T. fMRI study of neural sensitization to hedonic stimuli in long-term, daily cannabis users. Hum Brain Mapp. 2016;37(10):3431-43.
- Itoi C, Hiromitsu K, Saito S, Yamada R, Shinoura N, Midorikawa A. Predicting sleepiness during an awake craniotomy. Clin Neurol Neurosurg. 2015;139:307-10.
- Zemmoura I, Fournier E, El-Hage W, Jolly V, Destrieux C, Velut S. Hypnosis for Awake Surgery of Low-grade Gliomas: Description of the Method and Psychological Assessment. Neurosurgery. 2016;78(1):53-61.
- Hansen E, Seemann M, Zech N, Doenitz C, Luerding R, Brawanski A. Awake craniotomies without any sedation: the awake-awake-awake technique. Acta Neurochir (Wien). 2013;155(8):1417-24.
- Potters JW, Klimek M. Awake craniotomy: improving the patient’s experience. Curr Opin Anaesthesiol. 2015;28(5):511-6.
- Goettel N, Bharadwaj S, Venkatraghavan L, Mehta J, Bernstein M, Manninen PH. Dexmedetomidine vs propofol-remifentanil conscious sedation for awake craniotomy: a prospective randomized controlled trial”. Br J Anaesth. 2016;116(6):811-21.
- Vallapu S, Panda NB, Samagh N, Bharti N. Efficacy of Dexmedetomidine as an Adjuvant to Local Anesthetic Agent in Scalp Block and Scalp Infiltration to Control Postcraniotomy Pain: A Double-Blind Randomized Trial. J Neurosci Rural Pract. 2018;9(1):73-79.
- Freyschlag CF, Duffau H. Awake brain mapping of cortex and subcortical pathways in brain tumor surgery”. J Neurosurg Sci. 2014;58(4):199-213.
- Kanno A, Mikuni N. Evaluation of Language Function under Awake Craniotomy”. Neurol Med Chir (Tokyo). 2015;55(5):367-73.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores declaran no tener conflicto de intereses. El presente artículo, en forma de comunicación oral, fue premiado como “mejor CO” durante el XXXIV Congreso de la SOANNE, marzo 2018.
Autor para la correspondencia: José Luis Gil Salú. Hospital Universitario Puerta del Mar. Av. Ana de Viya, 21, 11009. Cádiz, España