Mesa de Comunicación Orales Breves
Inflamación/Enfermedades Autoinmunes
Actual. Med. 2018; 103: (804). Supl. 34-54
Leer Artículo Completo
IF-01. UN AUMENTO DE INCIDENCIA EN UNA PATOLOGÍA AUTOINMUNE: SARCOIDOSIS
A. Sánchez Ramos1, M. Rodríguez Borrego1, A. Hidalgo Conde1, M. Abarca Costalago1, R. Arnedo1, G. Ojeda1, J. Sánchez Lora1
1.Medicina Interna. Hospital Clínico Universitario Virgen de la Victoria. Málaga
- Mañá J, Rubio-Rivas M, Villalba N et al. Multidisciplinary approach and long-term follow-up in a series of 640 consecutive patients with sarcoidosis: Cohort study of a 40-year clinical experience at a tertiary referral center in Barcelona, Spain. Medicine (Baltimore) 2017; 96: e7595.
- Thomas KW, Hunninghake GW. Sarcoidosis. JAMA 2003; 289: 3300. Newman LS, Rose CS, Maier LA. Sarcoidosis. N Engl J Med 1997; 336: 1224.
OBJETIVOS: Análisis descriptivo de los casos de Sarcoidosis presentes en el Hospital Universitario Virgen de la Victoria de Málaga desde 1990 a 2015 y comparación con los datos obtenidos en otras series de casos.
PACIENTES Y MÉTODOS: Se contó con la revisión de 85 casos, se descartaron 17 por falta de datos. También se hizo uso del programa SPSS para la valoración de la significación estadística de la distribución clínica por sexos
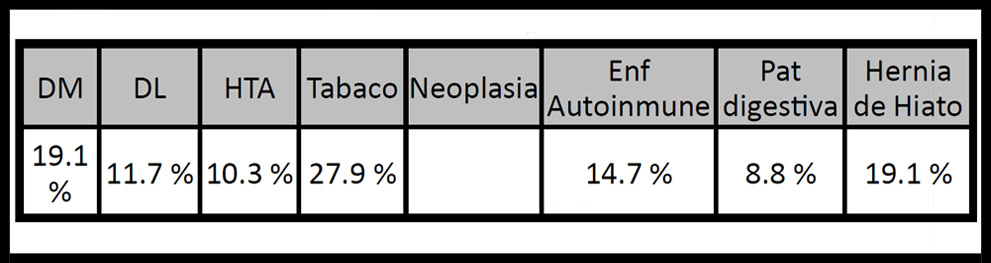
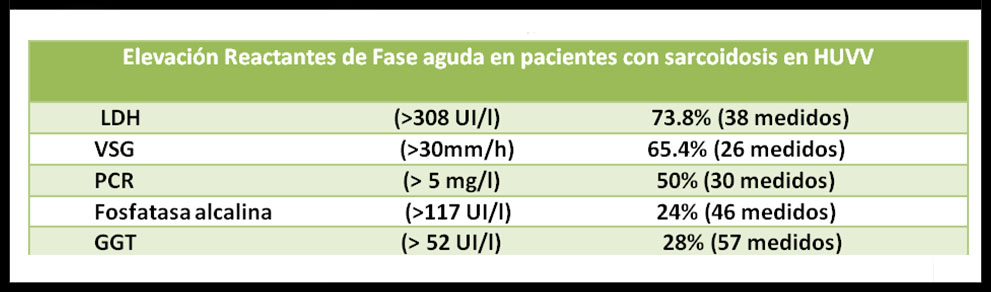
RESULTADOS: De los 68 pacientes a estudio, un 54,4% eran mujeres y un 45,6 %, hombres. La edad media al diagnóstico fue de 45 años en hombres y 50 años en las mujeres. Como debut clínico encontramos el respiratorio en un 50% de los casos. Un 88,2% presentaban afectación del aparato respiratorio, de los que las adenopatías hiliares mediastínicas como único signo (estadío radiológico I) constituían un 33.8%. Un 76,5% de los pacientes tenían registradas pruebas de función respiratoria en las que en la mitad de los casos se encontraba un patrón respiratorio normal, mientras que el patrón respiratorio patológico predominante lo constituía el patrón restrictivo con un 34,6%. Cabe destacar el importante grado de comorbilidad presente en la mayoría de los pacientes, llegando a la hipótesis de su actuación como cofactor proinflamatorio predisponente para el desarrollo de la enfermedad
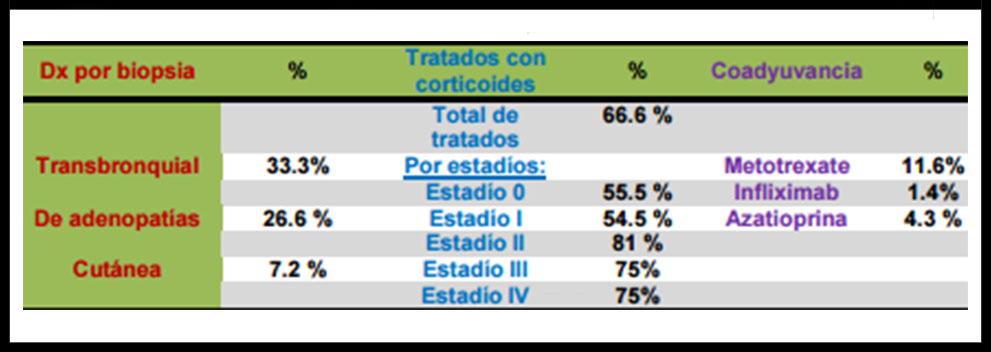
CONCLUSIONES: En esta serie de casos, a diferencia de otros estudios, se administra tratamiento corticoideo a pacientes sin afectación radiológica o con estadío I a diferencia de otros estudios. Sin embargo, esta necesidad de tratamiento parece ser, en la mayoría de los casos, por síntomas extrapulmonares o por tratarse de casos de falsos negativos en cuanto a la afectación pulmonar.
La revisión de los casos de sarcoidosis presentes en el HUVV muestra características de la enfermedad en proporciones similares a otros estudios realizados a nivel mundial, lo que demuestra un patrón de enfermedad que se repite de forma constante y que nos debe hacer sospechar de ella. La llamativa comorbilidad proinflamatoria podría ser objeto de estudios con el objetivo de establecerlo como predisponente etiológico. A finales de los 90 predominaba el síndrome de Löfgren como debut clínico de la sarcoidosis, en la actualidad, predomina el debut respiratorio.
Por último, encontramos un aumento progresivo de la incidencia de los hallazgos casuales, por la generalización de las pruebas de imagen.
Tabla 1. Comorbolidad.
Tabla 2
Tabla 3
IF-05. INGESTA DIETÉTICA, ÍNDICE DE CALIDAD ANTIOXIDANTE DE LA DIETA (DAQS) Y PROTEÍNA C REACTIVA (PCR) EN EL LUPUS ERITEMATOSO SISTÉMICO (LES)
G. Pocovi Gerardino1, M. Correa Rodríguez2, J. Callejas Rubio3, R. Rodríguez López3, M. Martín Amada4, M. Cruz Caparrós5, A. Barnosi6, B. Rueda Medina2
1.FIBAO. Instituto de Investigación Biosanitaria, IBS. Granada
2.Facultad de Ciencias de la Salud. Universidad de Granada, UGR
3.Servicio de Medicina Interna. Enf. Autoinmunes y Sistémicas. Hospital Campus de la Salud. Granada
4.Servicio de Medicina Interna. Complejo Hospitalario de Jaén
5.Servicio de Medicina Interna. Hospital de Poniente. El Ejido (Almería)
6.Servicio de Medicina Interna. Complejo Hospitalario Torrecárdenas. Almería
- Smidowicz A., Regula J. (2015). Effect of nutritional status and dietary patterns on human serum C-reactive protein and interleukin-6 concentrations. Advances in Nutrition (Bethesda, Md.), 6 (6), 738–47.
- Tur JA, Serra-Majem L, Romaguera D, Pons A (2005). Does the diet of the Balearic population, a Mediterranean type diet, still provide adequate antioxidant nutrient intakes? European Journal of Nutrition, 44 (4), 204–213.
OBJETIVOS: La proteína C reactiva (PCR) es bien conocida como biomarcador de inflamación. Elevaciones ligeras en los niveles de PCR se asocian a un aumento del riesgo de enfermedades cardiovasculares y han sido observadas en patologías crónicas e inflamatorias como el lupus eritematoso sistémico (LES), una enfermedad de origen autoinmune. En sujetos sanos, la alimentación y ciertos nutrientes parecen ser capaces de modular los niveles de PCR (Smidowicz & Regula, 2015). Sin embargo, de momento no existen datos que relacionen la influencia de la dieta en los niveles séricos de PCR en pacientes con lupus. Por ello, nos planteamos estudiar el posible efecto entre la ingesta de nutrientes y antioxidantes de la dieta y los niveles de PCR en pacientes con LES.
PACIENTES Y MÉTODOS: Se realizó un estudio de carácter transversal en una población de 91 pacientes de ambos sexos clínicamente estables diagnosticados con LES. Los niveles séricos de PCR se determinaron mediante un ensayo de inmuno- turbidimetría ultrasensible (Beckman Coulter analyzer AU5800). La ingesta de macro y micronutrientes fue obtenida a través de un recordatorio de alimentos de 24 horas y la ingesta de antioxidantes estimada a través del índice de calidad antioxidante de la dieta (DAQS)(Tur, Serra-Majem, Romaguera, & Pons, 2005). La relación entre la ingesta de nutrientes, el DAQS y los niveles de PCR se determinó a través de análisis de varianzas (ANOVA). Los valores de p<0.05 se consideraron estadísticamente significativos.
RESULTADOS: La media de edad de los pacientes fue de 44,5 ± 13,5, presentando un SLEDAI de 3,5 ± 2.9 y SLICC de 1,3 ± 1,2. Se observaron niveles de PCR (3,76 ± 6,68 mg/L) por encima de los rangos de normalidad en los enfermos evaluadas. La ingesta diaria de fibra y ciertos micronutrientes (calcio, hierro, folato, vitaminas A y D) eran inferiores a las recomendadas. No se observaron correlaciones estadísticamente significativas entre la ingesta dietética de nutrientes ni el DAQs con los niveles séricos de PCR.
CONCLUSIONES: Los pacientes con LES evaluados llevaban una dieta deficiente y de baja calidad. En base a ella, no pudo establecerse asociaciones significativas entre la ingesta dietética de nutrientes o de antioxidantes con el estado inflamatorio en los pacientes medido a través de la PCR. Se necesitarían estudios de intervención en estas poblaciones con dietas de buena calidad para poder esclarecer el rol de la dieta en los niveles de PCR en pacientes con LES.
IF-07. EXPERIENCIA CON EL USO DE RITUXIMAB EN ENFERMEDADES AUTOINMUNES SISTÉMICAS (EAS) EN UN HOSPITAL DE TERCER NIVEL
V. Sández Montagut1, J. López Morales1, F. Nieto García1, M. Pérez Quintana1, F. García Hernández1, S. Rodríguez Suárez1, J. Andreu Álvarez1, J. García Morillo1
1.Unidad de Enfermedades Autoinmunes y Minoritarias. Complejo Hospitalario Virgen del Rocío. Sevilla
- Oon S, Huq M, Godfrey T, Nikpour M. Systematic review, and meta-analysis of steroid-sparing effect, of biologic agents in randomized, placebo-controlled phase 3 trials for systemic lupus erythematosus. Semin Arthritis Rheum. 2018 Jan 6. pii: S0049-0172 (17) 30579-6.
OBJETIVOS: Presentar una serie de casos de paciente con EAS en nuestro hospital que ha recibido Rituximab en los últimos 12 años. Realizar un estudio descriptivo básico en cuanto a las variables poblacionales demográficas básicas.
PACIENTES Y MÉTODOS: Presentamos un estudio transversal observacional descriptivo. Para ello se ha analizado una base de 48 pacientes con EAS diagnosticadas y tratadas con Rituximab por la Unidad de Enfermedades Autoinmunes y Minoritarias de nuestro Hospital. Analizamos dicha población usando el programa “hoja de cálculo Google”.
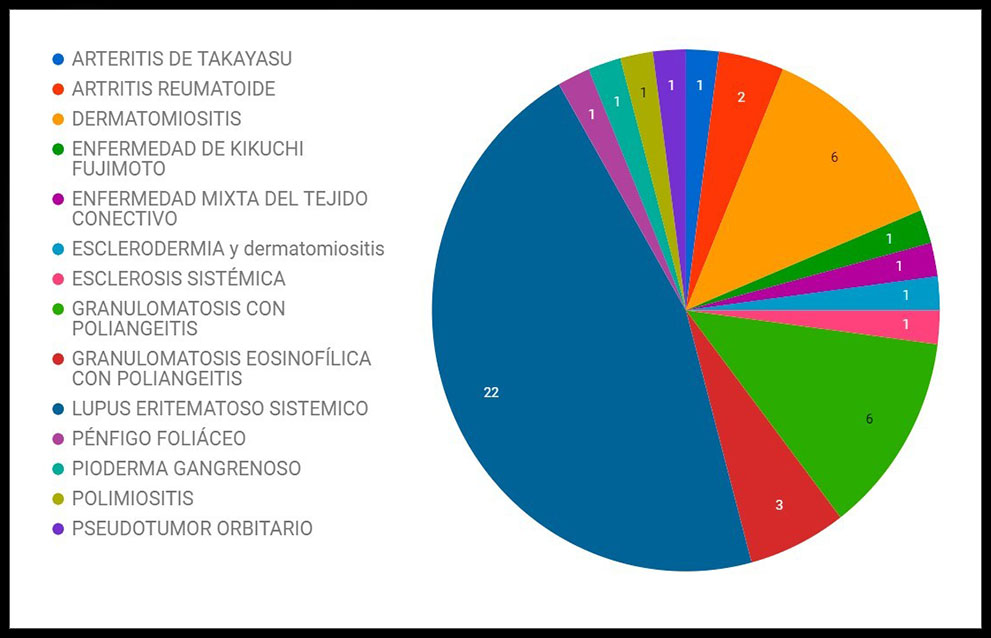
RESULTADOS: Se trata de una población mayoritariamente femenina (40 mujeres y 8 hombres). La media de edad se sitúa en 40.9 años (mediana 38), con una desviación standard (ST) de ±13.1. Las enfermedades que presentaban fueron: Arteritis de Takayasu 1 caso, Artritis Reumatoide 2, Dermatomiositis 6, Enfermedad de Kikuchi Fujimoto 1, Enfermedad Mixta del Tejido Conectivo 1, Esclerodermia asociada a dermatomiositis 1, Esclerosis sistémica 1, Granulomatosis con poliangeitis 6, Granulomatosis eosinofílica con poliangeitis 3, Lupus Eritematoso Sistémico 22, Pénfigo Foliáceo 1, Pioderma gangrenoso 1, Polimiositis 1, Pseudotumor Orbitario 1.
El tiempo medio desde el diagnóstico hasta la administración de Rituximab fue 7.7 años con una ST ±7.1. Se consiguió el control de la actividad a los 6 meses en un 64.6% de los pacientes, medido según las diferentes escalas adaptadas a las distintas enfermedades; sin embargo la remisión al año se consiguió en el 39%.
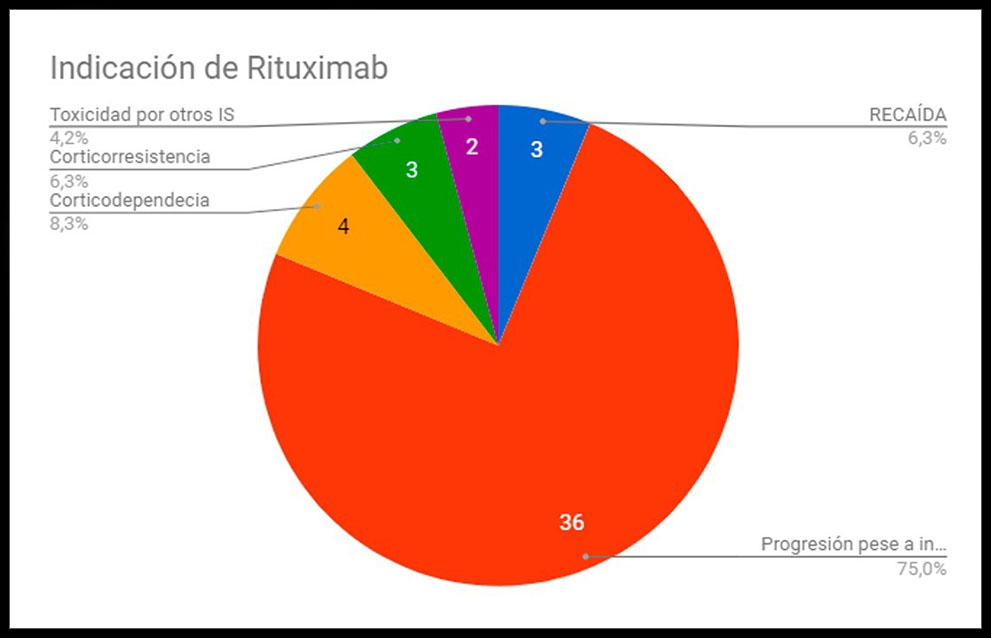
Las indicaciones de tratamiento fueron: recaída 3 casos, progresión de la enfermedad pese a inmunosupresión 36, corticodependencia 4, corticorresistencia 3 y toxicidad por otros inmunosupresores (IS) 2. Los fármacos que estaban recibiendo los pacientes previo al tratamiento con Rituximab eran ciclosporina en 7 casos, inmunoglobulinas 7, ciclofosfamida 24, leflunomida 4, antipalúdicos 21, metotrexato 6 y micofenolato 20; 5 pacientes no recibían ningún IS. Además, un 37% de los pacientes recibían 2 inmunosupresores, un 18% recibían 3, un 4.2% recibían 4 y sólo un paciente (2.1%) recibía 5 fármacos
CONCLUSIONES: El rituximab se establece como una posibilidad terapéutica en algunas de las EAS (LES, Sjogren, AR, etc.), con, cada vez, más estudios que así lo avalan. Actualmente, se viene usando en muchos Hospitales, como el nuestro, como tratamiento de segunda línea en pacientes que presentan fracaso o toxicidad con otros IS.
Los datos recabados de nuestros pacientes se muestran concordantes con la mayoría de estudios publicados: mayoría de pacientes mujeres, con una edad relativamente joven, una tasa de respuesta inicial alta (65%) con una respuesta mantenida en torno al 40%. Hemos de tener en cuenta que son pacientes que ya han sido tratados previamente con otros IS y que han fracasado, bien por falta de respuesta, bien por toxicidad, por lo que son pacientes que cumplen en su mayoría criterios de refractariedad para otros IS. Es decir, se “rescata” un porcentaje nada desdeñable de pacientes que progresan en su enfermedad pese a tratamiento óptimo.
Figura 1
Figura 2
Figura 3
IF-08. SEGURIDAD RELACIONADA CON EL USO DE RITUXIMAB EN PACIENTES CON ENFERMEDADES AUTOINMUNES SISTÉMICAS (EAS) EN UN HOSPITAL DE TERCER NIVEL
V. Sández Montagut1, F. Nieto García1, J. López Morales1, M. Pérez Quintana1, S. Rodríguez Suárez1, F. García Hernández1, J. Andreu Álvarez1, J. García Morillo1
1.Unidad de Enfermedades Autoinmunes y minoritarias. Complejo Hospitalario Virgen del Rocío. Sevilla
- Oon S, Huq M, Godfrey T, Nikpour M. Systematic review, and meta-analysis of steroid-sparing effect, of biologic agents in randomized, placebo-controlled phase 3 trials for systemic lupus erythematosus. Semin Arthritis Rheum. 2018 Jan 6. pii: S0049-0172(17)30579-6.
OBJETIVOS: Recoger y mostrar datos relacionados con la seguridad del uso de Rituximab en paciente con EAS en nuestro hospital. Detectar potenciales efectos adversos y complicaciones relacionada con dicho fármaco.
PACIENTES Y MÉTODOS: Presentamos un estudio transversal observacional descriptivo. Para ello se ha analizado una base de 48 pacientes con EAS diagnosticadas y tratadas con Rituximab por la Unidad de Enfermedades Autoinmunes y Minoritarias de nuestro Hospital. Analizamos dicha población usando el programa “hoja de cálculo Google”.
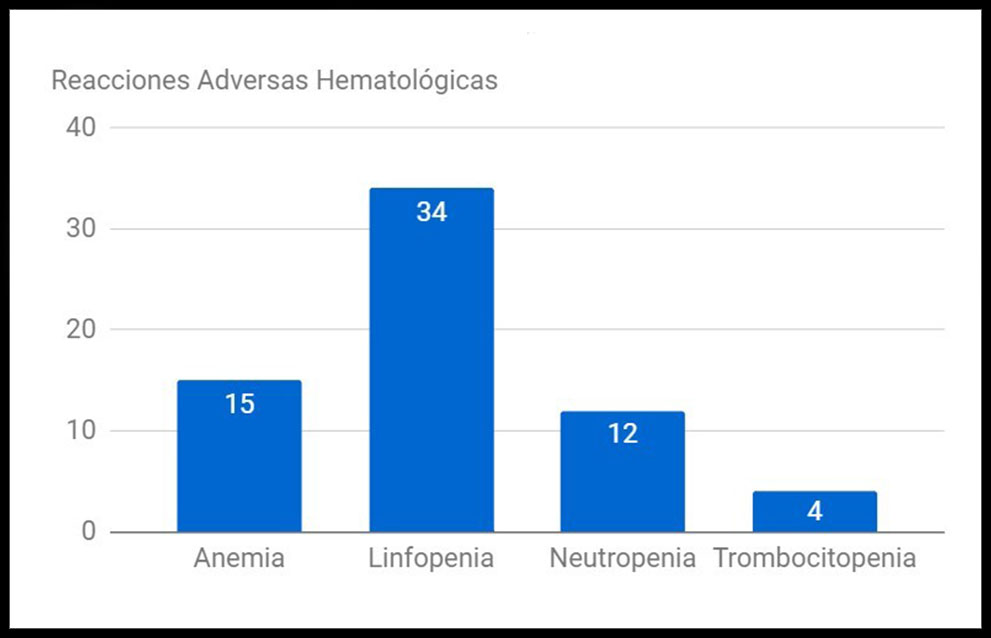
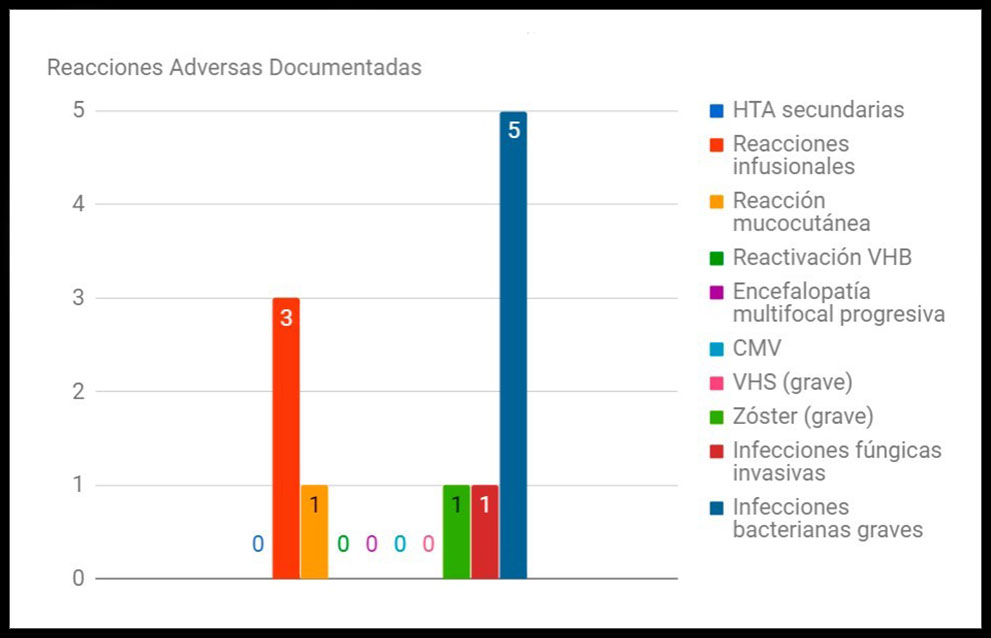
RESULTADOS: Detectamos un total de 11 (22,9%) reacciones adversas relacionadas con la infusión y con la inmunosupresión generada por Rituximab. Aparecieron 3 (6,25%) reacciones infusionales (todas ellas leves), 1 (2,08%) reacción mucocutánea grave, 1 (2,08%) herpes Zóster grave, 1 (2,08%) infección fúngica invasora y 5 (10,42%) infecciones bacterianas graves (que requirieron tratamiento antibiótico y/u hospitalización). De los 48 pacientes tratados, sólo a 1 de ellos hubo que retirarle el fármaco por dicha reacción adversa (shock séptico). Además, evidenciamos las siguientes reacciones adversas hematológicas: 15 (31.25%) desarrollaron anemia, 34 (70.83%) linfopenia, 12 (25%) neutropenia y 4 (8.33%) trombocitopenia. Todas estas reacciones están descritas en la ficha técnica de Rituximab. Por otro lado, se recogieron los eventos relacionados con aparición de hipertensión arterial, reactivación de Virus de la Hepatitis B, encefalopatía multifocal progresiva, infecciones por Citomegalovirus e infecciones graves por Virus Herpes Simplex, pero no se produjo ningún caso.
CONCLUSIONES: Los estudios recientes propugnan Rituximab como un fármaco eficaz y seguro para el tratamiento. En nuestro registro, sólo precisó la retirada del fármaco 1 paciente por reacción adversa grave. Las otras 10 registradas sólo precisaron tratamiento específico o modificación de la pauta de administración (generalmente modificación de la premedicación).
Por otro lado, las reacciones hematológicas registradas fueron leves en la mayoría de ellas ninguna de ellas precisó tratamiento específico por lo que no parece suponer un impacto clínico relevante.
Comparando dichos efectos secundarios, se ajustan a los descritos por el fabricante, apareciendo además en la misma proporción de la esperada (salvo la trombopenia, de la que detectamos menos de 1/10 casos, que era lo esperado). Aun así, recordar que los efectos adversos descritos en la ficha técnica son en su mayoría en pacientes en monoterapia con Rituximab. De todos nuestros pacientes, 19 (39.6%) recibieron únicamente dicho fármaco, lo demás (60,4%) lo recibieron en combinación con otros fármacos.
Rituximab se ha mostrado como un fármaco seguro para el tratamiento de EAS. La mayoría de reacciones adversas detectadas sólo requirieron tratamiento específico y se pudo mantener el tratamiento, salvo en un caso en el que hubo que retirarlo.
Figura 1
Figura 2
IF-09. EXPERIENCIA CON EL USO DE BELIMUMAB EN LUPUS ERITEMATOSO SISTÉMICO (LES) EN UN HOSPITAL DE TERCER NIVEL
J. López Morales1, V. Sández Montagut1, F. Nieto García1, M. Pérez Quintana1, F. García Hernández1, S. Rodríguez Suárez1, J. Andreu Álvarez1, J. García Morillo1
1.Medicina Interna. Complejo Hospitalario Virgen del Rocío. Sevilla
- Riancho-Zarrabeitia L, Villa I, Santos-Gómez M, Aurrecoechea E. Belimumab in systemic lupus erythematosus: Experience in clinical practice settings in a regional hospital. Reumatol Clin. 2018 Mar 16. pii: S1699-258X(18)30041-X.
- Trentin F, Gatto M, Zen M, Maddalena L, Nalotto L, Saccon F, Zanatta E et al. Effectiveness, Tolerability, and Safety of Belimumab in Patients with Refractory SLE: a Review of Observational Clinical-Practice-Based Studies. Clin Rev Allergy Immunol. 2018 Apr; 54(2): 331-343.
- Blair HA, Duggan ST. Belimumab: A Review in Systemic Lupus Erythematosus. Drugs. 2018 Mar; 78 (3): 355-366.
OBJETIVOS: Se presenta una serie de casos de pacientes con Lupus Eritematoso Sistémico (LES) en nuestro centro por la Unidad de Enfermedades Autoinmunes y Minoritaria que han recibido Belimumab desde 2012 a 2018. Se realiza estudio descriptivo básico en cuanto a variables poblacionales demográficas básicas, complicaciones y toxicidad, e indicaciones seguidas.
PACIENTES Y MÉTODOS: Estudio transversal observacional descriptivo analizando 6 pacientes con LES diagnosticadas y tratadas con Belimumab tras fracaso de líneas de tratamiento previas mediante uso de “hoja de cálculo Microsoft Excel”.
RESULTADOS: Se trata de una población exclusivamente femenina (6 mujeres), con una edad media de 39,33, con una desviación estándar (ST) de ±18,27. Se trató tan solo a pacientes con diagnóstico de LES siguiendo criterios SLICC para diagnóstico y escala SLEDAI para actividad con tiempo medio desde el diagnóstico hasta la administración de Belimumab fue 6 años con una ST ±3. Se consiguió la desaparición de la actividad a los 6 meses en un 100% de las pacientes, medido según escala SLEDAI con mantenimiento y remisión total en el 75% de las pacientes; en el 25% restante, tras la retirada del fármaco, existió nuevo brote, precisando nueva administración de Belimumab.
Las indicaciones de inicio de tratamiento fueron: progresión de la enfermedad (fundamentalmente Nefropatía Lúpica) pese a inmunosupresión (2 casos), Corticodependencia (1 caso) o difícil control de brotes previamente bien controlados con Inmunosupresores (IS) (3 casos) todos con autoanticuerpos positivos. Los fármacos que estaban recibiendo las pacientes previo al tratamiento con Belimumab fueron: Deflazacort en 4 pacientes, Metilprednisolona 1 paciente, Prednisona 3 pacientes, Antipalúdicos del tipo Hidroxicloroquina 5 pacientes, Dapsona 2 pacientes, Micofenolato de Mofetilo 3 pacientes, Azatioprina 5 pacientes, Rituximab 3 pacientes e Inmunoglobulinas 1 paciente; ninguna paciente no seguía tratamiento con IS y una de ellas participó en un ensayo clínico (CELESTIAL 47). Además, en el momento del inicio de tratamiento con Belimumab, un 84% de las pacientes recibían 2 inmunosupresores y un 16% recibían 3 tras líneas secuenciales de tratamiento. No se apreciaron eventos adversos o tóxicos con la administración del fármaco. Tan solo dos pacientes (32%) precisaron nueva dosis de Belimumab para control de actividad de la enfermedad y una de ellas (16%) hasta una tercera.
CONCLUSIONES: El uso de Belimumab cada vez es más extendido en hospitales de Tercer Nivel en el tratamiento de LES de difícil control entre diversos autores, pero aún no se dispone de suficiente base científica para indicarlo de forma más precoz, limitándose a considerarse terapias de final de línea.
En nuestro centro se utiliza a dosis de 10 mg/kg/mes por progresión de la enfermedad a pesar de tratamiento con IS o difícil control de brotes anteriormente bien controlados siendo la mayoría de pacientes cumplidoras de criterios de refractariedad a IS y siempre con autoanticuerpos ANA y/o Anti-DNA positivos.
Aún nuestra experiencia es escasa, puesto que hemos tratado a pocos pacientes y precisamos de mayor evidencia para generar conocimiento al respecto, pero se consideran fármacos seguros y con buena tasa de éxito en alcanzar remisión sintomática y de afectación orgánica.
- Belimumab es un buen fármaco para control sintomático y progresión de la enfermedad en pacientes seleccionados con buen perfil de seguridad
- En nuestra serie (6 pacientes) se han observado tasas de control de actividad de hasta el 75%.
IF-10. ESTUDIO DESCRIPTIVO DE PACIENTES CON SÍNDROME ANTIFOSFOLÍPIDO GRAVE Y PRESENCIA DE ANTICUERPOS ANTIPROTROMBINA
Á. Sánchez de Alcázar del Río1, M. Morales Gómez1, C. Borrachero Garro1, I. Martín Suárez1, A. González Macía1, J. García Moreno1
1.Servicio de Medicina Interna. Complejo Hospitalario de Especialidades Juan Ramón Jimenez. Huelva
- González León R, García Hernández FJ, Castillo Palma MJ, Sánchez Román J. Anticuerpos antiprotrombina positivos en una paciente con síndrome antifosfolípido secundario y clínica hemorrágica. Medicina Clínica 2011; 137: 668-9.
OBJETIVOS: Describir la presentación clínica de una serie de casos de pacientes diagnosticados de Síndrome Antifosfolípido (SAF) en los que se objetivó la presencia de anticuerpos antiprotrombina, así como la morbimortalidad y los factores pronósticos asociados.
PACIENTES Y MÉTODOS: Se seleccionó a un grupo de pacientes seguidos en consultas externas de Enfermedades autoinmunes, diagnosticados de SAF grave, en los que se confirmó la presencia de Anticuerpos Anti Protrombina. Entre los pacientes con positividad del mismo se describieron las variables clínicas en el momento de la determinación, analíticas, y el espectro previo de anticuerpos antifosfolípidos (aFL), tales como anticuerpos anticardiolipina (ACL), anticoagulante lúpico (AL) y anticuerpos anti B2 glicoproteina 1b (Anti B2G1b) que presentaba cada paciente, así como el tratamiento inmunosupresor recibido, mediante el estudio retrospectivo de las historias clínicas.
RESULTADOS: El número de pacientes seleccionado fue 9. Respecto a la manifestación clínica de los pacientes, el 66,66% (6 pacientes) presentó manifestaciones trombóticas de repetición a pesar de una correcta anticoagulación con Acenocumarol, el 22,22% (2 pacientes) manifestó de forma simultánea evento trombótico y hemorrágico (siendo la forma de presentación de uno de ellos SAF catastrófico), mientras que sólo el 11,11% (1 paciente) tuvo clínica hemorrágica. Respecto a la determinación de anticuerpos antifosfolípidos, el 66,66% (6 pacientes) de los pacientes analizados presentó triple positividad de los mismos (ACL+, AL+ y Anti B2GP1b+) a títulos moderados-altos, mientras que el 33,33% (3 pacientes) restante presentó doble positividad para ACL y AL a títulos moderados, siendo negativo para Anti B2GP1b. En el 77,77% (7 pacientes) existían alargamiento de los tiempos de coagulación. En la mayoría de ellos (66,66%) se retiró la anticoagulación oral y fueron manejados con heparina de bajo peso molecular subcutánea, necesitando asociar esteroides e inmunosupresión en el 88,88% de los casos (8 pacientes), y recibiendo tratamiento con Prednisona y Azatioprina el 75% de los mismos (6 pacientes), mientras que el 25% (2 pacientes) necesitó la administración de Rituximab.
CONCLUSIONES: Estamos ante un SAF grave cuando hay recurrencia de fenómenos y persistencia de positividad del espectro de aFL. A destacar el SAF catastrófico, donde existe la presencia de enfermedad trombótica diseminada, en vasos de pequeño calibre, con fallo multiorgánico asociado. Hasta un 25-59% de pacientes con SAF grave presenta positividad para anticuerpos antiprotrombina, pudiendo aparecer además clínica hemorrágica por la interacción que este anticuerpo tiene con la protrombina (factor II de la coagulación), uniéndose a su fracción inactiva y ocasionando un lavado acelerado de la misma, presentando un elevado incremento de la morbimortalidad, tanto por fenómenos trombóticos como por fenómenos hemorrágicos, sobre todo si presenta triple positividad para aFL. Ha de sospecharse ante pacientes con SAF que presentan fenómenos trombóticos a pesar de una correcta anticoagulación, alargamiento de tiempos de coagulación o aquellos que presentan clínica hemorrágica. El tratamiento consiste en la retirada de dicumarínicos hasta la estabilización del cuadro, dada la interferencia de los anticuerpos antiprotrombina con el factor II, administrando en su lugar heparina de bajo peso molecular y asociando en ocasiones tratamiento inmunosupresor (basado en esteroides, Azatioprina o Rituximab) para disminuir, o incluso negativizar, los niveles de anticuerpos antiprotrombina.
IF-11. USO DE RITUXIMAB EN UN HOSPITAL COMARCAL
E. Manzano López1, D. González Vaquero2, N. Castillo Fernández1, C. Ocaña Losada1, J. Rodríguez Rodríguez1, G. Gómiz Rodríguez1, J. Serrano Carrillo de Albornoz1
1.Medicina Interna
2.Farmacia. Hospital de Poniente. El Ejido (Almería)
- Asociación española del medicamento y productos sanitarios [Sede web]. Madrid. AEMPS. 15 de septiembre de 2017 [acceso 10 de enero de 2018]. Ficha técnica de rituximab: https://www.aemps.gob.es › cima › pdfs.
OBJETIVOS:Nuestro objetivo es describir la incidencia de complicaciones derivadas del uso de rituximab en indicaciones off- label y su relevancia clínica en un hospital comarcal.
PACIENTES Y MÉTODOS:Se recogieron todos los pacientes que recibieron rituximab, desde 2009 hasta octubre de 2017. Se realizó una revisión de la historia clínica digital y del registro de uso llevado a cabo por el servicio de farmacia. Se recogieron datos demográficos, la indicación para la que se pautó y las reacciones adversas recogidas en los 6 meses posteriores al inicio del tratamiento. Análisis de los datos con IBM SPSS Statistics versión 24.
RESULTADOS: Se analizaron un total de 21 pacientes siendo el 47.6% varones y un 52.4% mujeres con una edad media de 53 años. Los diagnósticos registrados fueron 28.6% glomerulonefritis primarias, 23.8% glomerulonefritis lúpica, 23.8% vasculitis, 14.3% miopatías inflamatorias y 9.5% pénfigos. Un 42.6% de los pacientes sufrieron reacciones adversas. Ningún paciente tuvo que suspender el tratamiento por reacción adversa. La complicación más frecuente fueron las citopenias que presentaron 11 pacientes (52.4%). La citopenia más frecuente fue la anemia (47.6%), seguida de la leucopenia (28.6%) y finalmente la trombopenia (14.3%).Un 66.7% de las reacciones adversas requirió ingreso por neumonía o sepsis. El 22.2% de las RAMs fueron infecciones respiratorias que no precisaron ingreso. Se registró un caso de fibrilación auricular. No se registraron reacciones relacionadas con la perfusión de rituximab.
CONCLUSIONES:Se trata de un estudio descriptivo, retrospectivo basado en la revisión de la historia clínica, con un número pequeño de pacientes (21 casos) aunque para un hospital comarcal es un número significativo de pacientes. No se observaron reacciones adversas graves, se recogieron los casos que motivaron ingreso o consultar en el servicio de urgencias hospitalarias. Probablemente, las reacciones leves estén infraestimadas. Sólo una cuarta parte de los pacientes requirieron ingreso, ninguno tuvo que interrumpir el tratamiento y no hubo ningún exitus secundario a su uso.
Según la evidencia disponible las reacciones adversas más frecuentes asociadas al uso de rituximab son las relacionadas con la perfusión y llama la atención que en nuestro hospital no se haya registrado ningún caso. En nuestro caso la reacción adversa más frecuente fueron las citopenias, en especial la anemia.
Además, se detectó un caso de fibrilación auricular que se trata de una reacción adversa frecuente, aunque las reacciones adversas cardiológicas no suelen registrarse en la historia clínica, se les da mayor importancia a las complicaciones infecciosas. Sería de utilidad un estudio con un tamaño muestral mayor y que fuera más incisivo en el registro de reacciones adversas, en la causa de las citopenias, en otras reacciones adversas a parte de las infecciones, incluso que correlacionara los niveles de inmunoglobulina G y subpoblaciones linfocitarias con el riesgo de infecciones.
En nuestro hospital rituximab es usado de forma compasiva y mayoritariamente en glomerulonefritis primarias. La mayoría de los pacientes no sufrieron reacciones adversas graves. Aproximadamente una cuarta parte de los pacientes requirió ingreso y ninguno tuvo que suspender el tratamiento. No se produjo ningún fallecimiento asociado al fármaco. La reacción adversa más frecuente fueron las citopenias (principalmente anemia) que afectó a la mitad de los pacientes, seguida de las infecciones. En resumen, a pesar de las limitaciones del estudio, rituximab es un fármaco seguro.
IF-13. TRATAMIENTO CON RITUXIMAB A BAJA DOSIS EN ENFERMEDADES AUTOINMUNES
R. Ríos Fernández1, J. Callejas Rubio1, D. Sánchez Cano1, F. Hernández Mohedo2, N. Ortego Centeno1
1.Unidad de enfermedades autoinmunes sistémicas. Hospital San Cecilio. Granada
2.Servicio de Hematología. Hospital Universitario Virgen de las Nieves. Granada
- Barcellini W, Zaja F, Zaninoni A et al. Low-dose rituximab in adult patients with idiopathic autoimmune hemolytic anemia: clinical efficacy and biologic studies.Blood. 2012; 119: 3691-7.
- Zaja F, Vianelli N, Volpetti S et al. Low-dose rituximab in adult patients with primary immune thrombocytopenia. European journal of haematology. 2010; 85: 329-34.
- Callejas Rubio JL, Camps MT, García-Hernandez F and Asociacion Andaluza de Enfermedades A. [Treatment with rituximab of autoimmune disease: results from AADEA’s registry]. Medicina clínica. 2008; 130: 79.
OBJETIVOS: Rituximab (RTX) es un anticuerpo monoclonal quimérico anti CD20, que ha demostrado ser eficaz en muchas enfermedades autoinmunes. Hasta ahora, dos pautas son las que se usan en la práctica clínica diaria: el protocolo del linfoma (375 mg/m2 ×4 semanas ) y el protocolo de artritis reumatoide (1000 mg los días 1 y 15).
Existen ya trabajos donde se ha visto la efectividad de RTX a baja dosis en pacientes con anemia hemolítica autoinmune (AHA) o púrpura trombocitopénica autoinmune (PTI) encontrando una respuesta similar a la del protocolo de linfoma. Aportamos el resultado de nuestros pacientes con enfermedades autoinmunes tratados con baja dosis de RTX.
PACIENTES Y MÉTODOS: Se realizó una revisión en nuestra consulta de enfermedades autoinmunes sistémicas de aquellos casos tratados con RTX a baja dosis entre abril de 2016 y marzo de 2018. Se recogieron las siguientes variables: Edad, sexo, diagnóstico, causa de tratamiento, tratamiento al inicio y al final del seguimiento.
Los pacientes fueron seguidos durante 12 meses tras el tratamiento, recogiéndose los datos de hemoglobina o plaquetas, según procediese, al inicio, al mes, a los tres meses , 6 meses y 12 meses tras el tratamiento.
RESULTADOS: Se encontraron 4 casos tratados con RTX, todas ellas mujeres entre 45 y 83 años. Dos pacientes estaban diagnosticadas de un LES y otras dos de S. de Sjögren. Las pacientes con LES tenían una AHA y las pacientes con Sjögren tenían una PTI. Todas ellas estaban en tratamiento con esteroides y sólo una, que tenía una AHA, tomaba también un inmunosupresor (azatioprina). En todas menos en una, se pudo reducir la dosis de esteroides tras el tratamiento con RTX.
En los pacientes con AHA se observó una mejoría de las cifras de hemoglobina que era mantenida durante todo el año. En las pacientes con PTI, en una de ellas, hubo una subida de las cifras de plaquetas que sólo se mantuvo 6 meses y en la otra no hubo respuesta alguna.
CONCLUSIONES: Hemos observado que el tratamiento con RTX es efectivo en la AHA. En la PTI observamos solo efectividad en uno de los casos, y además la respuesta no fue tan duradera como en la AHA. Esto permitió poder bajar el tratamiento inmunosupersor en estos pacientes.
Se ha publicado la eficacia de RTX a baja dosis en distintas enfermedades inmunológicas: artritis reumatoide, LES, AHA, PTI, pénfigo, neutropenia autoinmune, y miastenia entre otras. En estos casos el tratamiento con rituximab a baja dosis permitiría evitar los efectos secundarios del mismos (reacciones de infusión, reactivación de enfermedades virales y la leucoencefalopatía multifocal progresiva).
Hasta ahora el tratamiento con RTX en los distintos hospitales es de segunda línea y de uso compasivo dado el alto coste que supone. Al bajar la dosis, se baja el coste y podría considerarse como una opción terapéutica.
RTX a baja dosis es un tratamiento efectivo, permitiendo bajar la dosis de corticoides, particularmente en la AHA.