Caso Clínico
Síndrome del dedo azul, ¿qué opción terapéutica deberíamos tomar?
Blue Toe Syndrome, ¿What should we do?
Actual. Med. 2018; 103: (805). Supl. 19-44
RESUMEN
El Ateroembolismo se caracteriza por la migración de émbolos, que provienen de placas ateroescleróticas (sobre todo en el eje aórtico central), hacia órganos diana. Esta patología presenta una serie de factores predisponentes y factores desencadenantes. Existen diversas estrategias terapéuticas que van desde el manejo médico conservador hasta el tratamiento quirúrgico (cirugía abierta o endovascular). Describimos un caso de ateroembolismo distal del miembro inferior izquierdo, que en principio se trató de manera conservadora con tratamiento médico y se identificaron lesiones arterioescleróticas en su eje arterial central.
Palabras clave: Ateroembolismos, Síndrome del dedo azul, livideces distales.
ABSTRACT
Atheroembolism is the migration of cholesterol clots from the aorta to target organs, with risk and triggers factors. There are differents kinds of therapies, from medical treatment to a surgical one (endovascular or open surgery). Now we are going to describe a 58 years old male case with Blue Toe Syndrome in the inferior left limb, early treated in a medical way and atherosclerotic plaques demonstrated.
Keywords: Atheroembolism, Blue toe syndrome, distal lividities.
Leer Artículo Completo
INTRODUCCIÓN
El Síndrome del Dedo Azul es la aparición de lesiones, generalmente en forma de cianosis, en uno o más dedos de una extremidad (la inferior es la más frecuente) manteniendo presentes los pulsos distales; es una manifestación de un ateroembolismo a nivel de un miembro inferior.
Fue descrito por primera vez por Flory en 1945. En la actualidad presenta una prevalencia del 1% – 4% según los estudios clínicos (1). La incidencia de esta patología es difícil de cuantificar ya que se trata de una patología sobre diagnosticada (más de un 25%). Entre los factores de riesgo más representativos se encuentran la edad (más frecuente en mayores de 60 años), enfermedad arterial periférica, hipertensión arterial (HTA) y la enfermedad coronaria pues todos ellos favorecen el desarrollo de arterioesclerosis, que es la principal fuente de los émbolos. Al mismo tiempo existen factores precipitantes o desencadenantes, de entre los que destacan, los procedimientos endovasculares (1.6%) con intervalo del 1.3% al 3.6% (2), que se erigen como la primera causa debido al incremento de tratamientos que se realizan por esta vía actualmente. La segunda causa más frecuente descrita ocurre de manera espontánea (3). Existen otras causas como son los traumatismos y la cirugía cardíaca.
Manifestaciones clínicas del ateroembolismo: Las cutáneas son las más frecuentes, en las extremidades inferiores (livedo reticularis, dedos azules…) y pueden tardar en aparecer hasta 1 mes tras el evento desencadenante en el 50% de los casos. La afectación renal se presenta entre el 5% al 10%, se puede expresar en forma de Necrosis Tubular Aguda (NTA) o de Enfermedad Renal Crónica (ERC) tanto estable como terminal. En un tercio de ellas termina con Terapia de Sustitución Renal (TSR). El colon es el órgano más afectado del sistema gastrointestinal (en un 42% aproximadamente) (6), mientras que en el SNC se manifiesta en forma de eventos isquémicos cerebrales o retinianos (lesiones de Holenhorts y AITs).
El diagnóstico definitivo se realiza por biopsia del órgano afectado, en muy raros casos necesario, y las pruebas de imagen tales como Angio TAC, Angio RMN y la ecografía solo determinan zonas de ateroesclerosis, pero no son capaces de identificar la placa causante del ateroembolismo.
Existen 3 objetivos terapéuticos principales: tratamiento del órgano afectado, prevención de nuevos episodios y profilaxis de la morbimortalidad cardiovascular. Hay diversas estrategias como son el manejo conservador médico que incluye el uso de prostaglandinas sistémicas para las lesiones focales y la antiagregación para profilaxis. Otra serie de terapias tales como la antiagregación o la papaverina intraarteriales se han utilizado pero no existen ensayos aleatorizados que muestren que esta terapia tiene beneficio. Hoy en día se plantea el uso de estatinas (estabiliza la placa y disminuye la livedo reticularis) e inhibidores de enzima convertidora de angiotensina en los pacientes con ateroembolismo como profilaxis cardiovascular. La anticoagulación no se recomienda por considerarse un factor precipitante de eventos ateroembólicos; solo se aconseja si hay indicación por otro motivo.
La reparación quirúrgica está indicada en patología infrarrenal y que se acompañe de isquemia de miembros inferiores (MMII) y consiste en la exclusión del segmento proximal y distal de la lesión. Se considera más seguro que los procedimientos endovasculares. Actualmente no existen estudios suficientes que evidencien mejores resultados de la terapia endovascular frente a la cirugía abierta, como se puede ver en los estudios de Okki et al (6), donde el 53% se trató endovascular (Angioplastia + Stent) y no presentaron complicaciones, el 27% restante requirió amputación (el 75% mayor y 25% menor), el 7% presentó embolismo recidivante y el otro 7% progresión de la enfermedad, el resto abandonaron el estudio. En los estudios de Renshaw et al (7) y Kumins et al (8), se evidenció mejoría clínica y se propuso como opción terapéutica el tratamiento endovascular. Todos estos estudios se realizaron en poblaciones pequeñas y con variabilidad entre sus resultados. Brewer et al (9) ha propuesto que las lesiones podrían tratarse estabilizando la placa con tratamiento antiplaquetario primero y, si no aparecen síntomas nuevos, angioplastia transluminal percutánea a las 6 semanas. Con el advenimiento de mejores stents (recubiertos) y sistemas de liberación más controlados al igual que mejoría en las técnicas endovasculares, se requieren nuevos estudios prospectivos y mayor tamaño muestral.
También están descritas la simpatectomía y el estimulador de la médula espinal para el control del dolor en casos refractarios o sin opción quirúrgica.
El pronóstico de una ateroesclerosis diseminada, con embolismo de repetición es malo, con una mortalidad a 1 año entre el 64 % al 81% y una tasa de amputación por pérdida tisular hasta un 45% en algunas series (4).
CASO CLÍNICO
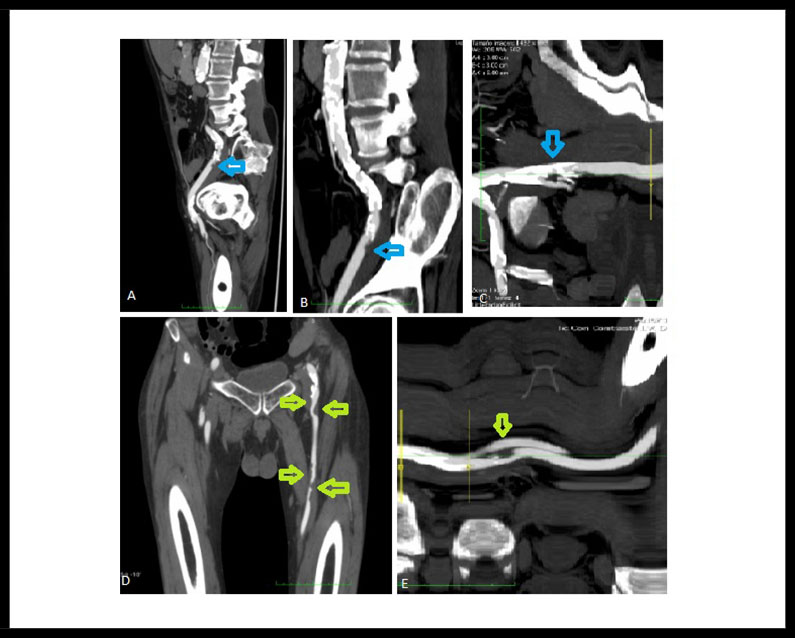
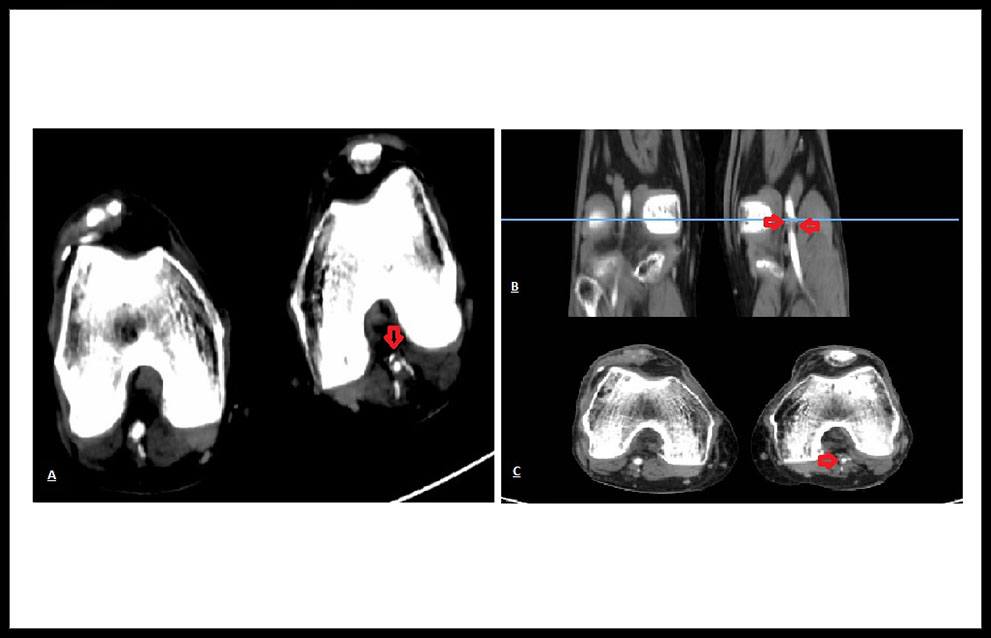
Paciente varón de 58 años, fumador de 1 paquete día, sin otros antecedentes patológicos personales ni familiares de interés, que acudió al servicio de urgencias por dolor y cianosis en los dedos del miembro inferior izquierdo (MII), de forma súbita, conservando pulsos distales en todo momento. Se pautó analgesia y solicitó estudio de imagen (Angio TAC) de manera ambulatoria, donde se evidenció ateromatosis en el sector aorto-ilíaco y fémoro-poplíteo del miembro inferior izquierdo (MII) y se pautó tratamiento médico. (Figura 1.) (Figura 2.)
Figura 1. (A), (B) y (C): Flechas de color celeste, úlceras arterioescleróticas en el sector Iliáco. (D) y (E): Flechas de color verde úlceras arterioescleróticas en Arteria Femoral Común y Femoral Superficial.
Figura 2. (A) y (C) Flechas rojas úlcera arterioescleróticas en Arteria Poplítea Izquierda en corte transversal. (B) Flechas rojas úlcera arterioescleróticas en Arteria Poplítea Izquierda en corte coronal.
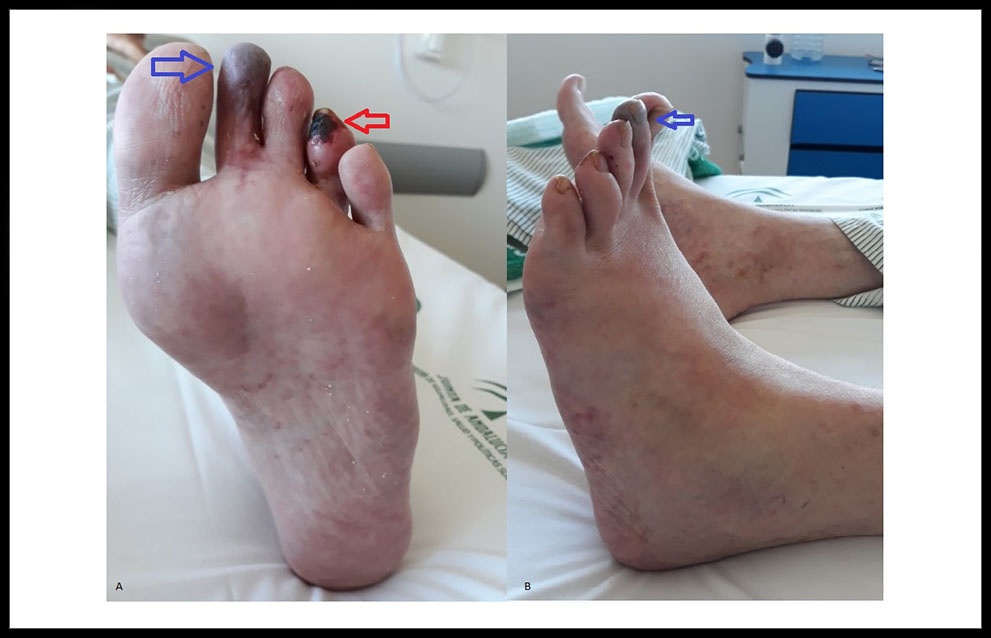
El paciente acudió nuevamente al Servicio de Urgencias por empeoramiento del dolor, que no controlaba con analgesia pautada. Se ingresó para tratamiento con prostaglandinas intravenosas durante 15 días y analgesia IV; la mayoría de las lesiones desaparecieron progresivamente, delimitándose con necrosis seca a nivel distal del 2º y 4º dedos del MII. (Figura 3.)
Figura 3. (A) y (B): cianosis total del 2º dedo MII (flechas azules), necrosis seca del 4º dedo del MII (flecha roja) y lesiones de características ateroembólicas en la planta del pie izquierdo.
El paciente fue dado de alta con tratamiento antiplaquetario (Clopidogrel, alergia al ácido acetilsalicílico), estatinas (Atorvastatina), analgesia de rescate además de control de factores de riesgo vascular, como la abstinencia absoluta del hábito tabáquico.
DISCUSIÓN Y CONCLUSIONES
Paciente con un cuadro de ateroembolismo del MII, que se trata de manera conservadora con control del dolor, antiagregación y estatinas. Añadiendo al tratamiento las Prostaglandinas iv, se consigue la desaparición de la mayoría de las lesiones digitales y la delimitación de una necrosis focal en el 2º y 4º dedos del MII.
En las pruebas de imagen iniciales se objetivan placas ateroescleróticas en el eje del miembro afectado, de una extensión considerable al estar en distintos sectores.
Basándonos en la bibliografía y las guías actuales que refieren aislar o eliminar la fuente embolica (10), se consideraron varias opciones terapéuticas a tomar: mantener tratamiento conservador, realizar un procedimiento endovascular (Angioplastia + Stent recubierto) o cirugía abierta con derivación mediante By Pass del sector afectado como tratamiento definitivo. Nosotros optamos por el tratamiento conservador, al encontrarnos con lesiones en varios sectores, a nivel aorto-iliaco y a nivel fémoro-poplíteo.
REFERENCIAS
- Mayo RR, et al: Redefining the incidence of clinically detectable atheroembolism. Am J Med 100(5):524–529, 1996.
- Ballard J, et al: Aortoiliac stent deployment versus surgical reconstruction: analysis of outcome and cost. J Vasc Surg 28(1):94–103, 1998.
- Jeffrey W. Olin/ John K. Bartholomew/Atheromatous Embolization/Rutherfords Vascular Surgery 8th Edition/Elseviere/2014.
- Síndrome del dedo azul/Artículo Especial/Rev Esp Cardiol 71 (2) 111 e1 – e69/2018.
- SC Smith Jr, EJ Benjamin, RO Bonow, et al/ AHA/ACCF secondary prevention and risk reduction theraphy for patien with coronary and other atherosclerotic vascular disease: 2011 update/J Am coll Cardiol 58 (23)/2011.
- Ohki T, et al: Ex vivo human carotid artery bifurcation stenting correlation of lesion characteristics with embolic potential. J Vasc Surg 27(3):463–471, 1998.
- Renshaw A, et al: Angioplasty with stenting is effective in treating blue toe syndrome. Vasc Endovascular Surg 36(2):155–159, 2002.
- Kumins NH, et al: Early experience using the Wallgraft in the management of distal microembolism from common iliac artery patholology. Ann Vasc Surg 16(2):181–186, 2002.
- Brewer ML, Kinnison ML, Perler BA, White RI Jr. Blue toe syndrome: treatment with anticoagulants and delayed percutaneous transluminal angioplasty.Radiology. 1988;166 (1 Pt 1):31–36.
- Victor Aboyans* (coordinador de la ESC) (Francia), Jean-Baptiste Ricco*,a (coordinador) (Francia), Marie-Louise E.L. Bartelink (Paises Bajos), Martin Bjorcka (Suecia), Marianne Brodmann (Austria), Tina Cohnerta (Austria), Jean-Philippe Collet (Francia), Martin Czerny (Alemania), Marco De Carlo (Italia), Sebastian Debusa (Alemania), Christine Espinola-Klein (Alemania), Thomas Kahan (Suecia), Serge Kownator (Francia), Lucia Mazzolai (Suiza), A. Ross Naylora (Reino Unido), Marco Roffi (Suiza), Joachim Rotherb (Alemania), Muriel Sprynger (Belgica), Michal Tendera (Polonia), Gunnar Tepe (Alemania), Maarit Venermoa (Finlandia), Charalambos Vlachopoulos (Grecia) e Ileana Desormais (Francia) Guía ESC 2017 sobre el diagnóstico y tratamiento de la enfermedad arterial periférica, desarrollada en colaboración con la European Society for Vascular Surgery (ESVS), Rev Esp Cardiol. 2018;71(2):111.e1-e69
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Dr. David Esteban Abad Gómez. Unidad de Gestión Clínica de Angiología y Cirugía. Vascular del Hospital Universitario San Cecilio de Granada
Avenida de la Innovación S/N. Código Postal 18016