Revisión
COVID-19 y cáncer de próstata: "una asociación de interés clínico"
Prostate cancer and COVID-19: "an association of clinical interest"
Actual Med. 2021; 106(814). Supl2: 130-134
RESUMEN
Analizamos la posible relación del Cáncer de Próstata (CP) y la COVID-19. Los bajos niveles de andrógenos (niveles de castración química o niveles indetectable) ejercen una modulación negativa sobre la Proteasa TMPRSS2. Esto esta respaldado por el posible papel de la sensibilidad del Receptor Androgénico (RA) a los niveles de andrógenos en sangre. Si estos son bajos, la modulación sobre la Proteasa TMPRSS2 es negativa; en cambio, si son altos la modulación es positiva y se favorece con ello la entrada del virus al interior de la célula. Es decir, los Inhibidores de la Proteasa TMPRSS2 y la Terapia Supresora de Andrógenos) (ADT: Androgenic Deprivation Therapy) dificultan la entrada del virus en la célula. Lo andrógenos en sangre y la sensibilización del Recepto Androgénico a estos facilitan la entrada del virus asi como el incremento del PSA (Antígeno Prostático Especifico), un marcador tumoral se usa para detectar el cáncer de próstata. La TMPRSS2 es una proteína endotelial implicada en la colonización viral (SARS-CoV-2 y COVID19). Inhibir la TMPRSS2 podría potencialmente ser una terapia clínica efectiva para la COVID-19.
Palabras clave: Cáncer de Próstata; COVID-19; Niveles de castración; Proteasa TMPRSS2; Sensibilización del Recepto Androgénico.
ABSTRACT
We analyze the possible relationship between Prostate Cancer (PC) and COVID-19. Androgens low levels (levels of chemical castration or undetectable levels) exert a negative modulation on the TMPRSS2 Protease. This is supported by the possible role of Androgen Receptor (AR) sensitivity to androgen levels in the blood. If these are low, the modulation on the TMPRSS2 Protease is negative; Nevertheless, if they are high, the modulation is positive and thus the entry of the virus into the cell is favored. In other words, TMPRSS2 Protease Inhibitors and Androgenic Deprivation Therapy (ADT) make it difficult for the virus to enter the cell. The androgens in the blood and the sensitization of the Androgen Receptor to these facilitate the entry of the virus as well as the increase of the PSA (Prostate Specific Antigen), a tumor marker used to detect prostate cancer. TMPRSS2 is an endothelial protein involved in viral colonization (SARS-CoV-2 and COVID19). Potentially, inhibiting TMPRSS2 could be an effective clinical therapy for COVID-19.
Keywords: Prostate cancer; COVID-19; Castration levels; TMPRSS2 protease; Androgen Receptor Awareness.
Leer Artículo Completo
Las infecciones provocadas por los coranovirus son comunes en todo el mundo y afectan a personas y animales. En los humanos pueden causar el catarro común y la gastroenteritis en los lactantes. Por el contrario, el coronavirus del Síndrome Respiratorio Agudo Severo (SARS-Cov: Severe Acute Respiratory Syndrome) y el coronavirus del Síndrome Respiratorio de Oriente Medio (MERS: Middle East Respiratory Syndrome ) se transmiten de animales a humanos y causan enfermedades respiratorias graves en las personas afectadas.
El SARS surgió en 2002 en la provincia de Guangdong, al sureste de China, y los murciélagos de herradura chinos sirven como reservorios naturales. La transmisión humana fue facilitada por huéspedes intermediarios como los gatos de algalia y los perros mapache, que con frecuencia se venden como fuentes de alimento en los mercados húmedos chinos. En la actualidad no se dispone de vacunas y la pandemia de 2002 y 2003 fue detenida con medidas de control convencionales, restricciones de viaje y aislamientos de pacientes.
En diciembre de 2019, surgió una nueva enfermedad respiratoria de origen infeccioso en Wuhan, provincia de Hubei, al norte de Guangdong. La infección se relacionó con el mercado de animales de Huanan, posiblemente debido al contacto con estos. Posteriormente, se produjo la transmisión de persona a persona y la enfermedad se denominó en un principio como SARS de Wuhan, Neumonía de Wuhan o SARS-Coronavirus 2 (SARS-CoV 2) para diferenciarla del SARS-CoV. En enero de 2020, la OMS recomendó que el nombre provisional de la enfermedad fuera el de “Enfermedad respiratoria aguda por 2019-nCoV”. La OMS anunció un mes mas tarde que COVID-19 sería el nombre oficial de la enfermedad; un acrónimo de “COronaVIrus Disease 2019” (Enfermedad por coronavirus 2019, en español).
Tres aspectos, que consideramos de interés, son analizados: La entrada del virus en la célula, los mecanismos implicados que pueden impedir la entrada y, COVID-19 y Cáncer de Próstata (CaP). Intentamos, con una terminología fácil y al mismo tiempo explicativa, que la lectura y comprensión sea lo mas amena posible.
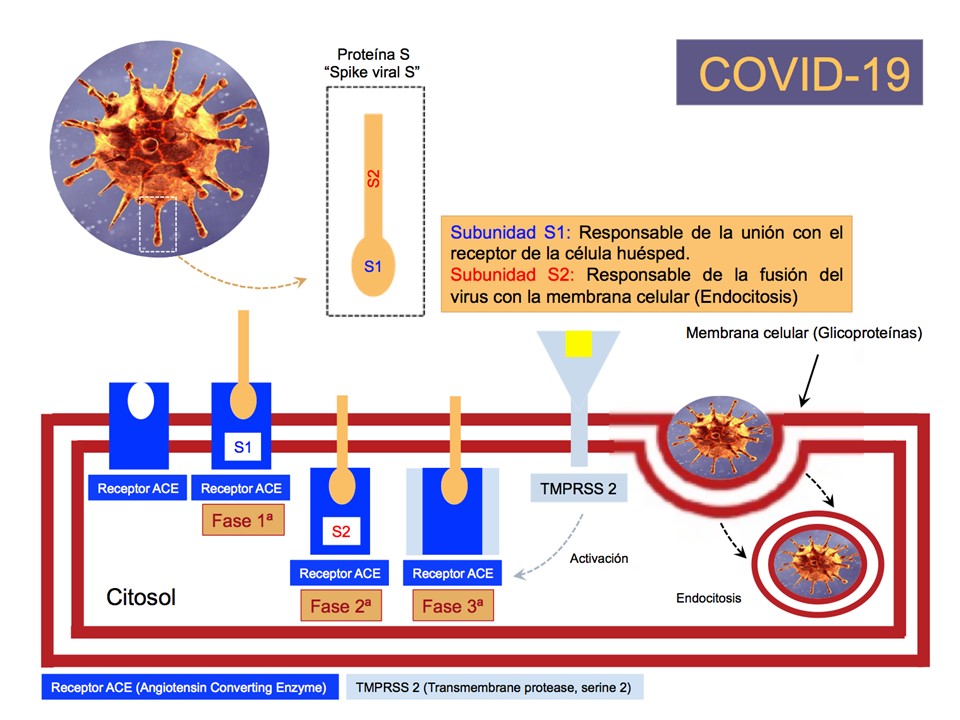
La COVID-19 penetra en las células que forman cualquier epitelio; respiratorio, digestivo, prostático etc., gracias a la intervención de tres proteínas (“S”, “ACE” e “TMPRSS2”). La “Proteina S” es una glicoproteína, que tiene una morfología en forma de “aguja” (Spike, espícula en inglés) y que envuelve al virus. Esta (“Spike viral S”) facilita la unión del virus con la proteína ACE2 (Angiotensin Converting Enzyme 2: Enzima Convertidora de Angiotensina 2) de la célula huésped que actúa como receptor (Fig. 1). La proteína “S” esta constituida por dos subunidades, la S1 y la S2. La primera, la S1, es responsable de su unión con el receptor (ACE) de la célula hospedadora. En cambio, la S2 es responsable de la fusión del virus con las membrana celular (Fig. 1). El desdoblamiento o la escisión de la proteína “S” en las dos subunidades se debe a la actuación de la tercera proteína comentada, la Proteasa TMPRSS2 (Transmembrane Protease Serine 2: Proteasa transmembrana serina 2) (Fig.1).
Figura 1. El ACE2 (Angiotensin Converting Enzyme 2: Enzima Convertidora de Angiotensina 2) y la Proteasa TMPRSS2 (Proteasa Transmembrana Serina 2) son dos receptores de membrana de superficie que participan en la entrada de la COVID-2 en la célula diana del huésped. El acoplamiento del virus a las células se produce tras la unión de la Proteína “Spike viral S” (Subunidad S1: Responsable de la unión con el receptor de la célula huésped) al Receptor ACE2 (Fase 1ª). A continuación el virus entra en el interior de la célula del huésped por endocitosis y es recubierto por un fragmento de membrana celular (Fase 2ª). Este mecanismo recibe el nombre de endocitosis (Endocitosis: Proceso por el cual las células incorporan dentro de ellas moléculas, que son recubiertas por una vesícula formada a partir de la propia membrana celular. En ambas fases, el proceso de unión del “Spike viral S” al Receptor ACE2 debe ser activado por la Proteasas TMPRSS2. Después de la fusión, el contenido genómico y proteico de la COVID-19 se entrega al citosol (El líquido que se localiza dentro de las células) y el virus comienza su ciclo de replicación. (El proceso de replicación del ADN (Ácido DesoxirriboNucleico, conocido también por las siglas ADN, es un ácido nucleico que contiene las instrucciones genéticas) es el mecanismo que le permite duplicarse; es decir, sintetizar una copia idéntica. De esta manera, de una molécula de ADN única, se obtienen dos o más “réplicas” de la primera y la última.
La activación de la proteína “S” por parte de la Proteasa TMPRSS2 abre las puertas de la célula al virus. El proceso tiene dos fases: Fase 1ª.- La Subunidad S1 de la Proteína “S” se acopla al receptor ACE, lo que facilita la unión viral a la superficie de las células diana. Fase 2ª.- La Subunidad S2 favorece la fusión de la 0envoltura viral (Proteina”S”) con la membrana celular, lo que permite la fusión de ambas; es decir la fusión del virus con la célula (Fig. 1). Después de la fusión, el contenido genómico y proteico de la COVID-19 pasa al citosol (“Líquido que se localiza dentro de la célula”) y el virus comienza su ciclo de replicación. La actuación de la Proteasa TMPRSS2, que suele localizarse cerca del receptor ACE, es imprescindible para que ambas fases tengan lugar. La Proteasa TMPRSS2 es una enzima proteolítica, también conocidas como peptidasas o proteasas (Enzimas proteolíticas: Sustancias que se producen de manera natural en estómago y páncreas, y que son responsables de gran cantidad de funciones, como el proceso de la digestión, la división celular y la degradación de proteínas y aminoácidos para su correcta absorción).
Quiero aclarar, para evitar confusiones fáciles, que la ACE2 muestra una considerable homología con la ACE (Enzima Convertidora de Angiotensina), que se traduce en un 40% de identidad y un 61% de similitud. A diferencia de la ACE, la ACE2 no convierte la angiotensina I en angiotensina II, ni los inhibidores de la ECA bloquean su actividad (Los inhibidores de la ECA se utilizan para tratar la insuficiencia cardíaca y la hipertensión arterial ).
El segundo aspecto que analizamos corresponde a los mecanismos implicados que pueden impedir la entrada del virus en la célula: Fármacos y andrógenos en la COVID-2 y el Cáncer de Próstata. La entrada de la COVID-19 en la célula podría ser bloqueada tanto por los anticuerpos neutralizantes de la proteína “S” (Anticuerpos: Sustancia segregada por los linfocitos para combatir una infección producida por virus o bacterias) como por los inhibidores de la proteasa “TMPRSS2”.
Hace tan solo unos meses, Markus Hoffmann, investigador en el “German Primate Center”, University of Göttingen, ha querido averiguar cómo el nuevo coronavirus (COVID-19) entra en las células del huésped y cómo se puede bloquear este proceso. Sus resultados muestran que se requiere que la Proteasa TMPRSS2, presente en el cuerpo humano, entre en las células. En este sentido los investigadores han podido comprobar que el “Mesilato de Camostat” inhibe la Proteasa TMPRSS2. Tras esta comprobación han averiguado que también se puede prevenir la infección por la COVID-19. Es decir, el “Mesilato de Camostat” bloquea la entrada del virus en las células que forman parte del epitelio respiratorio. Por tanto, esta proteasa es un objetivo potencial para posibles intervenciones terapéuticas presentes y futuras.
En esta misma línea, y tan solo hace unas semanas, los profesores Jun-ichiro Inoue y Mizuki Yamamoto, del Centro de Investigación de Enfermedades Infecciosas Asiáticas del Instituto de Ciencias Médicas de la Universidad de Tokio, comunican los resultados de un ensayo clínico frente a la COVID-19 con el empleo de un fármaco comercializado para otras enfermedades. Se trata del “Mesilato de Nafamostat”, utilizado en Japón para tratar la pancreatitis aguda y antes en Europa como medicamento para la fibrosis quística (Fig. 2). Los investigadores demuestran que el Nafamostat previene la fusión de la envoltura del virus con las membranas de la superficie de la célula huésped, la 2ª Fase de la entrada de la COVID-19 en la célula (Fig. 1). Además, puede inhibir la fusión del virus con la célula a una concentración inferior a una décima parte del “Mesilato de Camostat”, comentado. Con independencia de ello ambos fármacos, “Mesilato de Camostat” y “Mesilato de Nafamostat”, son viejos conocidos de los clínicos y existen datos que demuestran sus perfiles de seguridad.
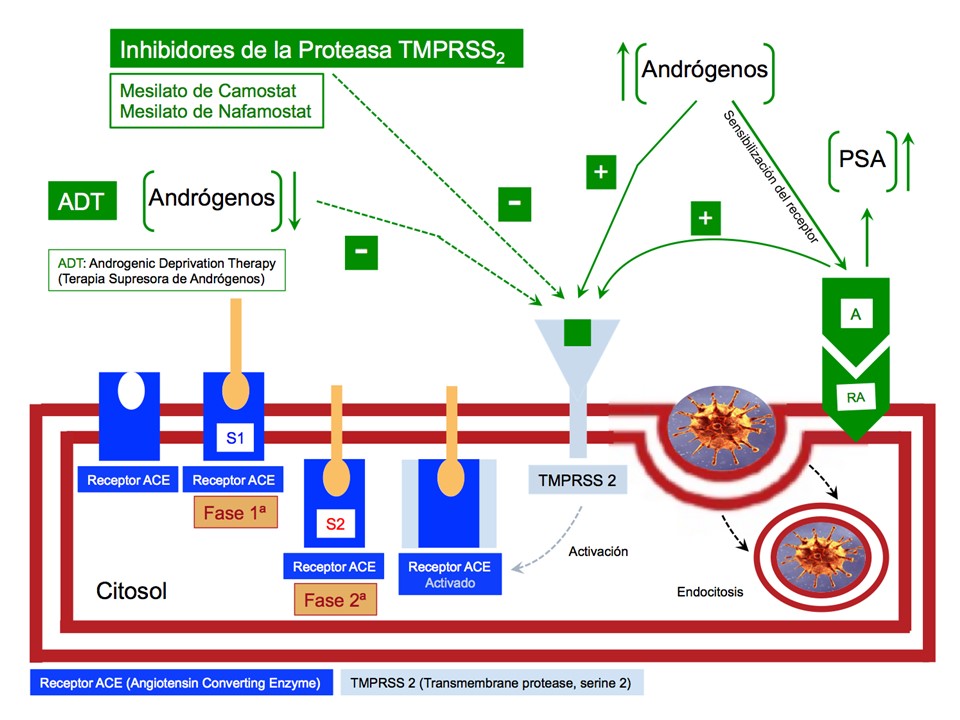
Figura 2. Los bajos niveles de andrógenos (niveles de castración química o niveles indetectable) ejercen una modulación negativa sobre la Proteasa TMPRSS2, empleando una vía similar a los Inhibidores de la Proteasa TMPRSS2, el “Mesilato de Camostat” y el “Mesilato de Nafamostat comentada”. Todo esto esta respaldado por el posible papel de la sensibilidad del Receptor Androgénico (RA) a los niveles de andrógenos en sangre. Si estos son bajos, la modulación sobre la Proteasa TMPRSS2 es negativa; en cambio, si son altos la modulación es positiva y se favorece con ello la entrada del virus al interior de la célula. Es decir, los Inhibidores de la Proteasa TMPRSS2 y la Terapia Supresora de Andrógenos) (ADT: Androgenic Deprivation Therapy) dificultan la entrada del virus en la célula. Lo andrógenos en sangre y la sensibilización del Recepto Androgénico a estos facilitan la entrada del virus asi como el incremento del PSA (Antígeno Prostático Especifico), un marcador tumoral se usa para detectar el cáncer de próstata.
El enfoque de la reutilización de fármacos se ha seguido como una táctica de gestión temporal para tratar a los pacientes con la COVID-19. Sin embargo, la eficacia de muchos de los fármacos aprobados ha sido controvertida. Por tanto, sigue siendo una prioridad mundial mantener los esfuerzos para el rápido desarrollo de nuevas moléculas. Es importante resaltar, por la repercusión mediática habida, que la Cloroquina no bloquea la infección por la COVID-19 a través de la inhibición de la Proteasa TMPRSS2. Estos resultados indican que la Cloroquina se dirige hacia una vía de activación viral que no está activa en las células pulmonares y es poco probable que proteja contra la propagación de la COVID-19 en y entre pacientes.
Como hemos comentado, hasta ahora, tan solo dos genes principales, dos proteínas, además de la Proteina “Sipke-S” (Spike viral S), se han asociado con la entrada del virus COVID-19 en las células epiteliales del huésped: la Enzima Convertidora de Angiotensina 2 (ACE2) y la Proteasa TMPRSS2 (Fig.2).
El tercer y ultimo aspecto que analizamos corresponde a la COVID-2 y al Cáncer de Próstata. ¿Ambas entidades están relacionadas?, ¿Existe algún vinculo entre ellas?… Recientemente han surgido datos prometedores que apuntan a un posible vínculo, mas o menos oculto, entre el Cáncer de Próstata (CaP) y la COVID-19. Montopoli y cols. (Institute of Oncology Research, Università della Svizzera Italiana. Mayo de 2020) han demostrado que los pacientes con CaP que recibieron terapia de privación de andrógenos mediante tratamiento hormonal (Terapia supresora de andrógenos o ADT: Androgenic Deprivation Therapy) tenían un riesgo menor (cuatro veces) de infectarse por la COVID-19 en comparación con los pacientes que no recibieron dicho tratamiento o incluso con los pacientes con otro tipo de cáncer (Fig.2).
Konrad H. Stopsack y cols. (Junio de 2020) analizan los posibles mecanismos subyacentes del papel protector de las terapia hormonal en el Cáncer de Próstata (Ca P) contra la COVID-19. Los autores revelan una posible relación entre los “objetivos” o “metas” de la COVID-19 en las células epiteliales del huésped, las aberraciones genéticas del Ca P, el Receptor de Andrógenos (RA) y la Proteasa TMPRSS2 (Fig.2).
Por otra parte, Montopoli y cols. han planteado la hipótesis de que los varones con la COVID-19, que tienen unos niveles más altos de andrógenos que las mujeres y una expresión (Expresión, expresa: Se refiere a la cantidad de proteínas que elabora una célula) sostenida de la Proteasa TMPRSS2, fallecen mas por la enfermedad. Pettersson y cols. han observado que estos niveles de andrógenos activan los Receptores de Andrógenos (RA) que instiga la transcripción de los genes diana, como el Antígeno Prostático Específico (PSA) y la Proteasa TMPRSS2 (Fig. 2). Por el contrario la Terapia de Deprivación Androgénica (ADT) modula negativamente la actividad de la Proteasa TMPRSS2 (Fig. 2).
Por tanto, en todo paciente con Ca P sensible a andrógenos (Que todavía el cáncer no se ha hecho resistente a las hormonas) el tratamiento estándar de primera línea sigue siendo la Terapia Supresora de Andrógenos (ADT: Androgenic Deprivation Therapy) desde 1941 hasta la actualidad. Si además el paciente con Cáncer de Próstata (Ca P) es COVID positivo, esta terapia estaría aun mas justificada por la modulación que la ADT hace sobre los niveles de andrógenos y por ende sobre la modulación negativa de la Proteasa TMPRSS2 comentada. Es decir, los bajos niveles de andrógenos (niveles de castración química o niveles indetectable) modulan la Proteasa TMPRSS2 empleando una vía similar a la del “Mesilato de Camostat” y el “Mesilato de Nafamostat comentada”. Todo esto esta respaldado por el posible papel de la sensibilidad del Receptor Androgénico (RA) a los niveles de andrógenos en sangre y por ende a la modulación positiva que estos hacen sobre la actuación de la Proteasa TMPRSS2 en relación a la entrada del virus en el interior de la célula epitelial (Fig.2).
En conjunto, estas investigaciones sugieren que existe una diafonía (Perturbación interdependiente de ambas entidades clínicas) entre COVID-19 y Ca P a nivel genético subcelular. La alta expresión (Expresión, expresa: Se refiere a la cantidad de proteínas que elabora una célula) de TMPRSS2 y su papel en la patogénesis de ambas enfermedades allana el camino para identificar nuevos enfoques terapéuticos para tratar la COVID-19, que se basan en la supresión de andrógenos y la inhibición de la Proteasa TMPRSS2. Lo que es realmente prometedor acerca de la reutilización de los tratamientos para el Ca Próstata para atacar la COVID-19 es que muchos de ellos tienen un riesgo bajo de efectos secundarios graves y, por lo tanto, pueden usarse solos o en combinación con otros posibles medicamentos reposicionados para estudiar su eficacia contra la COVID-19. En conclusión, existe una asociación potencial entre los objetivos de la COVID-19 en las células epiteliales del huésped, por un lado, y las aberraciones genéticas del cáncer de próstata y los soportes moleculares, como el Receptor Androgénico (RA) y la Proteasa TMPRSS2, por otro lado. Los fármacos antiandrogénicos y los inhibidores de la Proteasa TMPRSS2 utilizados en el cáncer de próstata “podrían”, por tanto, servir como opciones terapéuticas habituales para los pacientes con la COVID-19.
REFERENCIAS BIBLIOGRÁFICAS
- Bottcher E, Matrosovich T, Beyerle M, Klenk HD, Garten W, Matrosovich M. Proteolytic activation of influenza viruses by serine proteases TMPRSS2 and HAT from human airway epithelium. J Virol 2006; 80(19):9896–8.
- Lucas JM, True L, Hawley S, Matsumura M, Morrissey C, Vessella R, et al. The androgen-regulated type II serine protease TMPRSS2 is differentially expressed and mislocalized in prostate adenocarcinoma. J Pathol 2008; 215(2):118–25.
- Pettersson A, Lis RT, Meisner A, Flavin R, Stack EC, Fiorentino M, et al. Modification of the association between obesity and lethal prostate cancer by TMPRSS2:ERG. J Natl Cancer Inst 2013;105(24):1881–90.
- Penney KL, Pettersson A, Shui IM, Graff RE, Kraft P, Lis RT, et al. Association of Prostate Cancer Risk Variants with TMPRSS2:ERG Status: Evidence for Distinct Molecular Subtypes. Cancer Epidemiol Biomarkers Prev 2016; 25(5):745–9 .
- Konrad H. Stopsack and Lorelei Mucci. TMPRSS2 and COVID-19: Serendipity or opportunity for intervention?.Cancer Discovery 10(6):CD-20-0451. April, 2020.
- Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med 2005;11(8):875–9.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Castiñeiras Fernández, Jesús. Servicio de Urología del H.U. “Virgen Macarena”. Universidad de Sevilla. Sevilla. E-mail: uro-cast@us.es.