Original
Diferenciación epitelial in vitro de células mesenquimales troncales humanas (hCMTs) de tejido adiposo (TA) y médula ósea (MO): caracterización celular y estudio de expresión de HLA I y II
Epithelial in vitro differentiation of human mesenchymal stem cells (hMSCs) from adipose tissue (AT) and bone marrow (BM): cellular characterization and study of HLA I and II expression
Actual. Med. 2016; 101: (798): 72-78 DOI: 10.15568/am.2016.798.or02
Enviado: 30-06-2016
Revisado: 15-07-2016
Aceptado: 10-08-2016
RESUMEN
Introducción: Las células troncales mesenquimales derivadas de tejido adiposo o médula ósea constituyen uno de los tratamientos de terapia celular más utilizados en los ensayos clínicos actuales por su capacidad inmunomoduladora. Además, por su potencial de diferenciación a células epiteliales pueden ser utilizadas en ingeniería tisular incorporadas a tejidos artificiales como la piel o córnea, sustituyendo a las células epiteliales autólogas de estos tejidos. Es necesario realizar una correcta caracterización de estas células diferenciadas y estudiar el efecto de la diferenciación en la expresión del HLA de clase I y II.
Objetivos: Caracterizar y realizar los controles de calidad GMP en dos líneas de células mesenquimales troncales humanas de distintos orígenes (tejido adiposo y médula ósea) tras diferenciarlas a células epiteliales in vitro, y analizar si se modifica la expresión de los marcadores HLA I y II antes y después del proceso diferenciador.
Metodología: Se ha realizado el aislamiento y expansión de las dos líneas celulares de células mesenquimales troncales a partir del tejido fuente y se ha procedido a su diferenciación in vitro a células epiteliales mediante medios de cultivos suplementados con factores de crecimiento específico. Se han realizado controles de calidad siguiendo los requerimientos de las normas de correcta fabricación y se ha estudiado por citometría de flujo la expresión de HLA tipo I y II antes y después del proceso diferenciador. Finalmente se ha comprobado mediante estudio histológico e inmunohistoquímico las características de las células diferenciadas.
Resultados: Se han aislado dos líneas de células mesenquimales troncales de tejido adiposo y médula ósea que cumplen los controles de calidad propuestos. Tras el proceso diferenciador in vitro, las células mesenquimales troncales humanas no expresan marcadores HLA (I y II) importantes en la respuesta inmune, pero sí expresan débilmente proteínas relacionadas con los principales estratos epiteliales (CK5, CK6 y CK14).
Conclusión: La ausencia de expresión de marcadores de HLA I y II por citometría de flujo en las células diferenciadas favorecería su uso con carácter alogénico en la construcción de piel y córneas humanas por ingeniería de tejidos, sin embargo, son necesarios más estudios que confirmen estos resultados preliminares y protocolos que optimicen el proceso diferenciador in vitro de las células mesenquimales troncales.
Palabras clave: Células Mesenquimales Troncales Humanas, Diferenciación Celular, Antígenos HLA, Citrometría de Flujo, Caracterización Celular.
ABSTRACT
Background: Human mesenchymal stem cells derived from adipose tissue and bone marrow are one of the most common cell therapy procedures used in recent clinical trials due to their immunomodulation capacity. Furthermore, for their epithelial differentiation potential can be used in tissue engineering, incorporated in artificial tissues such as skin and cornea, replacing autologous epithelial cells. It is necessary to make a correct cellular characterization of differentiated cells and to study the effect in HLA I and II expression.
Objetives: Characterization and quality controls under GMP conditions of in vitro differentiated human mesenchymal stem cells from different sources (adipose tissue and bone marrow) to epithelial lineage, and study of HLA I and II expression before and after differentiation.
Methods: Isolation and expansion of two human mesenchymal stem cells lines from their tissues of origin and in vitro differentiation to epithelial cells using culture mediums supplemented with specific growth factors. Quality controls according Good Manufacturing Practices have been made and HLA I and II expression before and after differentiation have been studied. Finally, characteristics of differentiated cells have been demonstrated by histological and immunohistochemical analysis.
Results: Two human mesenchymal stem cells lines from adipose tissue and bone marrow have been isolated complying with the proposed quality controls. After in vitro differentiation, human mesenchymal stem cells do not express HLA (I and II) markers, which are important in immune response, but weakly express proteins related to main epithelial layers of human skin (CK5, CK6 and CK14).
Conclusion: The absence of expression of HLA I and II by flow cytometry in differentiated cells would promote the use of them with allogenic character to construct human skin and cornea by tissue engineering, however, more studies and protocols are required to confirm these preliminary results and to optimize in vitro differentiation of human mesenchymal stem cells.
Keywords: Regenerative Biomedicine, Human Mesenchymal Stem Cells, Cell Differentiation, HLA Antigens, Cellular Characterization.
Leer Artículo Completo
INTRODUCCIÓN
La biomedicina regenerativa es un área multidisciplinar emergente que pretende desarrollar nuevos productos o terapias que permitan reparar, sustituir o regenerar tejidos y órganos dañados de pacientes (1). La mayoría de los tratamientos que existen hasta la fecha tienen limitaciones (2,3), lo que ha puesto de manifiesto la necesidad de buscar nuevas estrategias, para lo cual se está investigando con células madre autólogas o alogénicas, de diferentes tipos (4): células madre embrionarias humanas (hESCs), células madre pluripotentes inducidas humanas (hiPSCs), y células madre adultas (ASCs), donde se incluyen las mesenquimales troncales (CMTs), las hematopoyéticas y las tejido-específicas.
Debido a los inconvenientes que conlleva el uso de hESCs y las hiPSCs (5), las ASCs, principalmente las células mesenquimales troncales (CMTs), se han convertido en la terapia más extendida, gracias a su rápida disponibilidad y probada seguridad (6). Estas son células madre multipotentes, que pueden obtenerse de diferentes tejidos como gelatina de Wharton (GW), tejido adiposo (TA) o médula ósea (MO) (7) y diferenciarse, según las condiciones o factores del medio de cultivo utilizados, a células mesodérmicas (8,9), pero también a otros linajes no mesodérmicos (7).
Actualmente, estas células se aplican en campos como el cáncer, la inmunoterapia, la ingeniería de tejidos y la regeneración tisular (7), como por ejemplo en piel y córnea (10,11). La regeneración de tejidos dañados requiere células capaces de proliferar, diferenciarse y contribuir funcionalmente al proceso regenerativo (7), por ello, el uso de hCMTs resulta esperanzador debido a las características que poseen y a su facilidad de obtención.
Tanto la piel como la córnea son dos tejidos constituidos por varias capas de células, donde la más externa sirve de barrera protectora y está constituida por células epiteliales, queratinocitos en el caso de la piel y células epiteliales limbares en el de la córnea, por lo que resulta fundamental el estudio de diferenciación de hCMTs a células de linaje epitelial.
Para que las hCMTs puedan utilizarse como medicamento o como parte de estas terapias clínicas, su producción debe desarrollarse dentro de salas blancas o de GMP (Good Manufacturing Practices), las células deben de caracterizarse de forma adecuada y someterse a múltiples controles de calidad como análisis de viabilidad celular, esterilidad, análisis de micoplasmas, endotoxinas y cariotipo.
La International Society of Cellular Therapy (ISCT) ha establecido los criterios (12) que deben de cumplir las hCMTs para su correcta caracterización y que puedan ser aprobadas como terapias avanzadas: capacidad de adherencia a plástico, la capacidad de diferenciación a adipocitos y osteocitos, la expresión de una serie de marcadores de superficie celular (CD90, CD73, CD105 y CD44) y la no expresión de otros (CD45, CD19, CD11b y HLA-DR) (13).
Dentro de estos marcadores, destacan los relacionados con el sistema HLA, un grupo de genes polimórficos que codifican para tres glicoproteínas: I, II y III, importantes en las funciones inmunológicas (14). Los HLA de clase I (A, B y C), se expresan en casi todas las células nucleadas y plaquetas y presentan péptidos intracelulares a células T citotóxicas (15), mientras que los de clase II (DR, DQ y DP) se encuentran exclusivamente en células del sistema inmune, presentando péptidos exógenos a células T helper (16).
La baja expresión de marcadores HLA tipo I y II y la ausencia de algunas moléculas co-estimuladoras como CD80, CD86 y CD40 ha favorecido su uso alogénico en diferentes patologías por su baja inmunogenicidad. Sin embargo, existe cierta controversia en la literatura sobre si el proceso de diferenciación a otras estirpes celulares favorece la expresión de marcadores HLA (15-20).
El objetivo de este estudio es aislar y caracterizar dos líneas celulares de hCMTs de distintos orígenes (TA y MO) con la realización de todos los controles de calidad GMP y en una segunda fase inducir la diferenciación epitelial in vitro mediante su cultivo con medios específicos y analizar la posible variación en la expresión de marcadores HLA clase I y II mediante citometría de flujo.
MATERIALES Y MÉTODOS
2.1. Caracterización y control de calidad de las Células Mesenquimales Troncales Humanas (hCMTs)
Se ha trabajado con dos líneas celulares de hCMTs, una derivada de tejido adiposo (TA) procedente de excedentes de muestras de la Unidad de Producción Celular e Ingeniería Tisular (UPCIT) del Complejo Hospitalario Universitario de Granada, y otra derivada de médula ósea (MO), procedente de excedentes de muestras de control de calidad que son enviadas a la UPCIT de Granada; previamente los donantes firman el consentimiento informado autorizando el uso en investigación de las células. Ambas líneas se aislaron y cultivaron en medio de células mesenquimales troncales (MCMT) (17), realizando pases celulares hasta conseguir 12 millones de células necesarias para el estudio de diferenciación.
2.1.1. Viabilidad y cuantificación celular
Cuando las hCMTs alcanzan una confluencia cercana al 100%, se retira el medio de cultivo y se lavan con PBS (1 mL/25cm2). Posteriormente, se incuban con TrypLE Select 1x (1 mL/25cm2) 5 minutos a 37ºC, 5% CO2 y 80% de humedad relativa, tras lo cual, se neutraliza con el doble de volumen de medio de cultivo. Se recogen las células en tubos de 50 mL y se centrifugan 10 minutos a 1500 rpm. Se retira el sobrenadante y se resuspende en el medio de cultivo correspondiente. Finalmente, en un eppendorf de 0,2, se diluyen las hCMTs en Trypan Blue a una proporción 1:10 (v/v), y se cargan por capilaridad en una cámara de Neubauer. que permite, con ayuda del microscopio, realizar el recuento celular.
2.1.2. Esterilidad
La esterilidad se estudia utilizando el sistema BacT/ALERT® 3D, para lo cual, al realizar un cambio de medio o pase celular dentro de la CFL, se recoge el medio en el que se encontraban las hCMTs, incubándose 1 mL en cada uno de los frascos comerciales de análisis de microorganismos anaerobios y aerobios. Estos, por su composición, permiten el crecimiento de un tipo de microorganismo, y gracias al carbón activo, neutralizan el efecto de los antibióticos que pueda haber en el medio, evitando falsos negativos.
Las muestras se mantienen 7 días en incubación, controladas por el sistema cada 10 minutos, período tras el cual, si no se observa ningún cambio colorimétrico, se aseguran las condiciones de esterilidad.
2.1.3. Análisis de Micoplasmas
En la detección por PCR del ADN de micoplasmas en el sobrenadante del MCMT, se utiliza el kit comercial Venor®GeM, validado según la Farmacopea Europea, que incluye los controles interno y positivo (ADN de Mycoplasma orale). Los cebadores del kit son específicos para una región codificante altamente conservada del ARNr 16S del genoma de Micoplasma, lo que permite la detección de varias especies.
En primer lugar, tras reconstituirse los reactivos y conservarse según las indicaciones del kit, la muestra de medio se calienta a 95ºC durante 10 minutos, se centrifuga durante 5 segundos y, se recoge el sobrenadante en un eppendorf estéril, descartando el sedimento. Al mismo tiempo, se prepara la mezcla de reacción de PCR siguiendo las instrucciones del kit y se reparten 23 µL en cada tubo de reacción, añadiendo 2 µL de muestra, 2 µL de control positivo y 2 µL de agua libre de DNA (C. Negativo) respectivamente. Estos se introducen en el termociclador con el siguiente perfil térmico: 1 ciclo a 94ºC 30 segundos, 39 ciclos de tres pasos (94ºC 30 segundos, 55ºC 30 segundos y 72ºC 30 segundos) y mantenimiento a 4ºC.
Una vez terminado el proceso, se le añaden 6 µL de Loading Dye 5x a cada uno, mezclando bien con pipeta. Finalmente, 5 µL de cada tubo y del marcador de peso molecular se cargan en los pocillos del cassette y se corren las muestras en el gel, a 275V durante 4 minutos con la luz UV encendida y la luz del laboratorio apagada.
En todos los carriles debe observarse una banda de 191 pb correspondiente al control interno, mientras que en el carril del control positivo debe observarse adicionalmente una banda de 267 pb.
2.1.4. Cariotipo
Las hCMTs se siembran en cinco Chamber Slide® (3000 células/cm2) con unos 3 mL de MCMT. Se incuban en la estufa a 37ºC, 5% CO2, cambiando el medio cada 2-3 días hasta que alcancen una confluencia del 60-70%. El día antes de proceder a la detección en metafase, se añaden 120 μL de colcemida (0,4 μg/ml), dejándolos en incubación toda la noche. Al día siguiente se desecha el medio, se lavan con 2 mL de KCl 75mM, una solución hipotónica que provoca la lisis celular y salida de cromosomas, y se incuban durante 30-35 minutos con 3 mL de KCl 75mM.
Transcurrido ese tiempo se añaden 3 mL de fijador de Carnoy (metanol y ácido acético glacial en proporción 3:1 (v/v)) y se incuban durante 3 minutos a temperatura ambiente (3X). Finalmente, se despegan los portas y se dejan secar, para posteriormente ser enviados al laboratorio de Citogenética del servicio de Análisis Clínicos del Hospital Universitario Virgen de las Nieves, donde se obtienen las bandas G mediante la tinción de Giemsa.
Para la tinción, se tratan los portas con 2 mL de tripsina al 0,05% (g/v) en PBS entre 10 y 30 segundos, se lavan con agua destilada y se tiñen con Giemsa al 5% (v/v) en agua destilada durante 15 minutos. Por último, se lavan con abundante agua y se interpretan los resultados al microscopio.
2.1.5. Diferenciación a adipocitos (ADP) y osteocitos (OST)
Se siembran 4 T25 (dos controles negativos y dos para diferenciar) a una densidad de 12.000 cél/cm2 y 4-5 mL de MCMT. Se incuban a 37ºC y 5% CO2 y se cambia de medio cada 2-3 días hasta que alcancen una confluencia del 85-90% para comenzar la diferenciación a adipocitos, y del 100% para la diferenciación a osteocitos.
Los medios de diferenciación utilizados y los protocolos establecidos tanto para la diferenciación como para la tinción con Oil Red O y Alizarin Red S, se encontraban previamente descritos (18).
2.1.6. Análisis fenotípico por citometría de flujo (CMF)
Para terminar la caracterización de las hCMTs se utiliza la CMF, utilizando anticuerpos monoclonales específicos frente a distintas proteínas de superficie, en este caso CD90, CD73, CD105 y CD 44 > 80 % y CD45, CD11b y CD19 < 20 %, además de los HLA de clase I (HLA-A, HLA-B, HLA-C) y el HLA de clase II (HLA-DR) < 20% (BD Biosciencies, San Jose, CA, USA). Este panel de anticuerpos monoclonales está establecido por el Servicio de Análisis Clínicos (Sección de Citometría/Biopatología tumoral) del Hospital Universitario Virgen de las Nieves, para identificar hCMTs, al cual se le ha incluido el HLA de clase I.
Se recogen 1 millón de hCMTs/tubo que se centrifugan 30-60 segundos a 8.000-14.000 rpm y resuspenden en 0,5 mL de PBS. El tubo se envía al Servicio de Análisis Clínicos, que prepara las siguientes combinaciones de marcadores con 7 μL de cada anticuerpo:
Tubo 1 (control isotipos): IgG1 PerCP-Cy5, IgG1 PE, IgG1 FITC y IgG1 APC
Tubo 2: CD45-FITC / CD19 PerCP-Cy5 / CD73-PE / CD90-APC
Tubo 3: HLA-DR-FITC / CD105-PE / CD11b-APC / CD44 PerCP-Cy5
Tubo 4: HLA-ABC-APC
A cada tubo se le añaden 100.000 de hCMTs, se mezclan, agitando suavemente y se incuban 30 minutos a temperatura ambiente. Después, se lavan con PBS y centrifugan 5 minutos a 1.500 rpm (2X). Por último, se resuspenden en 0,5 mL de PBS y se analizan inmediatamente, adquiriendo un mínimo de 5.000 eventos para cada tubo.
Para la interpretación de los resultados se establecen las ventanas de lectura y con el programa Infinicyt™ se analizan los histogramas determinando la expresión y porcentajes de cada uno de los marcadores.
2.2. Diferenciación in vitro de las hCMTs a células de linaje epitelial
Las hCMTs derivadas de TA y MO se mantienen en cultivo con sus correspondientes pases hasta que se obtiene una cantidad mínima de 12 millones, que se siembran en dos factorías de 1 piso (9.524 hCMTs/cm2). En este momento, las hCMTs se incuban con 100 mL/factoría de medio de diferenciación a queratinocitos (MQT), el cual está constituido, además de por DMEM, suero bovino fetal, glutamina y antibióticos (anfotericina B y gentamicina) que son componentes habituales de los medios de cultivo, por factores de crecimiento epidérmico y de queratinocitos (19) que estimulan la proliferación, debido su capacidad mitogénica, y diferenciación celular a estirpe epitelial al actuar sobre receptores específicos de superficie celular que activan los procesos de morfogénesis del epitelio y reepitelización . Con este, se mantienen entre 3 y 4 semanas hasta que adquieran una morfología esférica y formen colonias típicas de queratinocitos, cambiando el medio cada 2-3 días.
2.2.1. Análisis histológico e inmunohistoquímico de las células diferenciadas
Tras la diferenciación, las células se recuperan, cuentan y determina su viabilidad. Para realizar el estudio, se recogen en dos eppendorfs con tapón de rosca, 1 millón de hCMTs/tubo que se centrifugan 30-60 segundos a 8.000-14.000 rpm y se retira el sobrenadante dejando sólo el pellet. Un tubo se envía al Servicio de Anatomía Patología del Hospital Universitario de Granada, mientras que el otro se conserva a 4ºC por si fuese necesario repetir el experimento.
Para determinar la histología, se realiza una tinción de Hematoxilina y Eosina (H&E), mientras que para la inmunohistoquímica se estudian las siguientes proteínas: CK Multi-Pan Clon MNF116 (CK5, 6, 8 17 y 19), CK14 y vimentina (10, 20, 21).
El pellet celular se fija con formol tamponado al 4%, durante aproximadamente 12-24 horas, a continuación, con un papel muy fino, se rescata el pellet y se introduce en un cassette en el procesador de tejidos ON (el cassette pasa por formol, alcohol 100º, xilol y parafina). Al día siguiente se realiza el bloque de parafina en una estación de inclusión y se corta con un micrótomo a 2,5 micras.
Para la histología, se añade la tinción de H&E a los cristales y se deja secar 24 horas a 37ºC o 1 hora a 60ºC.
Para la inmunohistoquímica, el pellet celular embebido en parafina requiere un desenmascaramiento antigénico, que en el caso de las CK-pan, la CK14 y la vimentina se realiza con EDTA (pH 8), 20 minutos a 95ºC dentro de un módulo PT Link.
Tras esto, se bloquea con peroxidasa durante 10 minutos, se incuba otros 10 con el anticuerpo primario y lo mismo con el secundario. A continuación, se incuba con un polímero durante 15 minutos y se revela con diaminobencidina (DAB), al cual durante 2 minutos se le añade un amplificador específico. Además, se realiza una contratinción con Hematoxilina (Hx) durante 20 segundos.
Entre cada fase del proceso se lava con buffer y tras la Hx, con agua para azulearla. Finalmente se deshidrata (con alcoholes crecientes 96º-100º) y se aclara con xilol para su posterior montaje y detección.
2.2.2. Análisis fenotípico y HLA por CMF de las células diferenciadas
Se recuperan las células y la técni ca y los marcadores utilizados en este caso son iguales a lo descrito anteriormente (véase el punto 2.1.6.).
RESULTADOS
3.1. Control de calidad y caracterización de las hCMTs procedentes de TA y MO
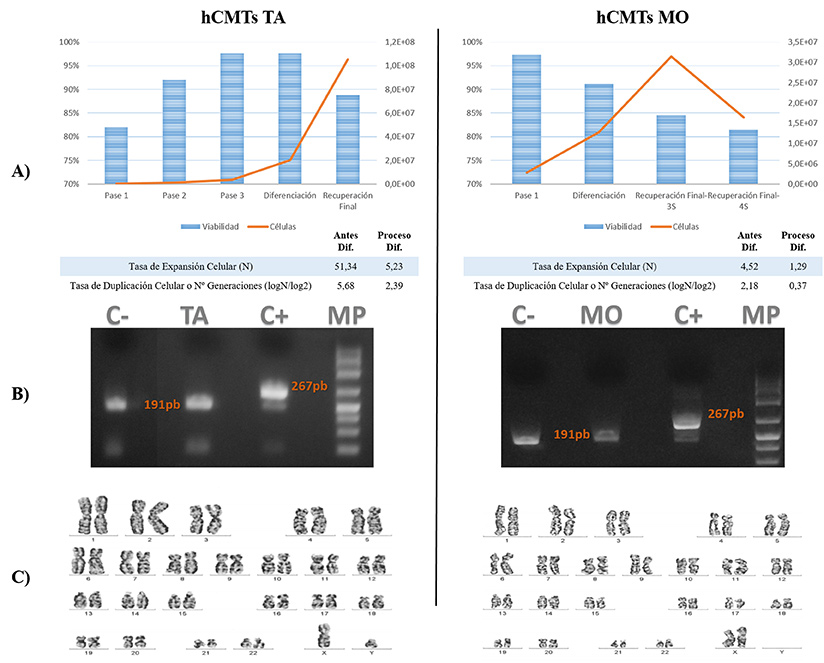
Se analizó la viabilidad de ambas líneas a lo largo de todo el proceso, que se mantuvo por encima del 80%, y en cuanto al número de células, cabe destacar la mayor velocidad proliferativa de las procedentes de MO durante la fase de expansión y una menor proliferación que las de TA tras la inducción de la diferenciación. En la figura 1a se indica además la tasa de expansión y duplicación celular. (Figura 1a). En lo referente a la esterilidad, la prueba con el sistema BacT/ALERT® 3D resultó negativa a los 7 días, igual que el análisis de micoplasmas, debido a la ausencia de las bandas características de peso molecular de micoplasmas (267 pb) (Figura 1b). Al realizar el cariotipo de ambas líneas celulares de hCMTs, se descartó la presencia de alteraciones genéticas a nivel cromosómico en ambas líneas (Figura 1c).
Figura 1. Resultados de la prueba del control de calidad de las hCMTs. A la izquierda las de Tejido Adiposo (TA) y a la derecha las de Médula Ósea (MO). A) Gráficos de viabilidad y cuantificación celular a lo largo de todo el proceso, con los valores de Tasa de Expansión y Duplicación Celular, antes y durante el proceso de diferenciación, B) Resultados de la PCR para la detección de Micoplasmas y C) Imagen del cariotipo.
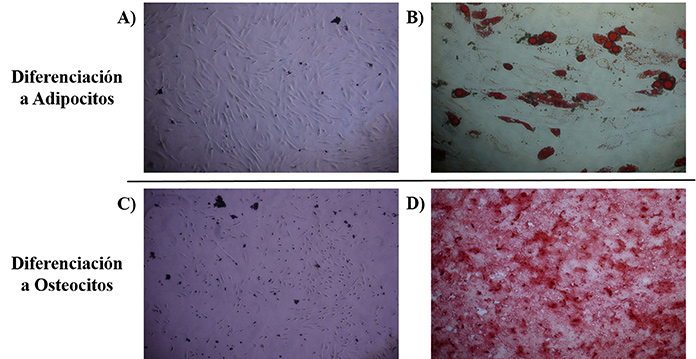
Para la caracterización de las hCMTs, ambas líneas celulares se diferenciaron a adipocitos y a osteocitos. Tras mantenerlas tres semanas con los medios de diferenciación correspondientes, se tiñeron de manera específica, con Oil Red O los adipocitos y con Alizarin Red S los osteocitos, observándose en ambos casos un color rojo característico, correspondiente a los depósitos de lípidos y calcio respectivamente, que no estaba presente en los controles (Figura 2).
Figura 2. Resultados de las pruebas de diferenciación de las hCMTs a Adipoctios y Osteocitos. A) Control negativo de diferenciación a Adipocitos, B) Prueba de diferenciación a Adipocitos, de color rojo las gotas lipídicas teñidas de Oil Red O, C) Control negativo de diferenciación a Osteocitos y D) Prueba de diferenciación a Osteocitos, de color rojo los depósitos de calcio teñidos de Alizarin Red S.
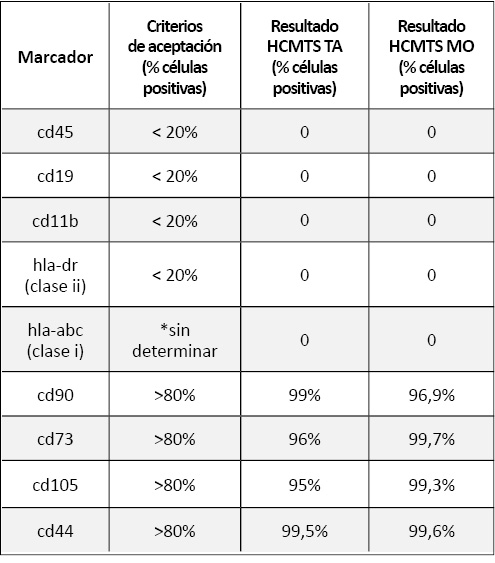
Las hCMTs se caracterizaron también mediante un análisis por citometría de flujo (CMF), con el cual se comprobó la expresión de marcadores requeridos por la Sociedad Internacional de Terapia Celular y la ausencia de expresión de los marcadores HLA de clase I y clase II (Tabla 1).
Tabla 1. Resultados de la Citometría de flujo antes de la diferenciación de las hCMTs de TA y MO y criterios de aceptación para ser consideradas como células madre. *HLA-ABC no está descrito como marcador típico de células madre pero se ha incluido para observar posibles diferencias tras el proceso de diferenciación.
3.2. Estudio de diferenciación in vitro de las hCMTs a células de linaje epitelial
Las hCMTs se diferenciaron y mantuvieron durante 3 semanas las de TA y durante 3 y 4 semanas las de MO, al observarse un proceso de diferenciación más lento. Tras ese período, se recuperaron y prepararon para su análisis histológico, inmunohistoquímico y fenotípico.
El análisis realizado demostró indicios de diferenciación de las hCMTs a células de linaje epitelial. Desde el punto de vista histológico, la tinción de H&E determinó el cambio de morfología celular con presencia de células de aspecto epitelioide, similares a los queratinocitos de la piel o las células limbares de la córnea. En el estudio inmunohistoquímico, el análisis de los marcadores de citoqueratinas (CK5, 6 y 14) y filamentos intermedios (vimentina), reveló una menor diferenciación de las hCMTs de MO a las 3 semanas (Figura 3), debido a la expresión mínima de estos marcadores. En el caso de las hCMTs de TA y MO diferenciadas a las 3 y 4 semanas respectivamente (Figura 4), se observó un leve incremento de la expresión de los marcadores.
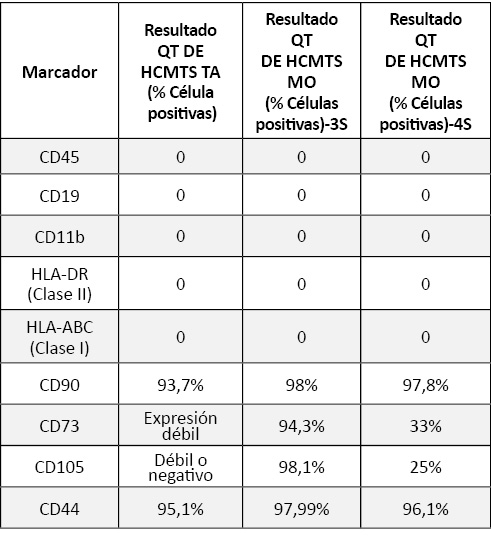
El análisis por citometría de flujo del panel de marcadores definido mostró (Tabla 2) una pérdida significativa de expresión de CD73 y CD105, sobre todo a las 3 semanas de diferenciación de las de origen de TA y a las 4 de las de MO.
3.3. Estudio de expresión de HLA I y II
La expresión de los marcadores de HLA I y II fue negativa en las células en las que se indujo la diferenciación tanto de origen de MO como de TA a las 3 y 4 semanas (Tabla 2).
Tabla 2. Resultados de la Citometría de flujo después de la diferenciación de las hCMTs de TA y MO (3 y 4 semanas).
DISCUSIÓN
La diferenciación in vitro de hCMTs de diferentes orígenes (TA y MO) a células de estirpe epitelial, durante 3 y 4 semanas es compleja como sugieren estudios previos (10,11). Los análisis histológicos e inmunohistoquímicos realizados han mostrado indicios de diferenciación epitelial como el cambio de la morfología celular y la expresión tenue de proteínas específicas epiteliales (10,20,21). El análisis por citometría de flujo de marcadores específicos para células mesenquimales ha mostrado la disminución de la expresión de algunos marcadores como CD73 y CD105 y la ausencia de expresión de los HLA I y II podría tener interesantes implicaciones en el ámbito de la regeneración tisular al facilitar el uso de células alogénicas.
La adecuada caracterización celular (26), antes de la diferenciación, acompañada de sus correspondientes controles de calidad en el contexto GMP, son requisitos necesarios imprescindible para asegurar que se está trabajando con hCMTs útiles para ensayos in vitro o in vivo.
En este estudio, los controles de calidad de las hCMTs muestran una viabilidad celular superior al 80% en todo el proceso de expansión y diferenciación, siendo menor en esta última etapa debido a que se somete a las células a un cambio crítico. En cuanto a los estudios de esterilidad y análisis de micoplasmas, ambos han resultado negativos, indicativo de que las condiciones de trabajo y mantenimiento de los cultivos es el adecuado, evitándose así el crecimiento de microorganismos que afectarían a los resultados obtenidos. Por último, el cariotipo normal de ambas líneas, descarta cualquier anomalía genética del tipo aneuploidía o euploidía, y constituye uno de los controles de calidad necesarios para el trabajo en un entorno GMP, en futuros estudios será necesario la realización de cariotipos seriados durante en el proceso de diferenciación celular.
Las hCMTs de TA y MO se adhieren fácilmente a los frascos de cultivo, perdiendo esta capacidad únicamente al final del proceso de diferenciación a células epiteliales, que no son capaces de adherirse a plástico (22). Además, las hCMTs se han diferenciado a adipocitos y osteocitos y el análisis fenotípico ha mostrado ausencia de expresión de marcadores como CD45, CD11b y CD19 y relacionados con la respuesta inmune (HLA-DR) y la expresión de otros marcadores como CD90, CD73, CD105 y CD44 (13).
Las hCMTs de TA, han mostrado indicios de diferenciación epitelial a partir de las 3 semanas tras los análisis histológicos e inmunohistoquímicos. Estas, han expresado débilmente proteínas específicas de piel (CK5, 6 y 14), implicadas en procesos de estabilidad epidérmica debido a su capacidad de unión por desmosomas y hemidesmosomas (CK5 y 14) y de migración y reepitelización (CK6) (23); y de de filamentos intermedios (vimentina) importantes en uniones celulares (desmosomas) (24); y han dejado de expresar, casi totalmente, los marcadores CD73 (ecto-5’-nucleotidasa) y CD105 (endoglina), proteínas implicadas en la proliferación y adhesión celular (25,26).
Las hCMTs de MO, han necesitado 4 semanas para mostrar indicios de diferenciación y la expresión de CD73 y CD105, no se ha visto tan reducida como en el caso de las células de TA, lo que sugiere más dificultades para la diferenciación a células epiteliales.
La inclusión de la caracterización de los HLA de clase I (HLA-A, HLA-B, HLA-C) y de clase II (HLA-DR), relacionados con la respuesta inmune, constituye un aspecto interesante de este trabajo. En las células estudiadas, tanto de TA como de MO, no se han expresado HLA de clase I y II, ni antes ni después de la diferenciación, lo que favorecería el uso de estas células de origen alógenico en constructos de piel o córnea creadas por ingeniería de tejidos. Sin embargo, merece la pena destacar que estos resultados podrían verse modificados dependiendo del estado de las hCMTs, puesto que según algunos estudios, estas pueden expresar HLA I (17,27,28) o no (29), lo cual parece que se debe al número de pases que las células han sufrido antes del análisis fenotípico, al observarse que a partir de 20 existe una expresión significativa del mismo (30), indicativo de que las características de las hCMTs varían con la edad, perdiendo plasticidad celular, con lo que habría que tenerlo en cuenta en futuros estudios.
Aunque los resultados de este estudio son interesantes, la optimización del proceso de diferenciación in vitro, el uso de marcadores inmunohistoquímicos más específicos y determinar si con el tiempo en cultivo las células modifican su perfil de expresión de HLA de clase I son algunas de las limitaciones de este trabajo.
CONCLUSIONES
La ausencia de expresión de marcadores de HLA tipo I y II en células hCMTs de TA y MO que han mostrado indicios de diferenciación epitelial in vitro, sugieren su potencial uso alogénico en tejidos creados por ingeniería de tejidos como la piel o córnea disminuiría el riesgo de rechazo, sin embargo, son necesarios más estudios a nivel preclínico para confirmar estos resultados preliminares.
AGRADECIMIENTOS
Laboratorio de Citogenética del servicio de Análisis Clínicos del Hospital Universitario Virgen de las Nieves. Servicio de Análisis Clínicos (Sección de Citometría/Biopatología tumoral) del Hospital Universitario Virgen de las Nieves.
FINANCIACIÓN PARCIAL
FIS ISC-III and FEDER PI13/02576
REFERENCIAS
- Witten CM, McFarland RD, Simek SL. Concise Review: The U.S. Food and Drug Administration and Regenerative Medicine. Stem Cells Transl Med. 2015;4(12):1495–9.
- Mao AS, Mooney DJ. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 2015;112(47):14452–9.
- Tsukamoto A, Abbot SE, Kadyk LC, DeWitt ND, Schaffer D V., Wertheim JA, et al. Challenging Regeneration to Transform Medicine. Stem Cells Transl Med. 2016;5(1):1–7.
- Heslop JA, Hammond TG, Santeramo I, Tort Piella A, Hopp I, Zhou J, et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Transl Med. 2015;4(4):389–400.
- Atala A. Regenerative medicine strategies. J Pediatr Surg. 2012;47:17–28.
- Fisher MB, Mauck RL. Tissue engineering and regenerative medicine: recent innovations and the transition to translation. Tissue Eng Part B Rev. 2013;19(1):1–13.
- Stoltz J-F, De Isla N, Li YP, Bensoussan D, Zhang L, Huselstein C, et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015;2015.
- L Ramos T, Sánchez-Abarca LI, Muntión S, Preciado S, Puig N, López-Ruano G, et al. MSC surface markers (CD44, CD73, and CD90) can identify human MSC-derived extracellular vesicles by conventional flow cytometry. Cell Commun Signal. 2016;14:2.
- Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science.1999;284(5411):143–7.
- Garzón I, Martín-Piedra MA, Alfonso-Rodríguez C, González-Andrades M, Carriel V, Martínez-Gómez C, et al. Generation of a biomimetic human artificial cornea model using Wharton’s jelly mesenchymal stem cells. Invest Ophthalmol Vis Sci. 2014;55(7):4073–83.
- Garzón I, Miyake J, González-Andrades M, Carmona R, Carda C, Sánchez-Quevedo M del C, et al. Wharton’s jelly stem cells: a novel cell source for oral mucosa and skin epithelia regeneration. Stem Cells Transl Med. 2013;2(8):625–32.
- Maleki M, Ghanbarvand F, Behvarz MR, Ejtemaei M, Ghadirkhomi E. Comparison of Mesenchymal Stem Cell Markers in Multiple Human Adult Stem Cells. Int J Stem Cells. 2014;7(2).
- Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy.2006;8(4):315–7.
- Trivedi VB, Dave AP, Dave JM, Patel BC. Human Leukocyte Antigen and Its Role in Transplantation Biology. Transplant Proc. 2007;39(3):688–93.
- Long EO, Jacobson S. Pathways of viral antigen processing and presentation to CTL: defined by the mode of virus entry? Immunol Today. 1989;10(2):45–8.
- Stern LJ, Wiley DC. Antigenic peptide binding by class I and class II histocompatibility proteins. Structure. 1994;2:245–51.
- Abumaree MH, Abomaray FM, Alshehri NA, Almutairi A, AlAskar AS, Kalionis B, et al. Phenotypic and Functional Characterization of Mesenchymal Stem/Multipotent Stromal Cells From Decidua Parietalis of Human Term Placenta. Reprod Sci. 2016; Available from: http://www.ncbi.nlm.nih.gov/pubmed/26902429
- Dauleh S, Santeramo I, Fielding 1¤ C, Ward K, Herrmann A, Murray P, et al. Characterisation of Cultured Mesothelial Cells Derived from the Murine Adult Omentum. PLoS One. 2016;11 (7).
- Shokrgozar MA, Fattahi M, Bonakdar S, Ragerdi Kashani I, Majidi M, Haghighipour N, et al. Healing potential of mesenchymal stem cells cultured on a collagen-based scaffold for skin regeneration. Iran Biomed J. 2012;16(2):68–76.
- Chavez-Munoz C, Nguyen KT, Xu W, Hong S-J, Mustoe TA, Galiano RD. Transdifferentiation of adipose-derived stem cells into keratinocyte-like cells: engineering a stratified epidermis. PLoS One. 2013;8(12):e80587.
- SundarRaj N, Rizzo JD, Anderson SC, Gesiotto JP. Expression of vimentin by rabbit corneal epithelial cells during wound repair. Cell Tissue Res. 1992;267(2):347–56.
- Llames SG, Del Rio M, Larcher F, García E, García M, Escamez MJ, et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 2004;77(3):350–5.
- Moll R, Divo M, Langbein L. The human keratins: biology and pathology. Histochem Cell Biol. Springer; 2008;129(6):705–33.
- Pérez-Sala D, Oeste CL, Martínez AE, Carrasco MJ, Garzón B, Cañada FJ. Vimentin filament organization and stress sensing depend on its single cysteine residue and zinc binding. Nat Commun. 2015;6:7287.
- Gao Z-W, Dong K, Zhang H-Z. The Roles of CD73 in Cancer. Biomed Res Int. 2014;2014.
- Nassiri F, Cusimano MD, Scheithauer BW, Rotondo F, Fazio A, Yousef GM, et al. Endoglin (CD105): a review of its role in angiogenesis and tumor diagnosis, progression and therapy. Anticancer Res. 2011;31(6):2283–90.
- Abumaree MH, Al Jumah MA, Kalionis B, Jawdat D, Al Khaldi A, AlTalabani AA, et al. Phenotypic and functional characterization of mesenchymal stem cells from chorionic villi of human term placenta. Stem Cell Rev. 2013;9(1):16–31.
- Le Blanc K, Tammik C, Rosendahl K, Zetterberg E, Ringdén O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 2003;31(10):890–6.
- Technau A, Froelich K, Hagen R, Kleinsasser N. Adipose tissue-derived stem cells show both immunogenic and immunosuppressive properties after chondrogenic differentiation. Cytotherapy. 2011;13(3):310–7.
- Shin K-S, Na K-H, Lee H-J, Kim D-G, Shin S-J, Kim JK, et al. Characterization of Fetal Tissue-derived Mesenchymal Stem Cells. Int J stem cells. 2009;2(1):51–8.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Álvaro Sierra-Sánchez. Email: alvarosisan@correo.ugr.es