Revisión
Células Madre endometriales: Aplicaciones clínicas y terapéuticas
Endometrial Stem Cells: Clinical and therapeutical applications
Actual. Med. 2017; 100: (800): 34-38 DOI: 10.15568/am.2017.800.re01
Enviado: 20-06-2016
Revisado: 02-02-2017
Aceptado: 02-02-2017
RESUMEN
Las células madre endometriales son las células madre adultas presentes en el endometrio encargadas de la regeneración del mismo tras cada menstruación. Deben tener una alta capacidad proliferativa y unas propiedades inmunológicas especiales para que cada mes el endometrio alcance el tamaño y las condiciones ideales para la implantación del óvulo fecundado y que éste no sea rechazado. Por dichas propiedades numerosos científicos están realizando investigaciones in vitro y en modelos animales para conocer mejor sus propiedades y características. Esta población de células endometriales incluye células madre mesenquimales, células madre epiteliales y las “side population cell”, y suponen una alternativa a las células madre mesenquimales provenientes de la médula ósea, a las células embrionarias y a las células madre provenientes del cordón umbilical debido a que pueden ser extraídas y aisladas de forma no invasiva y evitan conflictos éticos al tratarse de células madre adultas. Las hipotéticas aplicaciones se están dirigiendo hacia los campos de las enfermedades neurodegenerativas, terapia celular para la reparación de ciertos órganos e incluso en la creación de novedosas matrices 3D de tejidos bioartificiales mediante ingeniería tisular. Los resultados son muy prometedores y aunque se ha avanzado bastante, queda mucho trabajo e investigación por realizar para que estas hipotéticas aplicaciones lleguen algún día a la clínica. Como toda célula del organismo, las células madre endometriales son susceptibles de patología. La proliferación descontrolada fuera de la cavidad uterina se conoce como endometriosis, sin embargo ningún modelo animal ni humano ha reportado nunca esta enfermedad.
Palabras clave: Células madre endometriales, aplicaciones, endometriosis, ingeniería tisular, terapia celular, inflamación.
ABSTRACT
Endometrial stem cells are the adult stem cells present in the endometrium which are responsible of its regeneration after each menstruation. They must have a high proliferative ability and special immunological properties for the endometrium to reach every month an adequate size and the perfects conditions for implantation of the fertilized egg and avoid any rejection. Due to these properties scientifics are reporting some in vitro and in vivo research these stem cell population. The endometrial stem cells population includes mesenchymal stem cells, epithelial stem cells and side population cells, and they are an alternative to bone marrow stem cells and umbilical stem cells because of the fact that they can be obtained and isolated in a non-invasive procedure and they also avoid ethical issues due to be adult stem cells. Their potential applications are being aimed to the treatment of neurodegenerative diseases, cell therapy for repairing damaged tissues and organs and also in the creation of new 3D bioartificial organs which is part of the emerging tissue engineering. The results are really promising and although there is some available research, a long road must be crossed in order to traslate these hypothetical applications to the clinic. Endometrial stem cells, as any other cell, could undergo pathological. The uncontrolled proliferation outside the uterine cavity is known as endometriosis, however any animal or human study has never reported this.
Keywords: Endometrial stem cells, applications, endometriosis, tissue engineering, cell therapy, inflammation.
Leer Artículo Completo
INTRODUCCIÓN
Las células madre adultas son células indiferenciadas observadas en numerosos tejidos adultos. Tienen capacidad de regeneración y diferenciación en una o más líneas celulares además de alta capacidad proliferativa [1]. Junto con los mecanismos de cicatrización son las responsables de la reparación de tejidos cuando se produce una lesión. Por todo esto se le han atribuido, a través de los medios de comunicación científicos y ordinarios, grandes y ambiciosas aplicaciones terapéuticas sobre todo en los campos de la medicina regenerativa, terapia celular y la novedosa ingeniería tisular.
Las células madre pueden ser de diversos tipos: adultas, entre las que destacan: célula madre mesenquimal (MSC), célula madre hematopoyética (HSC), multipotent adult progenitor stem cell (MAPC) y embrionarias: células madre del cordón umbilical (UCBSC) y células madre embrionarias (ES)[2]. A pesar de que las células madre embrionarias tengan mayor potencialidad, presentan una serie de inconvenientes en comparación con las células madre adultas [3]:
- Son más difíciles de cultivar, al tener más necesidades que las células madre adultas.
- Las células madre embrionarias requieren más pasos hasta diferenciarse en la célula definitiva funcional.
- Las células madre embrionarias forman teratomas.
- El rechazo inmunológico es mayor con las células madre embrionarias.
- Conflictos éticos.
Sin embargo estas células madre adultas también presentan el inconveniente de ser obtenidas por procedimientos invasivos además de no presentar tasas de proliferación tan elevadas [2].
En el año 2004 Gargett y colaboradores [4] descubrieron una población de células madre adultas presentes en el endometrio. Son las células madre endometriales (EnSC) que en investigaciones posteriores han demostrado una serie de ventajas frente a las células madre adultas provenientes de la médula ósea al ser fáciles de aislar, expandirse, proliferar abundantemente, no suponer un método invasivo ni requerir anestesia [2, 5, 6]. Más recientemente se ha descrito una población con unas características muy similares a las EnSC que están presentes en la sangre menstrual, son las llamadas células madre endometriales menstruales o células regenerativas del endometrio (ERC) [1, 4, 7, 8]. Estas ERC y las anteriormente EnSC son células descritas muy reciente en la literatura científica y sus propiedades y posibles aplicaciones aún no han sido completamente investigadas.
Al tratarse de células madre su principal aplicación estará encaminada hacia la medicina regenerativa y existen numerosos artículos de ensayos y experimentación tanto en animales como en seres humanos. El objetivo de este artículo de revisión es dar a conocer las características, avances y aplicaciones terapéuticas que tienen las EnSC y las ERC en los campos de la medicina regenerativa. Al considerar la significación médica y las aplicaciones terapéuticas es necesario identificar las enfermedades en las que intervienen o pueden tener relación las EnSC y ERC. En concreto describiremos la endometriosis por ser la más prevalente y haberse demostrado que las EnSC y las ERC juegan un papel principal en su fisiopatología.
MATERIAL Y MÉTODOS
Se tuvieron en cuenta 32 artículos procedentes de la base de datos PubMed al seleccionar todos los artículos de los últimos 10 años hasta el 23/07/2016, resultantes de la búsqueda de las palabras: (“Endometrial stem cells” OR “Endometrial regenerative cells”) AND (endometriosis OR “cell therapy” OR inflammation OR “tissue engineering”[title])
CUERPO DE LA REVISIÓN
Fisiología del útero
El endometrio es un tejido dinámico a lo largo de la vida reproductiva de la mujer que alterna procesos de crecimiento y destrucción cada mes para la preparación del tejido encargado de recibir el óvulo fecundado. Mensualmente ocurren procesos de hiperproliferación y angiogénesis [1]. Esta perfecta armonía fisiológica está bajo control de las hormonas sexuales femeninas estrógenos y progesterona que provocan, entre otras acciones, la diferenciación y proliferación de las células presentes en el endometrio. Para ello resulta necesario la presencia de una población de células madre adultas las cuales no fueron aisladas con precisión hasta el año 2004[4].
Las EnSC son responsables de la regeneración del endometrio y la diferenciación hacia células más especializadas (células endometriales decidualizadas) en lo que se conoce como reacción de decidualización [4, 9]. La decidualización se define como la transformación de las células mesenquimales del endometrio a células secretoras. Se inicia en respuesta a altas concentraciones de progesterona que incrementan la concentración de AMPc en el tejido [10]. La decidualización conlleva un ambiente proinflamatorio en el útero que aumenta las interleuquinas (IL) circulantes que actúan como señal para regular el proceso de implantación. Esta respuesta inflamatoria es autolimitada y participa en el control de calidad que las células decidualizadas realizan al embrión recién implantado. El control de calidad implica la acción de numerosas quimiocinas inflamatorias, radicales libres, hormonas del estrés (cortisol) y se encarga de descartar aquellos embriones no aptos [10].
El endometrio presenta dos capas: la funcional y la basal. La primera es la que se desprende en cada ciclo y se pueden hallar células epiteliales (luminales y glandulares), estromales, endoteliales y leucocitos. En la segunda se encuentran principalmente las células progenitoras que originan la proliferación del endometrio, sin embargo éstas también se encuentran en la capa funcional pues es la que se desprende en cada periodo y en la sangre menstrual se pueden encontrar células madre adultas [9, 11].
Características de las EnSC y ERC
Las EnSC son una población de células madre que incluye tres poblaciones: Células madre mesenquimales endometriales (eMSC), células madre epiteliales y las “side population cells” (SP) [3, 7]. Estas EnSC han sido localizadas perivascularmente a las arterias del endometrio [4]. Sin embargo existe otro tipo de célula madre adulta en el endometrio. Son las células madre endoteliales, las cuales proceden a partir de las SP y no pueden ser aisladas a partir de la sangre menstrual, lo que hace indicar que esta subpoblación se encuentra únicamente en la capa basal que no se desprende y no se incluyen en la clasificación [4].
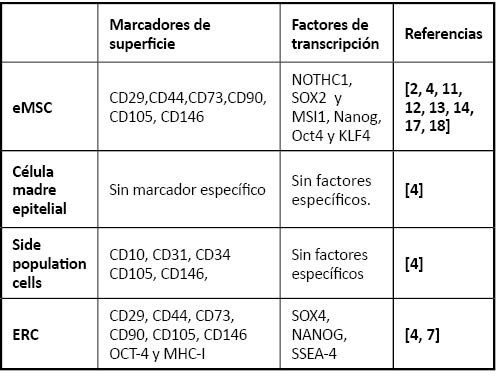
Numerosos autores han intentado definir el fenotipo y características de las EnSC: Se consideran células mesenquimales al presentar adherencia al plástico, proliferación y diferenciación en numerosas líneas celulares [4]. En lo que respecta a los marcadores moleculares por citometría de flujo, varios autores definen a las EnSC por ser: CD29+, CD44+, CD73+, CD90+, CD105+, CD146+. CD31-, CD34-, CD45-, CD133-, STRO1- [2, 4, 11, 12, 13, 14]. Es de destacar la ausencia del marcador STRO1, pues en las células mesenquimales endometriales es negativo mientras que es positivo en las células mesenquimales de la médula ósea [16]. Respecto a los factores de transcripción EnSC expresan NOTHC1, SOX2 y MSI1, Nanog, Oct4 y KLF4 [17, 18]. La reprogramación de células en células madre pluripotentes inducidas (iPS) se lleva a cabo a través de la expresión de OCT4, SOX2, KLF4 y c-myc [3]. El tener algunos de estos factores hace que las EnSC sean una fuente de células para ser reprogramadas más eficaz que el resto de células al emplear sólo 12 días en el proceso, mientras que el tiempo estándar suele ser de 4 semanas [3, 4, 7].
Las ERC por otra parte expresan CD29, CD44, CD73, CD90, CD105, CD146 OCT-4 y MHC-I manteniendo la ausencia de STRO-1 [7]. Por otra parte expresan como factores de transcripción SOX4, NANOG, SSEA-4 de forma muy variable y a veces inexistente [4].
Tabla 1: Marcadores fenotípicos y factores de transcripción de las poblaciones de células madre endometriales
Las propiedades y características que hacen a las EnSC unas células madre de elección para futuros tratamientos son:
- Facilidad de aislamiento y crecimiento, al ser obtenidas las denominadas ERC de la sangre menstrual y las EnSC de una biopsia de endometrio que no requiere anestesia [1, 2, 7, 12]
- Capacidad angiogénica[3, 4, 7, 12, 19]. Son capaces de estimular el crecimiento de vasos sanguíneos, algo que puede ser muy útil pues en ocasiones el problema de un injerto es el fracaso en el aporte sanguíneo al nuevo tejido.
- Son capaces de proliferar muy rápidamente y duplicar su población en 20 horas[7]
- Expresan telomerasa [4] y han demostrado mantener un cariotipo estable tras 40 pases [7].
- Pueden diferenciarse en multitud de tejidos como tejido neural [20, 21], hepatocitos [12], osteoblastos [1], musculo liso [4], cartílago [4], tejido muscular cardiaco[4], adipocitos [4], megacariocitos[1] y páncreas [6].
- Inducen la transformación de los macrófagos tipo I responsables de la inflamación aguda en macrófagos tipo II encargados de iniciar los procesos de regeneración y reparación [4] Además aumentan el número de linfocitos Treg [8]. Por ello se están probando las EnSC en patologías inflamatorias crónicas [3].
- La baja expresión de moléculas de HLA-II y moléculas co-estimuladoras de la respuesta inmune provoca una baja alorreactividad, lo que hace a estas células viables para un trasplante alogénico [4].
Aplicaciones en animales y humanos realizadas
En modelos animales han resultado ser útiles en la insuficiencia ovárica [22], en el reemplazo de neuronas dopaminérgicas en enfermedad de Parkinson [21]; aumentaron el número de islotes beta-pancreáticos en el páncreas de ratones con diabetes tipo I [7], mejoran la enfermedad de Duchenne en ratones al diferenciarlas en tejido muscular esquelético [4], han sido utilizadas en ratones infartados donde fueron diferenciadas a cardiomiocitos con la consecuente mejora de la función cardiaca [4], administradas de forma local su eficacia ha sido demostrada en modelos animales para enfermedades inflamatorias crónicas como esclerosis múltiple [3], encefalomielitis autoinmune [4] y colitis ulcerosa [8].
En humanos, las EnSC han sido utilizadas en un pequeño ensayo en fase I de cuatro pacientes de esclerosis múltiple donde las EnSC fueron administradas vía intravenosa e intratecal. Los resultados no muestran reacción inmunológica o efectos adversos un año después de la administración [3].
Otro estudio incluyó un paciente que padecía distrofia muscular de Duchenne. Le fueron administradas inyecciones intramusculares de EnSC. Los seguimientos realizados no reportaron efectos adverso después de tres años y pusieron de manifiesto un incremento en la fuerza muscular y una disminución de las enfermedades respiratorias [3].
Un tercer estudio usó las EnSC en un paciente con insuficiencia cardiaca congestiva, al que le fueron administradas EnSC por vía intravenosa, reveló un aumento de la fracción de eyección desde un 30% a un 40% [3].
Endometriosis
Como toda célula del organismo, las EnSC pueden ser una fuente de patología. Es el caso de patologías como endometriosis, hiperplasia de endometrio, cáncer de endometrio y adenomiosis [23]. En el presente artículo, de acuerdo con lo indicado con anterioridad nos ocuparemos de la endometriosis por ser la más frecuente y relevante ya que afecta al 6-10% de la población femenina en edad fértil [24, 25]. Se define la endometriosis como [11] “enfermedad crónica dependiente de estrógenos caracterizada por la presencia de tejido endometrial fuera de la cavidad uterina.” Aunque sea benigno prolifera en exceso, invade tejidos y puede ser causa de infertilidad [11]. Los tratamientos pueden ser quirúrgicos o médicos pero en ambos casos no son definitivos y la enfermedad recidiva, parece ser que debido a las EnSC [11, 25]. La causa de la endometriosis no está bien definida, puede ser multifactorial y se han postulado varias teorías [26]: Menstruación retrógrada, metaplasia celómica, restos embrionarios, metástasis linfoides o vasculares, o células madre.
Entre todas estas teorías destaca la menstruación retrógrada que provoca la colonización de las EnSC en el peritoneo siendo éstas responsables de las recidivas [9, 11, 23, 25, 27, 28]. Sin embargo la menstruación retrógrada afecta al 90% de la población femenina en edad fértil y sólo el 6-10% padece la enfermedad [28]. Esto se debe a que las EnSC en una paciente con endometriosis son diferentes a las que presentan pacientes sin endometriosis [15]. Se han encontrado alteraciones y sobrexpresión de OCT4, NANOG y el protoncogén c-KIT en las células madre que forman la tumoración en la endometriosis [24]. Otro artículo destaca el papel de la vía de señalización Notch1 en el origen de la enfermedad, apuntando que la infraexpresión de estos receptores mejora la enfermedad y disminuye la probabilidad de recidiva [25]. Finalmente otro estudio destaca el aumento de los marcadores de superficie CD9, CD10 y CD29 en EnSC de pacientes con endometriosis [27].
Es de destacar que, aunque son la mayoría, no todas las endometriosis se encuentran en la cavidad peritoneal. Parece ser que la endometriosis fuera de la cavidad peritoneal está causada por células madre mesenquimales provenientes de la médula ósea [11].
Futuras aplicaciones
Las EnSC son protagonistas en numerosas revistas de actualidad científica al poder ser una potente terapia para enfermedades degenerativas muy prevalentes como el Alzehimer o el Parkinson [2, 29] ya que pueden ser diferenciadas hacia tejido neural. También demuestran ser útiles en lesiones de órganos y tejidos blandos como hígado o páncreas (diabetes tipo I) sin embargo el mecanismo exacto sobre como las EnSC provocan la regeneración y reparación de los tejidos aún no está claro y sería necesario realizar más investigaciones al respecto [3].
Otra aplicación que en un futuro pueden tener las EnSC es en el campo de los tejidos artificiales dentro de la ingeniería tisular. Su facilidad de aislamiento y cultivo, su alta capacidad de proliferación, baja inmunogenicidad, capacidad angiogénica y estabilidad genómica las convierte en una fuente de células madre para completar las matrices que componen estos órganos bioartificiales mejores que las células embrionarias, umbilicales o mesenquimales [6]. Se han propuesto matrices de hidrogeles de fibrina para la reparación de nervios periféricos, donde las EnSC fueron diferenciadas con éxito hasta células de Schwann [30], matrices tridimensionales de tejido óseo para dichas lesiones [31] y una matriz tridimensional de una vejiga al ser diferenciadas en músculo liso [32]. Se ha propuesto también crear una matriz en 3D que contenga EnSC diferenciadas en células de los islotes beta pancreáticos para poder trasplantarlos directamente y así tratar la diabetes mellitus I [6].
Numerosos autores destacan el riesgo teórico de endometriosis que existe al usar las EnSC, sin embargo ningún modelo animal ni humano ha reportado esto [3], ya que tal y como se comentaba en el apartado anterior para que se diera dicha enfermedad es necesario la presencia de ciertas alteraciones en las células puesto que las EnSC de la endometriosis y las EnSC de una mujer sana no son iguales [15].
CONCLUSIONES
En su corto tiempo desde su descubrimiento las EnSC, por sus resultados in vitro y en modelos humanos y animales, han demostrado tener un enorme potencial en la regeneración y reparación de ciertas lesiones óseas, intestinales, de nervios periféricos, neurodegenerativas o de partes blandas. En el futuro desarrollo de órganos artificiales que plantea la ingeniería tisular las EnSC serían unas candidatas ideales para poblar las distintas matrices con las que son construidos.
En relación a la endometriosis es necesario seguir investigando y determinar los cambios que llevan a las EnSC a proliferar de forma anómala, así como aportar mayor cantidad de evidencia sobre si los tratamientos con EnSC podrían llegar a provocar una endometriosis iatrogénica en el órgano dañado.
Los resultados alcanzados hasta este momento indican la necesidad de investigar más sobre esta población de células pues sus mecanismos de reparación y regeneración así como su papel en la regulación de la respuesta inmune dentro del propio cuerpo aún siguen constituyendo una incógnita. Para que estas teóricas aplicaciones llegasen algún día a la clínica sería necesario conocer perfectamente dichos mecanismos.
REFERENCIAS
- Ghobadi F, Mehrabani D, Mehrabani G. Regenerative Potential of Endometrial Stem Cells: A Mini Review. World J Plast Surg. 2015;4(1): 3–8.
- Mobarakeh ZT, Ai J, Yazdani F et al. (2012) Human endometrial stem cells as a new source for programming to neural cells. Cell Biol. Int. Rep. 19(1):art:e00015.doi:10.1042/CBR20110009
- Verdi J, Tan A, Shoae-Hassani A, Seifalian AM. Endometrial stem cells in regenerative medicine. J Biol Eng, 2014;8:20
- Gargett CE, Schwab KE, Deane JA. Endometrial stem/progenitor cells: the first 10 years. Hum Reprod Update 2016; 22 pp. 137–163
- Pal L. Uterine stem cells—promise and possibilities. Maturitas, 2015 Nov;82(3):282-3. doi: 10.1016/j.maturitas.2015.07.018.
- Niknamasl A, Ostad SN, Soleimani M, et al. A new approach for pancreatic tissue engineering: human endometrial stem cells encapsulated in fibrin gel can differentiate to pancreatic islet beta-cell. Cell Biol Int. 2014 Oct;38(10):1174-82
- Xu Y, Zhu H, Zhao D, Tan J. Endometrial stem cells: clinical application and pathological roles. Int J Clin Exp Med 2015;8(12):22039-22044
- Lv Y, Xu X, Zhang B et al. Endometrial regenerative cells as a novel cell therapy attenuate experimental colitis in mice. J Transl Med 2014;12:344.
- Marin Figueira PG, Abrao MS, Krikun G, Taylor H. Stem cells in endometrium and their role in the pathogenesis of endometriosis. Ann. N.Y. Acad. Sci.2011;1221:10–17.
- Lucas ES, Salker MS, Brosens JJ . Uterine plasticity and reproductive fitness. Reprod BioMed Online 2013 Dec;27(6):664-72. doi: 10.1016/j.rbmo.2013.10.003. Epub 2013 Oct 12.
- G. Pittatore, A. Moggio, C. Benedetto, B. Bussolati, and A. Revelli. Endometrial Adult/Progenitor Stem Cells: Pathogenetic Theory and New Antiangiogenic Approach for Endometriosis Therapy. Reprod Sci 2014; 21(3):296-304
- Khademi F, Soleimani M, Verdi J, et al. Human endometrial stem cells differentiation into functional hepatocyte-like cells. Cell Biol Int. 2014; 38:825–834
- Noureddini M, Verdi J, Mortazavi-Tabatabaei SA et al. Human endometrial stem cell neurogenesis in response to NGF and bFGF. Cell Biol. Int. 2012;36:961–966
- Verdi J, Sharif S, Banafshe HR, Shoae-Hassani A. Sertraline increases the survival of retinoic acid induced neuronal cells but not glial cells from human mesenchymal stem cells. Cell Biol Int. 2014;38:901–909
- Nikoo S, Ebtekar M, Jeddi-Tehrani M, et al. Menstrual blood-derived stromal stem cells from women with and without endometriosis reveal different phenotypic and functional characteristics. Mol Hum Reprod 2014;20(9):905–918
- Wang H, Jin P, Sabatino M, et al. Comparison of endometrial regenerative cells and bone marrow stromal cells. J Transl Med 2012;10:207-221
- Mohseni R, Shoae-Hassani A, Verdi J. Reprogramming of endometrial adult stromal cells in the presence of a ROCK inhibitor, thiazovivin, could obtain more efficient iPSCs. Cell Biol Int. 2015;39:515–518.
- A. N. Schüring, J. Braun, S. Wüllner, L. Kiesel, M. Götte. mRNA-Expression of ERα, ERβ, and PR in Clonal Stem Cell Cultures Obtained from Human Endometrial Biopsies. ScientificWorldJournal. 2011;11:1762-9. doi: 10.1100/2011/949823.
- Masuda H, Matsuzaki Y, Hiratsu E et al. Stem Cell-Like Properties of the Endometrial Side Population: Implication in Endometrial Regeneration. PLoS One, 2010 28;5(4)
- Bayat N, Ebrahimi-Barough S, Ardakan MM et al. Differentiation of Human Endometrial Stem Cells into Schwann Cells in Fibrin Hydrogel as 3D Culture. Mol Neurobiol (2015).
- Navaei-Nigjeh M, Amoabedini G, Noroozi Aet al. Enhancing neuronal growth from human endometrial stem cells derived neuron-like cells in three-dimensional fibrin gel for nerve tissue engineering. J Biomed Mater Res A. 2014;102(8)
- Liu T, Huang Y, Zhang J et al. Transplantation of Human Menstrual Blood Stem Cells to Treat Premature Ovarian Failure in Mouse Model. Stem Cells Dev. 2014;23(13).
- C.E.Gargett . Uterine stem cells: What is the evidence?. Hum Reprod Update 2007;13(1): 87–101
- Fraunhoffer NA , Meilerman Abuelafia A, Stella I, Galliano S, Barrios M, Vitullo AD. Identification of germ cell-specific VASA and IFITM3 proteins in human ovarían endometriosis. J Ovarian Res 2015;8:66
- He H, Liu R, Xiong W, Pu D, Wang S, Li T. Lentiviral vector-mediated down-regulation of Notch1 in endometrial stem cells results in proliferation and migration in endometriosis. Mol Cel Endocrinol 2016;436:210-218
- Sassona IE, Taylor HS. Stem Cells and the Pathogenesis of Endometriosis. Ann N Y Acad Sci. 2008 ;1127:106–115
- Nikoo S, Ebtekar M, Jeddi-Tehrani M et al. Menstrual blood-derived stromal stem cells from women with and without endometriosis reveal different phenotypic and functional characteristics. Mol Hum Reprod 2014;20(9):905–918
- O DF, Roskams T, Van den Eynde K et al. The Presence of Endometrial Cells in Peritoneal Fluid of Women With and Without Endometriosis. Reprod Sci. 2016. 10.1177/1933719116653677
- Shoae-Hassani A, Mortazavi-Tabatabaei SA, Shari S, Rezaei-Khaligh H, Verdi J. DHEA provides a microenvironment for endometrial stem cells neurogenesis. Med Hypotheses 2011;76:843–846
- Bayat N, Ebrahimi-Barough S, Ardakan MM et al. Differentiation of Human Endometrial Stem Cells into Schwann Cells in Fibrin Hydrogel as 3D Culture. Mol Neurobiol, 2015. doi:10.1007/s12035-015-9574-7
- Alizadeh A, Moztarzadeh F, Ostad SN, Azami M, Geramizadeh B, Hatam G. Synthesis of calcium phosphate-zirconia scaffold and human endometrial adult stem cells for bone tissue engineering Artif Cells Nanomed Biotechnol. 2016;44(1):66-73
- Shoae-Hassani A, Sharif S, Seifalian AM, Mortazavi-Tabatabaei SA, Rezaie S, Verdi J. Endometrial stem cell differentiation into smooth muscle cell: a novel approach for bladder tissue engineering in women. BJU Int. 2013; 112(6):854-63
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Gonzalo Lendínez Sánchez. Facultad de Medicina de la Universidad de Granada. Alumno interno departamento de inmunología de la Universidad de Granada. Dirección: Calle del Pintor Miguel Ayala, número 2, 4º izquierda Jaén 23007. e-mail: gonlensa@hotmail.com