Caso Clínico
Linfoma plasmablástico con coinfección por Virus de Epstein Barr y Herpes Virus humano 8: reporte de caso
PLasmablastic lymphoma with coinfection by Epstein Barr Virus and Herpes Human Virus 8: a case report
Actual. Med. 2019; 104: (808): 188-190 DOI: 10.15568/am.2019.808.cc03
Enviado: 23-07-2018
Revisado: 08-10-2018
Aceptado: 07-03-2019
RESUMEN
El linfoma plasmablástico es una neoplasia agresiva poco frecuente. Se categoriza según la clasificación del 2016 de la OMS como una neoplasia linfoide del tipo del linfoma plasmablástico, que lo define como una proliferación difusa de células grandes neoplásicas semejantes a inmunoblastos B, en la cual las células tumorales presentan inmunofenotipo de células plasmáticas con positividad para CD138, CD38 y MUM-1, siendo negativas o débilmente positivas para CD45, CD20 y PAX-5. Tienen expresión de inmunoglobulinas plasmáticas en hasta 70% de los casos, sobre todo IgG, así como de cadenas ligeras kappa o lambda. La mayoría de los casos tienen relación con el virus Epstein-Barr. Presenta un claro predominio por el sexo masculino, y típicamente se asocia a estados de inmunodeficiencia, sobre todo al VIH. En estos pacientes, la media de edad de presentación es de 40 años y la cavidad oral suele ser la más afectada.
Palabras clave: Linfoma plasmablástico; Infección por VIH; Virus Esptein Barr; Virus herpes humano 8.
ABSTRACT
Plasmablastic lymphoma is a rare aggressive neoplasm. It is categorized according to the 2016 WHO classification as a lymphoid neoplasm of the type of plasmablastic lymphoma, which defines it as a diffuse proliferation of large neoplastic cells similar to B-immunoblasts, in which the tumor cells have immunophenotype of plasma cells with positivity for CD138, CD38 and MUM-1, being negative or weakly positive for CD45, CD20 and PAX-5. They have plasma immunoglobulin expression in up to 70% of cases, especially IgG, as well as kappa or lambda light chains. The majority of cases are related to the Epstein-Barr virus. It presents a clear predominance by the male sex, and is typically associated with immunodeficiency states, especially HIV. In these patients, the average age of presentation is 40 years and the oral cavity is usually the most affected.
Keywords: Plasmablastic lymphoma; HIV infection; Epstein Barr virus; Human Herpes Virus 8.
Leer Artículo Completo
INTRODUCCIÓN
El linfoma plasmablástico (LPB) está categorizado como un subtipo muy agresivo y poco común de linfoma no Hodgkin por la Organización Mundial de la Salud (1). Su primera descripción fue realizada por Delecluse y sus colaboradores en el año de 1997 (2). Originalmente se pensó que solo se presentaba en pacientes infectados con el virus de inmunodeficiencia humana (VIH), pero desde se descripción se han identificado que hasta 35% de los casos se presentan en pacientes con otro tipo de inmunodeficiencias o en inmunocompetentes (3).
Se calcula que este linfoma es responsable de 2 a 3 % de todos los linfomas asociados a VIH aunque la incidencia no es tan clara. La edad de presentación es menor en pacientes VIH positivo, 40 años, que en pacientes sin la infección, 58 años. Este linfoma es más prevalente en pacientes masculinos aunque esta diferencia es más marcada en pacientes VIH-postivos, 4:1 vs. 1.6 :1 en VIH-negativos (4).
Las células que caracterizan a este linfoma son grandes, redondas u ovaladas, con citoplasma abundante, núcleo excéntrico y nucléolo prominente; estas crecen en proliferaciones monomórficas cuyo fondo tiene aspecto de “cielo estrellado” debido a la presencia de linfocitos, macrófagos, cuerpos de mitosis y apoptosis (5).
Al analizar el inmunofenotipo de estas células, se encuentran negativo los marcadores tradicionales de las células B como CD20, CD79a y PAX-5 mientras que los marcadores de células plasmáticas como CD38, CD138 y MUM1/IRF4 son positivos.
Debido a esto, debe de diferenciarse de otros desórdenes linfoproliferativos como mieloma plasmablástico, linfoma difuso de células B grandes anaplásico cinasa positivo, enfermedad de Castleman multicéntrica, entre otras (6).
Existe una asociación entre el virus Epstein-Barr (VEB) y el linfoma plasmablástico, el RNA de éste se encuentra en 80% de los paciente VIH positivos, en dos tercios de los pacientes trasplantados y en 46% de los pacientes VIH negativos (7).
El cuadro clínico depende del sitio afectado, causando síntomas como diarrea, hematoquesia y dolor abdominal cuando afecta el tracto gastrointestinal; epistaxis, rinorrea, sinusitis, úlceras orales cuando afecta mucosa nasal y oral; así como adenopatías y síntomas B.
Clínicamente se encuentra en un estadio avanzado (Estadio de Ann Arbor III o IV) en 60% de los pacientes al momento del diagnóstico independientemente de la presencia o ausencia de VIH, sin embargo, la presencia de enfermedad en la cavidad oral y mandíbula es más común en pacientes infectados. La médula ósea está afectada en 30% de los pacientes al momento del diagnóstico (8).
Los sitios extranodales en los que más se presenta son tracto gastrointestinal, hueso y piel aunque también se puede encontrar en sitios santuario como los testículos o el sistema nervioso central.
El pronóstico es malo ya que la sobreviva promedio es de 8 meses independientemente de la presencia de VIH. El único factor de mal pronóstico reconocido hasta el momento es la presencia de rearreglos en el gen MYC (9).
Los régimenes de quimioterapia usados actualmente son ciclofosfamida hiperfraccionada, vincristina, doxorubicina y dexametasona alternando con metotrexato y citarabina. También se pueden utilizar agentes como bortezomib y lenalidomide que son de utilidad en mielomas de células plasmáticas. Se caracteriza por recaída temprana y posterior resistencia a quimioterapia (10).
CASO CLÍNICO
Masculino de 34 años de edad con antecedente de infección por Virus de Inmunodeficiencia Humana (VIH) clasificación clínica e inmunológica C3, CD4 186/mm3 (500 – 1500 /mm3 ) y Carga viral indetectable, en tratamiento con Efavirenz/Emtricitabina/Tenofovir (600/200/300 mg por día) y Trimetoprim/Sulfametoxazol (160/800 mg por día) y sin otros antecedentes personales patológicos, con cuadro clínico de 5 meses de evolución caracterizado por cefalea parietal derecha en EVA (Escala Visual Análoga) 8/10, tipo punzante, con irradiación a región frontal ipsilateral y occipital, acompañándose de déficit auditivo, así como visión borrosa, además de fiebre cuantificada de 38.5 ºC, pérdida de peso involuntaria de 10 kilogramos en los últimos 5 meses, astenia y adinamia, con posterior aparición de tumoración a nivel de cráneo.
A su ingreso a la unidad de urgencias se encontró con signos vitales dentro de los parámetros normales, con laboratorios que integraban una hipercalcemia, Ca+2 15.2 mg/dL, (8.5 – 10 mg/dL) y una Deshidrogenasa láctica (DHL) de 1992 UI/L (125 – 240 UI/L). A la exploración física se observó, consciente, orientado, con tumoración en región temporo-parietal-occipital de 20x20cm, pétrea, no móvil, fija a planos profundos, cavidad oral sin presencia de lesiones, adenopatía cervical derecha de 2×2 cm en región IV y V del lado derecho.
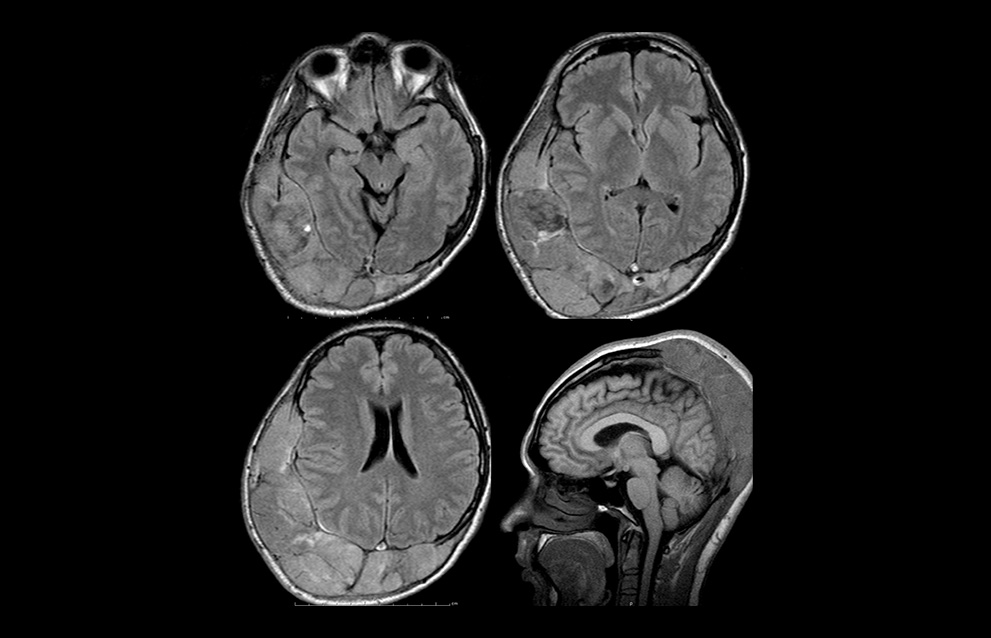
Dentro de los estudios de imagen se realizaron, radiografía de cráneo, que reveló pérdida de la arquitectura de hueso a nivel temporal, parietal y occipital, así como resonancia magnética nuclear con evidencia de tumor extra-axial en región fronto-parieto-temporo-occipital derecha que infiltraba estructuras adyacentes, que condicionó una herniación subfalcina y carcinomatosis leptomeníngea (Figura 1). PET-CT (Tomografía de emisión de positrones – Tomografía computada) con Fluorodesoxiglucosa con evidencia de actividad tumoral hipermetabolica a nivel de lesión extraaxial descrita, antro maxilar derecho y adenopatias cervicales.
Figura 1. Resonancia magnética nuclear: tumor extra-axial en región frontoparietotemporo-occipital derecha que infiltraba estructuras adyacentes, que condicionó una herniación subfalcina y carcinomatosis leptomeníngea
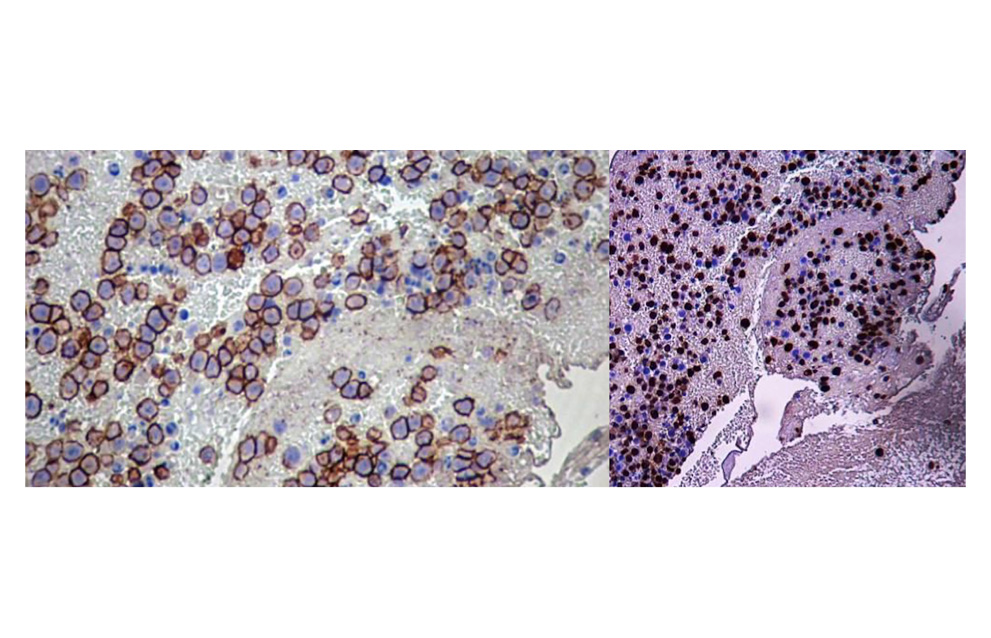
Por tal motivo se decidió realizar biopsia de tumor parieto-temporo-occipital, compatible con Linfoma plasmablástico con coinfección por virus de Epstein barr y Herpes virus humano 8. Inmunohistoquímica, Positivo: CD138, EBER-ISH, HHV8 y Ki67(90%), Kappa ++, lambda +, Negativo: CD20, EMA, CD30 y PAX5 y positivo CD3 en linfocitos T reactivos (Figura 2).
Figura 2. Inmunohistoquímica: Positivo CD138, EBER-ISH, HHV8 y Ki67(90%)
En biopsia de hueso, se reportó hipocelular para la edad (30%), relación mieloide-eritroide 2:1, con adecuada maduración y morfología de las tres series hematopoyéticas, hasta 4 megacariocitos por campos de gran poder, sin evidencia de infiltración neoplásica. Con CD138 positivo en 3% de células plasmáticas.
El paciente fue tratado con fluidoterapia y ácido zolendrónico para control de hipercalcemia, se propuso inicio de tratamiento con radioterapia (RT), con dosis de 30Gy/15Fx, posterior a 5 sesiones de RT, se encontró con mejoría en los niveles de calcio (8.52mg/dL) se egresó del hospital para completar sesiones de RT de manera ambulatoria. Cursó con candidiasis oral y radioepitelitis a cráneo grado 1, mostrándose reducción de la lesión >70%. Posteriormente se decidió inicio de esquema de quimioterapia con DA-EPOCH alternado con DA MTX, aplicándose tres ciclos con mejoría de su sintomatología.
DISCUSIÓN Y CONCLUSIÓN
El linfoma plasmablástico es un desafío diagnóstico, con un tratamiento agresivo y un mal pronóstico. Este debe hacerse en relación con los hallazgos clínicos (datos de inmunodeficiencia, relación con VIH y virus de Epstein-Barr) y el inmunofenotipo. El riesgo relativo de desarrollar este tipo de linfoma en pacientes con virus de inmunodeficiencia humana positivo es de 80 a 110 veces mayor que en la población general. Los linfomas en sujetos VIH positivos también se han asociado fuertemente con infección por otros virus, lo que sugiere un papel importante de estos en la patogenia de los linfomas. El algoritmo diagnóstico de los linfomas con diferenciación plasmáblástica es amplio (mieloma plasmablástico, Linfoma B difuso variante inmunoblástica, Linfoma difuso ALK +) por lo que es imprescindible realizar un estudio clínico y de inmunohistoquímica amplio.
Es un tumor altamente agresivo con pobre respuesta a la quimioterapia y con una supervivencia media muy baja, la mayoría de los pacientes fallecen dentro del primer año tras el diagnóstico. Estos tumores fueron designados como plasmablásticos por estar constituidos por células grandes y blásticas que mostraban un perfil fenotípico de células plasmáticas diferenciadas, con ausencia o débil expresión de marcadores de células B.
En la actualidad, cada vez se han descrito más LPB tipo cavidad oral en una localización extra-oral, en un 52%. La mayoría de los pacientes son VIH positivos y están infectados por el virus de Epstein Barr (74%). El HHV-8 es negativo en todos sus casos.
El diagnóstico diferencial debe hacerse con linfomas B de células grandes con rasgos plasmablásticos. Aunque todos estos linfomas tienen una morfología blástica y un fenotipo de célula B diferenciada terminal, la presentación clínica, el estado inmunológico y los rasgos morfológicos e inmunofenotípicos nos permitirán hacer el diagnóstico correcto.
El linfoma no Hodgkin constituye la segunda neoplasia más frecuente en pacientes VIH positivo. Es criterio definidor de SIDA. La incidencia de linfomas en SIDA es más de 100 veces superior a la incidencia en la población general y el riesgo no parece haberse reducido con la introducción de la terapia antirretroviral combinada El 90% son linfomas B y la mitad contienen el virus de Epstein-Barr.
Este caso presentado es un linfoma plasmablástico en un paciente VIH-positivo y de presentación clínica poco habitual.
REFERENCIAS BIBLIOGRÁFICAS
- Ahn J, Okal R, Vos J, Smolkin M, Kanate A, Rosado F. Plasmablastic lymphoma versus plasmablastic myeloma: an ongoing diagnostic dilemma. J Clin Pathol 2017; 70:775-780.
- Al-Malki M, Castillo J, Sloan J, Re A. Hematopoietic cell transplantation for plasmablastic lymphoma: a review. Biol Blood Marrow Transplant 2014; 20: 1877-1884.
- Castillo J, Bibas M, Miranda R. The biology and treatment of plasmablastic lymphoma. Blood 2015; 125: 2323-2330.
- Fernández R, Sancho J, Ribera J. Plasmablastic lymphoma. Med Clin 2016; 147:399-404.
- Bautista M, Ake C, Chen M, Wang J. Gastrointestinal lymphomas: Morphology, immunophenotype and molecular features. J Gastrointest Oncol 2012; 3:209-225.
- Xiao H, Minghui D, Lixing H, Daobin Z, Zhang A. Plasmablastic lymphoma: Review of 60 Chinese cases and prognosis analysis. Medicine 2017; 96: 1-5.
- Harmon C, Smith L. Plasmablastic Lymphoma: A Review of Clinicopathologic Features and Differential Diagnosis. Arch Pathol Lab Med 2016; 140:1074–1078.
- Loghavi S, Khaled A, Tariq N, Zhuang Z, Siok-Bian N, Tang G. Stage, age, and EBV status impact outcomes of plasmablastic lymphoma patients: a clinicopathologic analysis of 61 patients. J Hematol Oncol 2015; 8:65-70.
- Covens K, Verbinnen B, Geukens N. Characterization of proposed human B-1 cells reveals pre-plasmablast phenotype. Blood 2013; 121:5176–5183.
- Yan M, Dong Z, Zhao F, Chauncey T, Deauna D, Wang J et al. CD20-positive plasmablastic lymphoma with excellent response to bortezomib combined with rituximab. Eur J Haematol 2014; 93: 77-80.
INFORMACIÓN SOBRE EL ARTÍCULO
Autor para la correspondencia: Juan Daniel Díaz García. Calzada de Tlalpan 4800, Tlalpan Centro I, Belisario Domínguez Secc 16, 14080 Tlalpan, Ciudad de México. E-mail: judan_digar@hotmail.com