Caso Clínico
Sobre la legislación en Terapia Celular. A propósito de un caso clínico
Regarding of legislation on Cellular Therapy. A case report
Actual Med. 2020; 105(811): 240-243 DOI: 10.15568/am.2020.811.cc06
Recibido: 17/06/2020
Revisado: 19/06/2020
Aceptado: 23/07/2020
Resumen
Guiándose por el caso de una paciente sometida a tratamiento intrarticular con un producto celular no caracterizado del que se derivaron complicaciones, este artículo trata sobre aspectos novedosos de la legislación en «Terapia Celular». Procura alertar al colectivo médico que pudiera actuar fuera de la regulación que concierne a las terapias avanzadas, poniéndose en riesgo de actuaciones iatrógenas y procesos litigantes consecuentes. La expansión comercial de dispositivos que ofrecen productos celulares omitiendo el control de la Administración Sanitaria, aconseja extremar la atención a estos aspectos legislativos.
Palabras clave: Terapia Celular; Terapias Avanzadas; Legislación.
Abstract
This manuscript is centered on novel aspects of the legislation on “Cell Therapy” through the case of a patient who underwent intrarticular treatment with an uncharacterized cellular product from which complications arose. It aims to alert the medical community that could act outside the regulations concerning advanced therapies, implying a risk of iatrogenic actions and consequent litigation processes. The commercial expansion of devices that offer cellular products without the control of the Health Administration makes it advisable to pay extreme attention to these legislative aspects.
Keywords: Cell Therapy; Advanced Therapies; Legislation.
Leer Artículo Completo
INTRODUCCIÓN
La Terapia Celular está experimentando un crecimiento exponencial en muchos campos de la Medicina (1). El presente artículo pretende complementar la información aportada en la «Carta al Editor» firmada por Blanca Ruiz de Almirón en el nº808 de diciembre 2019 en la que se expuso el marco científico y legislativo en que debe desarrollarse (2). Mediante la exposición de un caso clínico de una paciente sometida a tratamiento con un producto celular no caracterizado del que se derivaron complicaciones, se procura advertir al colectivo médico que pudiera actuar fuera de esta regulación, poniéndose en riesgo de actuaciones iatrógenas y procesos litigantes. Se considera de especial interés insistir en la divulgación de estos conceptos ante la profusa oferta de dispositivos que, pretendiendo eximirse del control de las autoridades sanitarias, aseguran obtener productos celulares seguros y con potencial terapéutico.
CASO CLÍNICO
Mujer de 74 años acudió mostrando ostensible discapacidad a la marcha y ayudándose con bastones. Bajo el diagnóstico de artrosis subastragalina del pie izquierdo, había sido tratada dos meses antes mediante una infiltración intraarticular de 2 ml de un producto, que el facultativo denominó «células madre», elaborado a partir de una muestra de sangre periférica sometida durante 3 o 4 días a un procedimiento desconocido de laboratorio. El informe describió este producto como un «Cóctel de moléculas biológicamente activas purificadas aisladas de plaquetas y células hemáticas nucleadas pre-cultivadas con propiedades antiinflamatorias y regenerativas». La paciente refirió que, transcurridas 2 horas de la infiltración, sufrió un cuadro flogótico local de gran intensidad extendido al dorso de todo el pie obligando a mantener 15 días de reposo absoluto. Fue tratada mediante frío local y antiinflamatorios convencionales por vía oral. Siguió evolución tórpida durante los dos meses siguientes.
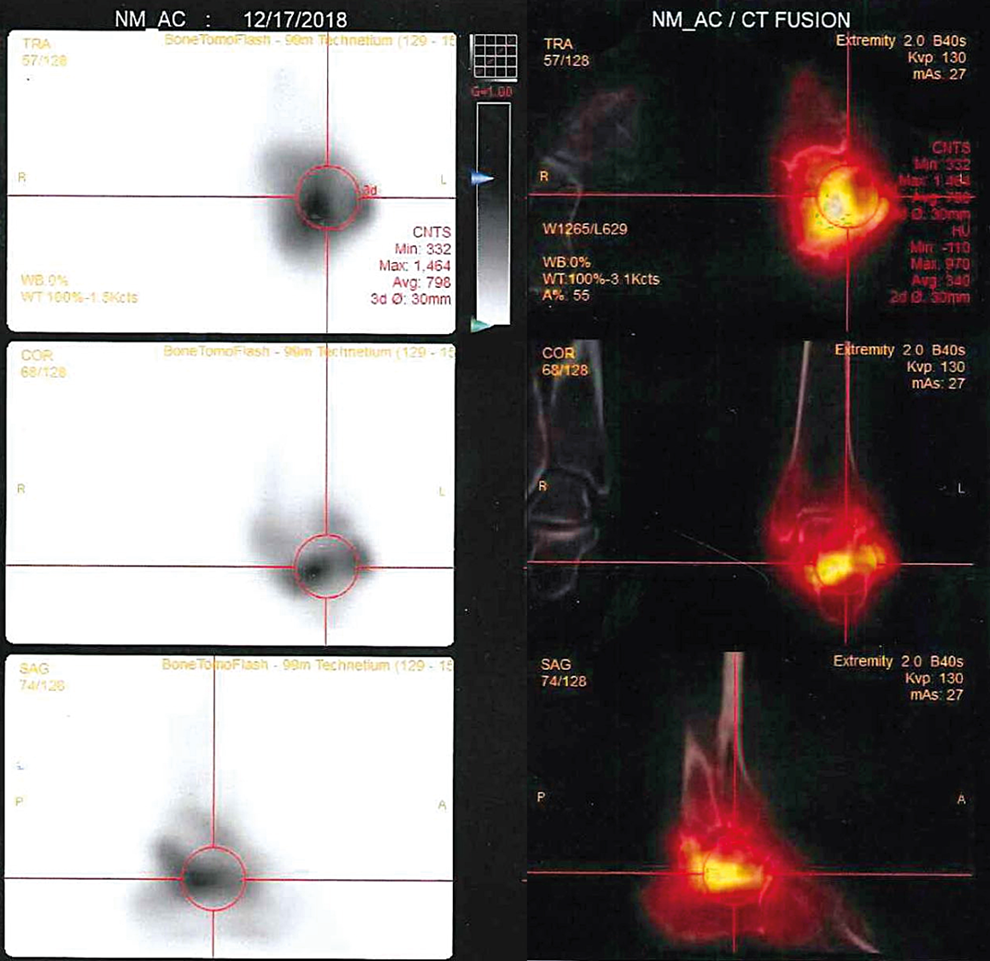
Tras comprobar la permanencia de estos signos ostensibles y descartar conflicto vascular se solicitaron exploraciones analíticas y de imagen. Los valores de laboratorio resultaron dentro de la normalidad, salvo linfocitosis de 50,5% (VN: 20-45%) con discreta neutropenia dentro de un recuento leucocitario normal y una PCR de 5,3 mg/l (VN <5). Las imágenes de RMN evidenciaron artrosis severa astragalocalcánea con derrame articular y el estudio gammagráfíco con leucocitos marcados mostró una extensa hipercaptación informada como «severa osteoartritis probablemente séptica en articulación subastragalina izquierda» (Imagen 1). Mediante abordaje abierto se drenó liquido sinovial de características inflamatorias y tomaron muestras para Gram y cultivo que resultaron ser negativas. Se administró durante 5 días Cefazolina 2gr/8h, Linezolid 600mg/12h. Al alta hospitalaria siguió tratamiento con Septrin 1c/12h durante 5 días más. La hipercaptación leucocitaria en la gammagrafía se consideró «falso positivo» y el proceso se diagnosticó de «osteoartritis subastragalina aséptica» como reacción secundaria a producto celular no caracterizado.
Figura 1. Gammagrafía ósea de tobillo izquierdo; art. subastragalina. SPECT/CT Fusión: La intensidad del grado de captación motivó su orientación diagnóstica inicial hacia un proceso séptico agresivo.
Ante la persistencia del cuadro clínico, después de 5 meses de haberse iniciado el proceso, fundamentándose en la experiencia obtenida en ensayos clínicos (3)(4), se planteó aplicar terapia celular mesenquimal.
Previa autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), se obtuvieron 100 ml de aspirado de médula ósea de ambas crestas ilíacas posteriores. La muestra fue remitida a la Unidad de Terapia Celular del Bang de Sang i Teixits de Barcelona donde, bajo normas de correcta fabricación para aplicación clínica (GMP), se aislaron y cultivaron las células troncales mesenquimales (MSC) durante 23 días. En seno del tarso y espacio astrágalo-calcáneo se infundió una dosis de 40x10E6 MSC resuspendidas en 4 ml de una solución salina balanceada con electrolitos y albúmina sérica humana. La paciente experimentó inmediatamente una importante mejoría del dolor y de la funcionalidad, prescindió del uso bastones y se reincorporó a las actividades de la vida diaria. A los 2 meses se dio por resuelto definitivamente el cuadro. Trascurrido más de 1 año del tratamiento permanece este resultado.
DISCUSIÓN
Las MSC se consideran multipotentes por su capacidad para generar in vitro distintos linajes celulares, adiposos, condroblásticos y osteoblásticos, pero su potencial terapéutico radica en su capacidad para señalizar células patológicas del tejido huésped, inhibiendo la apoptosis, estimulando la mitosis, cambiando el epigenoma y/o consiguiendo efectos antiinflamatorios mediante su acción sobre los linfocitos T y B, y secretando citocinas antiinflamatorias IL-10, IL-1RA o PGE2.
La «seguridad de uso» y la «eficacia terapéutica» de las MSC están relacionadas con la aplicación de la dosis adecuada a la patología a tratar que se determina por los estudios de concepto, en modelo animal y en ensayos clínicos, según exige el método científico y la legislación que rige la terapia celular (5). Como los procedimientos de obtención de médula ósea o tejido adiposo, fuentes dadoras más habituales, consiguen recolectar una mínima cantidad de MSC que además se encuentran en estado G0, para conseguir dosis terapéuticas es necesario su aislamiento y expansión bajo normas GMP. La seguridad y la eficacia del producto que finalmente se administra dependen también de las características y volumen del medio de suspensión celular, por así decir el excipiente del medicamento.
El medicamento celular debe estar acreditado como «Producto en Investigación» por parte de la AEMPS; (RD 223/2004; Ley 29/2006, RD 1344/2007, Ley 14/2007). Solo si se demuestra la ausencia de efectos adversos y buenos resultados, la misma autoridad sanitaria puede autorizar al equipo investigador a seguir aplicando el tratamiento celular; (CE 1394/2007, CE 668/2009, RD 477/2014). Este es el proceso que se siguió para la resolución del caso.
Pero, de un tiempo a esta parte, han aparecido en escena dispositivos que procesan muestras de tejido o células con objetivo de obtener la denominada «Fracción Vasculo Estromal» (FVS) compuesta por células de tejido conectivo que se encuentran alrededor del árbol vascular. Con estos procedimientos no se aísla ni multiplica el escaso contenido de las MSC en estado G0 y deberán competir por los nutrientes y el oxígeno con el resto del contenido pluricelular del producto administrado. Aun así, muy habitualmente se utiliza el término «células madre» para referirse a este tipo de productos que, al no seguir un procedimiento de cultivo en laboratorio que implicaría una «manipulación sustancial», no deben someterse al control de la Administración Sanitaria.
Esto no es así porqué los criterios de «manipulación no sustancial» concretan:
- En el caso de los tejidos, cualquier procedimiento que no altere las características originales del tejido relacionadas con su utilidad para la reconstrucción, reparación o sustitución.
- En el caso de las células, un procesamiento que no altere las características biológicas relevantes de las células.
Es decir, aunque no exista un proceso de cultivo en laboratorio, cualquier procedimiento que altere las características de tejidos o células también deberá cumplir los requisitos de la investigación de nuevos medicamentos y realizar los estudios de seguridad y eficacia para la aprobación de la comercialización del producto ya que hay menos fundamentos para predecir sus efectos que después de una «manipulación sustancial» (5).
En la guía de la FDA (Food and Drug Administration) publicada en noviembre de 2017 (6), se hace referencia explícita a la manipulación del tejido adiposo considerándolo un tejido estructural que tiene como función fundamental la amortiguación y el soporte. El proceso para obtener FVS implica más que una «manipulación no sustancial» porqué elimina los adipocitos y los componentes estructurales circundantes que ejercen la función de amortiguación y soporte, alterando así las características originales del producto. La EMA (European Medicines Agency) también considera que cualquier producto basado en terapia celular cuya aplicación implique un «cambio de función» entre la zona dadora y receptora del implante celular, se considera un «medicamento de terapia avanzada» (7). Si la FVS se administra con objetivo de tratar una enfermedad mediante acción farmacológica, inmunológica o metabólica, y contiene células o tejidos que «no se pretenden destinar a la misma función esencial entre la zona dadora y la receptora» también debe ser considerara un «medicamento de terapia celular».
En definitiva, la consideración «medicamento de terapia celular» según el Reglamento 1394/2007 depende tanto de la «manipulación sustancial» que puede sufrir durante su procesamiento como del «cambio de función esencial» en su aplicación. En España es a la AEMPS a quien corresponde establecer la consideración o no como «medicamento de terapia avanzada» del producto resultante (8). La FDA quiere hacer cumplir la ley en toda su amplitud y requiere a los fabricantes de dispositivos para la obtención de la FVS que presenten una solicitud de «Investigación de Nuevos Medicamentos» (IND) o de autorización de comercialización antes del mes de noviembre del 2020 (6).
Parece claro que en casos como el que ilustra este artículo se produce un evidente «cambio de función» del producto biológico empleado: infusión en una articulación de un producto celular obtenido a partir de una muestra de sangre, «multimanipulada» y aplicado en una articulación con intención antinflamatoria y/o regenerativa; por tanto, la aplicación fue una actuación ilícita.
En conclusión, el uso de productos biológicos que no han demostrado seguridad de uso ni indicios de eficacia mediante los estudios preclínicos y clínicos debe ser proscrito en práctica clínica. Ante la comercialización de productos celulares que omiten el control de la Administración Sanitaria, se aconseja extremar la atención y adaptar la práctica a la legislación sobre Terapia Celular, lo que debería evitar problemas de seguridad como el expuesto.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Campos, A. La célula y el tejido como medicamento. De la médula ósea al tejido nervioso. Discurso de Apertura. Universidad de Granada, 2013, pág. 26.
- ↑Ruiz de Almirón, B. Panorama actual de los medicamentos de terapia avanzada. Actual. Med. 2019 diciembre;104:(808):197. DOI: 10.15568/am.2019.808.cd01
- ↑Orozco Ll, Munar A, Soler R, et al. Treatment of knee osteoarthritis with autologous mesenchymal stem cells: a pilot study Transplantation 2013 June;95(12):1535-41. DOI: 10.1097/TP.0b013e318291a2da
- ↑Soler R, Orozco Ll, Munar A, et al. Final results of a phase I–II trial using ex vivo expanded autologous Mesenchymal Stromal Cells for the treatment of osteoarthritis of the knee confirming safety and suggesting cartilage regeneration. The Knee. 2016 August; 23 (4):647-654. 10.1016/j.knee.2015.08.013
- ↑Real Decreto 477/2014, de 13 de junio, por el que se regula la autorización de medicamentos de terapia avanzada de fabricación no industrial. Disponible el 30.05.2020 en: https://www.boe.es/diario_boe/txt.php?id=BOE-A-2014-6277
- ↑Regulatory Considerations for Human Cells, Tissues, and Cellular and Tissue Based Products: Minimal Manipulation and Homologous Use. Guidance for Industry and Food and Drug Administration Staff. U.S. Department of Health and Human Services. FDA. December 2017. Disponible el 30.05.2020 en: https://www.fda.gov/media/124138/download
- ↑Guidelines relevant for advanced therapy medicinal products. EMA. Disponible el 30.05.2020 en: https://www.ema.europa.eu/en/human-regulatory/research-development/advanced-therapies/guidelines-relevant-advanced-therapy-medicinal-products#celltherapy
- ↑Consideraciones sobre los productos sanitarios utilizados para la obtención de células autólogas y la clasificación del producto resultante como medicamento de terapia avanzada. AEMPS, MUH, 4/2018. Disponible el 30.05.2020 en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/2018/docs/NI-MUH_4-2018-Celulas-Autologas.pdf
INFORMACIÓN DEL ARTÍCULO
Conflicto de Intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Joan Rius Tarruella. Institut de Teràpia Regenerativa Tissular (ITRT), Centro Médico Teknon Barcelona. Calle Vilana, 12 · 08022 Barcelona, España. E-mail: joan.rius@itrt.es