Revisión
Evaluación de la proliferación de células adiposas en andamios de fibrina y quitosan: Revisión sistemática
Evaluation of the proliferation of adipose cells in fibrin and chitosan scaffolds: A systematic review
Actual Med. 2020; 105(811): 209-220 DOI: 10.15568/am.2020.811.rev02
Recibido: 23/06/2020
Revisado: 26/06/2020
Aceptado: 27/07/2020
Resumen
Introducción: Actualmente las matrices son utilizadas para la regeneración de órganos y tejidos. Dentro de los polímeros naturales más usados están el quitosán y la fibrina. Estas matrices proporcionan un ambiente tridimensional, con características biomecánicas adecuadas, las cuales permiten la proliferación, migración y diferenciación celular. El objetivo del presente estudio fue realizar una revisión sistemática de aquellos trabajos científicos que tratan de “evaluar la capacidad de proliferación in vitro de células madre adiposas sobre andamios de fibrina y quitosán”.
Materiales y Métodos: Se realizó una búsqueda bibliográfica en las bases de datos PubMed, Proquest y Science direct, utilizando términos de búsqueda específicos, desde enero de 2006 hasta diciembre de 2019. Dos investigadores determinaron independientemente la elegibilidad de los estudios. Se realizó la preselección de los artículos teniendo en cuenta los criterios de inclusión y exclusión. De los artículos seleccionados se extrajo información sobre morfología celular, comportamiento del cambio dimensional del polímero, aislamiento y caracterización celular, crecimiento, viabilidad, tasa de supervivencia y evaluación /citotóxica de las células; cuando faltaron datos, se contactó con los autores de la publicación. Se tuvo en cuenta la descripción de los métodos para obtener datos de proliferación celular mediante pruebas metabólicas como: (MTT), (MTS), WST-1, LIVE-DEAD, microscopía electrónica de barrido, microscopia electrónica de transmisión o microscopia de fluorescencia. Se utilizó una lista de chequeo para la valoración de los ítems y se determinó el índice de concordancia para los dos investigadores.
Resultados: La búsqueda inicial arrojó 165 publicaciones, de los cuales se excluyeron 100 por no cumplir con los criterios de inclusión. Sesenta y cinco se revisaron a texto completo, 58 fueron excluidos por encontrarse duplicados, presentar combinación de quitosán y fibrina con otros compuestos o por no encontrarse toda la información para la evaluación de la rigurosidad metodológica. Finalmente, siete artículos fueron seleccionados y se sometieron a la evaluación metodológica.
Conclusión: Los estudios seleccionados demuestran las ventajas biológicas y mecánicas de los biomateriales de fibrina y quitosán y su capacidad para estimular la proliferación celular. Estos biomateriales podrían ser considerados como opciones para ser utilizados como matrices en protocolos de ingeniería tisular y medicina regenerativa. Futuras investigaciones sobre evaluación de la proliferación celular sobre cualquier biomaterial deben estar direccionadas en plantear rigurosa metodología que permita la obtención de resultados fiables.
Palabras clave: Quitosán; Fibrina; Andamio; Proliferación; Células adiposas; In vitro.
Abstract
Introduction: Currently the matrices are used for the regeneration of organs and tissues. Among the most used natural polymers are chitosan and fibrin. These matrices provide a three-dimensional environment, with adequate biomechanical characteristics, which allow cell proliferation, migration and differentiation. The aim of the present study was to carry out a systematic review of those scientific works that try to “evaluate the in vitro proliferation capacity of adipose stem cells on fibrin and chitosan scaffolds”.
Materials and Methods: A literature search was conducted in the PubMed, Proquest and Science direct databases, using specific search terms, from January 2006 to December 2019. Two investigators independently determined the eligibility of the studies. The articles were preselected considering the inclusion and exclusion criteria. Information on cell morphology, polymer dimensional change behavior, cell isolation and characterization, growth, viability, survival rate and evaluation / cytotoxicity of cells was extracted from the selected articles; when data were missing, the authors of the publication were contacted. The description of the methods to obtain cell proliferation data using metabolic tests such as: (MTT), (MTS), WST-1, LIVE-DEAD, scanning electron microscopy, transmission electron microscopy or fluorescence microscopy was considered. A checklist was used to assess the items and the concordance index was determined for the two researchers.
Results: The initial search yielded 165 publications, of which 100 were excluded because they did not meet the inclusion criteria. Sixty-five were reviewed in full text, 58 were excluded because they found duplicates, presented a combination of chitosan and fibrin with other compounds, or because not all the information was found for the evaluation of methodological rigor. Finally, seven articles were selected and submitted to methodological evaluation.
Conclusion: Selected studies demonstrate the biological and mechanical advantages of fibrin and chitosan biomaterials and their ability to stimulate cell proliferation. These biomaterials could be considered as options to be used as matrices in tissue engineering and regenerative medicine protocols. Future research on the evaluation of cell proliferation on any biomaterial should be aimed at proposing rigorous methodology that allows obtaining reliable results.
Keywords: Chitosan; Fibrin; Scaffold; Proliferation; Adipose cells; In vitro.
Leer Artículo Completo
1. INTRODUCCIÓN
Los matrices son estructuras de soporte fabricados artificialmente, los cuales pueden ser de origen natural o sintético (1,2). Dentro de los matrices naturales, los biopolímeros más usados son el colágeno, la gelatina, el quitosán y la fibrina (3). Los matrices deben poseer una red extensa de poros interconectados que permitan el crecimiento y la proliferación celular, facilitando la difusión de oxígeno, nutrientes y factores de crecimiento. Además, deben ser biocompatibles, exhibir un perfil de biodegradación y tener resistencia mecánica de acuerdo con la aplicación terapéutica (4,5). Estas estructuras junto con los componentes celulares y moléculas bioactivas mejoran o restauran la función de tejidos dañados de forma parcial o completa, optimizando la respuesta inmunológica (6,7).
Uno de los biopolímeros más empleados es la fibrina, que desempeña un papel importante en la regeneración de la piel (8). Los medios de unión de fibrina se componen principalmente de fibrinógeno y trombina (8, 9). La fibrina permite segregar factores de crecimiento, aumentar la cantidad de proteínas estructurales de la matriz y mejorar la proliferación junto con la adhesión de células adiposas hacia el sitio de la herida (10–14).
Otro de los materiales usados es el quitosán, derivado de la quitina, mediante un alto grado de desacetilación (89%), que estimula fuertemente la proliferación de los fibroblastos. La ventaja de usar quitosán es su biocompatibilidad in vivo, tiene la particularidad de degradarse de manera controlada para permitir el reemplazo progresivo en la actividad de reparación y regeneración y proveer resistencia mecánica temporal al área donde se incorporará la matriz (7,13-15). En estudios in vitro el quitosán, ha logrado mejorar adhesión, proliferación, diferenciación y modulación del crecimiento celular (16–19). En sustitutos dérmicos obtenidos a partir de copolímeros de quitosán, se ha podido determinar que este biopolímero mejora sus características biomecánicas y biológicas, sin causar respuesta inmune, permitiendo una vascularización y colonización adecuada, obteniendo así una matriz organizada con poca formación de granulación y tejido cicatrizado (20). El quitosán empleado como soporte en cultivos de células adiposas, mediante el proceso de reticulación, mejora propiedades celulares como: adhesión, diferenciación, expansión, mantenimiento y proliferación (21–22).
Las células estromales o mesenquimales son multipotenciales y se pueden transformar en osteoblastos, condrocitos, adipocitos, neuronas y células musculares (23–25). Las células adiposas, consideradas células madre mesenquimales (MSC) por su capacidad de expansión in vitro e in vivo y por su alto potencial de diferenciación hacia linajes celulares especializados, son fáciles de obtener y constituyen una fuente con potencial de interés en la aplicación terapéutica en ingeniería tisular. El tejido adiposo se deriva del mesodermo, contiene una población microvascular de células endoteliales, músculo liso y células madre. El componente celular se obtiene mediante procesos de centrifugación y filtración, además, poseen características homólogas de células de la médula ósea, en cuanto a su alto grado de proliferación (26–28).
Se han reportado las propiedades de los matrices de quitosán y fibrina in vitro en cuanto a la proliferación de las células adiposas, encontrando que estos tipos de andamiaje ofrecen amplias superficies que mejoran el soporte de las células, aumentando el crecimiento, la diferenciación y la proliferación de las mismas; al igual que permite el paso de los nutrientes. (27,29–34). Sin embargo, no es claro cuál andamio presenta mejores condiciones para la proliferación de las células adiposas. El objetivo del presente estudio fue realizar una revisión sistemática de aquellos trabajos científicos que tratan de evaluar la capacidad de proliferación in vitro de células madre adiposas sobre andamios de fibrina y quitosán.
2. MATERIAL Y MÉTODOS
2.1. Estrategia de búsqueda
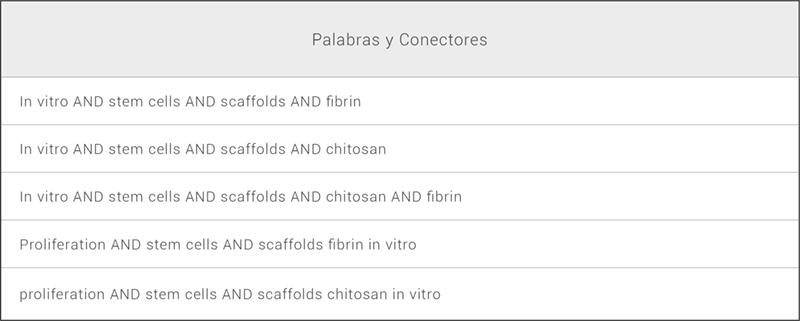
Se adoptaron directrices de la guía PRISMA para llevar a cabo esta Revisión Sistemática. Se realizó una detallada búsqueda en idioma inglés usando tres bases de datos electrónicas: Science Direct, Proquest y Pubmed. Una estrategia de búsqueda fue aplicada con los términos MeSH: Células madre (“Stem cells”), matrices (scaffold), quitosán (chitosan), fibrina (fibrin), proliferación (proliferation), regeneración tisular (“tisular regeneration”) e “in vitro”, combinados usando el operador boleano “AND” (ver Tabla 1).
Tabla 1. Estrategia de búsqueda. Conformación de los Algoritmos de búsqueda
Se incluyeron artículos publicados desde enero de 2006 hasta diciembre de 2019. Los artículos fueron seleccionados teniendo en cuenta los siguientes criterios de inclusión: 1. Estudios experimentales in vitro. 2. Estudios con datos de proliferación de células adiposas sobre matrices de quitosán y fibrina. Se excluyeron estudios donde se utilizaron fibrina y quitosán combinados con otros biomateriales.
2.2. Selección del estudio y proceso de recolección de datos
En la primera fase del estudio los títulos y los resúmenes fueron evaluados por dos revisores independientes. Se eliminaron los estudios que se encontraron repetidos en las bases de datos. Los desacuerdos fueron resueltos por un revisor experto en el tema, mediante discusión hasta llegar a un consenso.
De los estudios incluidos, los dos revisores examinaron los textos completos aplicando los criterios de inclusión y exclusión. Se excluyeron los informes de casos, opiniones de expertos y comentarios de la literatura. Se extrajo la información según los criterios de elegibilidad.
2.2.1. Datos de los artículos
De cada artículo se extrajo información sobre: 1. autor y año de publicación, 2. metodología del estudio (tipo de matriz, grupo control, aislamiento y caracterización de las células adiposas, morfología celular, observación de la microestructura mediante microscopía, comportamiento del cambio dimensional del polímero, crecimiento, viabilidad y tasa de supervivencia, evaluación /citotóxica de células adiposas cultivadas), 3. Análisis de los datos (Tabla 2). Cuando faltaron algunos datos mencionados, los autores de esta revisión se comunicaron con los investigadores obteniendo respuesta de dos ellos, según los requerimientos.
Tabla 2. Datos Metodológicos generales de los artículos seleccionadosFuente: Elaboración propia.
2.3. Evaluación de calidad
La evaluación de la calidad del estudio metodológico se realizó utilizando los criterios propuestos por Mossman et.al (1983). Por el tipo de estudio seleccionado no se utilizó una escala para medir el riesgo de sesgo, por lo tanto, se diseñó una lista de chequeo para evaluar los criterios relevantes de la metodología (ver Tabla 3). Los criterios relevantes fueron evaluados en cada artículo y calificados como “Sí” si el criterio se cumplía y “No” si el criterio no estaba claro. Cuando se cumplió con todos los criterios se calificó como bajo riesgo de sesgo. Se tomaron solo los estudios que cumplieron todos los criterios. Los desacuerdos entre los revisores se resolvieron mediante discusión para llegar a un consenso.
Tabla 3. Lista de chequeo con los criterios relevantes de la metodología de los artículos seleccionados.
Si: Cuando cumple con los criterios de rigor metodológico
No es claro: Cuando no presenta descripción detallada de los criterios de rigor metodológico
Se determinó como medida de resultado para la proliferación de células adiposas la absorbancia por medio de pruebas o ensayos metabólicos.
3. RESULTADOS
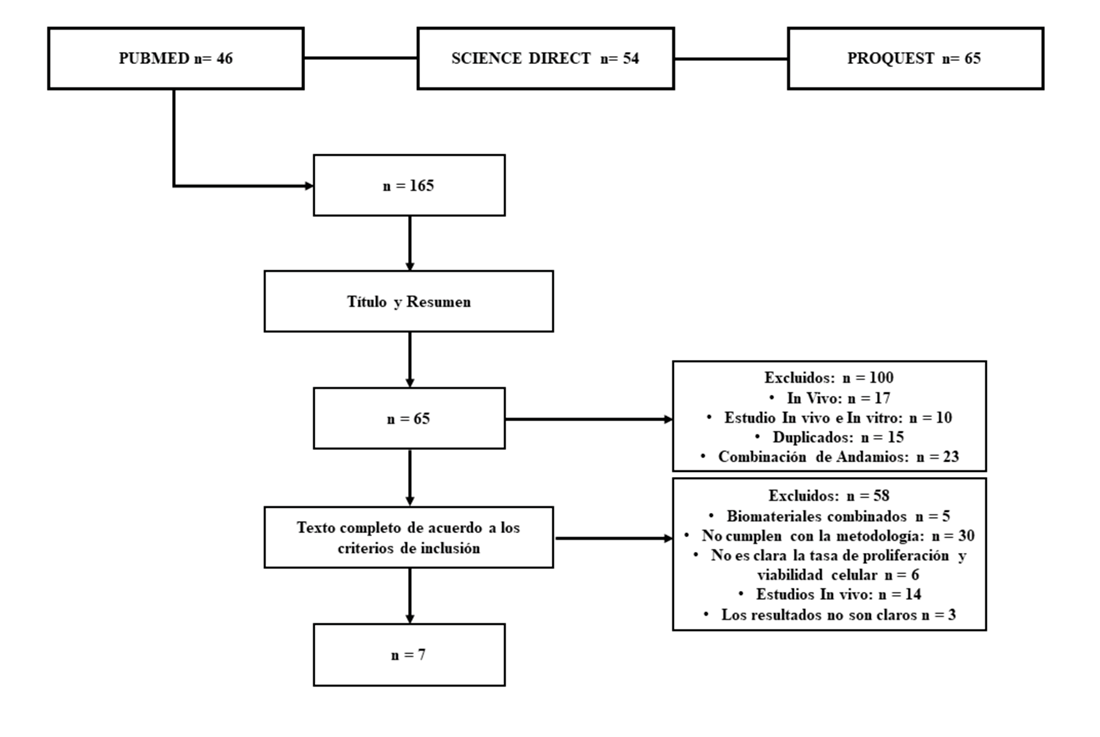
Se preseleccionaron 165 artículos de acuerdo con la búsqueda inicial, de los cuales se excluyeron 100 artículos que no cumplían con los criterios de inclusión. De los 65 artículos que fueron seleccionados, se hizo revisión a texto completo donde en 23 artículos se encontró combinación de biomateriales, 17 artículos fueron estudios in vivo, 10 estudios in vivo e in vitro y 15 duplicados (Figura 1). Finalmente, siete artículos fueron seleccionados para ser sometidos al análisis a texto completo (tabla 3); cuatro estudios: Park et. al, Chung et, Girandon et. al y Sheykhhasan et. al evaluaron la proliferación de células adiposas sobre matrices de fibrina, dos estudios Debnath et. al y Mohamed et. al evaluaron células adiposas en matrices de quitosán y el estudio de Wahl et. al comparó la proliferación celular en matrices de fibrina y quitosán.
Figura 1. Diagrama de flujo de la estrategia de búsqueda utilizada en este estudio
En cuanto a la morfología celular Chung et. al (2015) realiza un meticuloso análisis teniendo en cuenta el volumen, número de ramificaciones y conexiones celulares, longitud y diámetro celular. Por otro lado, Debnath et. al (2015), Wahl et. al (2015), Girandon et. al (2011) hacen descripción cualitativa de la morfología celular sin entrar en análisis detallados. El estudio realizado por Wahl et. al (2015) sólo se enfoca en describir la elongación celular mediante un programa informático sin considerar otras características morfológicas. Los trabajos de Sheykhhasan et. al (2015) y Mohamed et. al (2015).) no realizan análisis morfológico.
La mayoría de los trabajos coinciden en evaluar la proliferación celular en un rango de tiempo comprendido entre los 7, 10 y 14 días. La mejor tasa de proliferación celular se presentó entre los 7 y 14 días de experimentación.
De acuerdo con la medida de resultado, Chung et. al, realizó ensayo metabólico MTS dando como resultados una absorbancia de 490 nm evaluado en 2, 5 y 7 días, pero no hay una valoración expresada en porcentaje de proliferación celular. Debnath et. al, usó el ensayo JC1 (actividad mitocondrial) reportando resultados cualitativos, además utilizó el ensayo metabólico MTT mostrando resultados cuantitativos en porcentajes de proliferación celular. Finalmente, los resultados del ensayo de LDH (Lactato deshidrogenasa) los representa en microgramos por mililitro. El tiempo de evaluación fue entre 7 y 14 días.
Wahl et. al, mediante ensayo metabólico de LDH reporta una proliferación celular del 70% sobre andamio de fibrina y del 50% en andamio de quitosán a los 7 días; además reporta los resultados con la técnica WST-1 (Sales de Tetrazolium/formazan) con una absorbancia de 450 nm. El tiempo de evaluación fue de 1, 3, 7 y 14 días.
Park et. al, realiza pruebas metabólicas de ADN (PICOgreen) con una absorbancia de 260 nm y usa ensayos de inmunofluerescia, el tiempo de evaluación fue de 7 días.
Girandon et. al, usa la técnica metabólica de LIVE-DEAD expresando sus resultados en distribución de área, pero sin presentar un porcentaje de proliferación. El tiempo evaluado fue entre 7 y 14 días. Sheykhhasan et. al en su estudio utilizó ensayo metabólico MTT presentando resultados en absorbancia sobre 570 nm. No reporta el porcentaje de proliferación celular y realiza la evaluación inicial a los 2 y 3 días luego evalúa a los 14 días- Mohamed et. al, realiza ensayo metabólico LIVE- DEAD, con descripción cualitativa de la proliferación, evaluada entre 1 y 4 días (24 – 96 horas).
Evaluación de la calidad
Cuatro artículos (Chung et. al, Debnath et. al, Wahl et. al y Park et. al) cumplieron los parámetros de la evaluación de la calidad metodológica, sin embargo, hay una variabilidad en los ensayos metabólicos que no permiten una comparación en cuanto a la expresión cuantitativa de la proliferación de las células adiposas en las dos matrices. Los cuatro estudios presentan un incremento de la proliferación respecto al intervalo de tiempo.
4. DISCUSIÓN
Este trabajo tuvo como objetivo realizar una revisión sistemática de aquellos trabajos científicos que tratan de evaluar la capacidad de proliferación in vitro de células madre adiposas sobre andamios de fibrina y quitosán.
Los métodos y técnicas para evaluar la proliferación resultan de gran importancia para identificar las ventajas de los biomateriales que pueden servir como matrices (35–36) y las investigaciones que se decantan por realizar diferentes ensayos y técnicas arrojarán mejor evidencia que aquellos trabajos que se limitan a realizar solamente una prueba (37). En este sentido, esta revisión sistemática se focalizó en determinar los estudios que cumplían con los mejores criterios metodológicos para analizar la proliferación en diferentes biomateriales.
Se evidenció que los requisitos a tener en cuenta para desarrollar una metodología rigurosa son: 1. Se debe describir la caracterización celular cuando se utilizan células mesenquimales. 2. Se sebe describir el subcultivo utilizado en los ensayos. 3. Analizar la morfología celular midiendo las dimensiones celulares mediante microscopía o fluorescencia. 4. Usar o combinar ensayos metabólicos. 5. Tiempo de desarrollo de los experimentos.
Por esta razón, los criterios incluidos en este trabajo para evaluar la proliferación celular son el análisis minucioso de la morfología celular, ensayos metabólicos como MTT, WST-1, MTS, LIVE/DEAD, LDH y evaluación mediante microscopía o fluorescencia (38). Las pruebas metabólicas se perfilan como el gold standard para evaluar la proliferación y citotoxicidad celular in vitro además de tener como característica principal de proporcionar un dato cuantitativo. Además, este tipo de ensayos no deben interferir con el compuesto a evaluar, en este caso los matrices de fibrina y quitosán.
La Sociedad Internacional de Terapia Celular/ International Society for Cellular Therapy (ISCT), estableció unos criterios para identificar las células madre mesenquimales. Primero, se debe demostrar su morfología fibroblastoide y la adherencia a la superficie plástica del cultivo celular. Segundo, las células mesenquimales deben expresar como mínimo los marcadores de superficie positivos para CD105, CD90, CD73; y ser negativos para CD34 y CD45 (3).
En primer lugar, este estudio encontró que, aunque los 7 artículos elegidos presentaban rigurosa calidad metodológica solo 4 ellos hicieron un análisis integral para evaluar la proliferación sobre matrices de quitosán y fibrina específicamente. Cuando buscamos cuáles estudios hicieron caracterización de las células adiposas mesenquimales se encontró que cinco investigaciones realizaban una adecuada caracterización celular Park et. al, Chung et. al, Debnath et. al, Wahl et. al, Mohamed et. al. Incluyendo técnicas de citometría de flujo y diferenciación a linaje condrogénico, adipogénico y osteogénico tal como lo exige la ISCT. Interesantemente, el estudio de Mohamed et. al realiza caracterización de células mesenquimales utilizando técnica histoquímica, el cual utiliza anticuerpos específicos CD29, CD34, CD105, CD73, CD90 para identificar células mesenquimales. Aunque no es un ensayo convencional para caracterizar este tipo de células se convierte en una técnica opcional para dicho fin. Estos resultados, contrastan con diferentes trabajos que aunque realizan caracterización celular, no presentan una adecuada metodología para evaluar comportamiento celular sobre matrices (21, 39).
En segunda instancia, es importante resaltar que cuando evaluamos el ítem de si los investigadores describen el subcultivo celular utilizados para hacer los diferentes ensayos y técnicas para evaluar matrices se pudo confirmar que todos los estudios seleccionados en esta investigación consideraron importante nombrar el subcultivo celular. Estos hallazgos ponen de manifiesto, que la descripción del subcultivo celular es un requisito importante a la hora de diseñar experimentos de proliferación sobre matrices. Estos resultados están en desacuerdo con trabajos que se limitan a desarrollar ensayos y técnicas sin descripción previa del subcultivo celular (40).
En tercer lugar, la morfología celular es una característica importante que está correlacionada con importantes funciones bioquímicas involucradas en la formación de nuevo tejido, proliferación y migración celular. Además, se determinó cómo las características biológicas y biomecánicas de los matrices inciden sobre la proliferación celular observando que cuando se altera la morfología se altera la viabilidad y la tasa de proliferación celular. Es decir, los cambios morfológicos ocurridos sobre un biomaterial inciden sobre la proliferación (41).
En esta revisión se encontraron tres artículos que analizaron la morfología para evidenciar el comportamiento celular sobre los matrices de fibrina y quitosán. El método más reportado para analizar la morfología celular fue la microscopía, incluida la microscopía electrónica de barrido y en segundo lugar las técnicas de fluorescencia también se posicionan como una alternativa para evaluar la morfología celular. Los trabajos de H. Park et. al (2010), E. Chung et. al (2015), y T. Debnath et. al (2015) hacen una detallada descripción cuantitativa y cualitativa de la morfología celular sobre los matrices de fibrina y quitosán. Estos estudios ponen de manifiesto que una rigurosa interpretación cuantitativa y cualitativa ofrece mejor evidencia que aquellos estudios que solo se limitan a interpretaciones cualitativas o en algunos casos no se realiza dicha interpretación (22). Sin embargo, mucho de los estudios encontrados en la literatura reportan estás técnicas para evaluar morfología celular pero no proporcionan un juicioso análisis e interpretación. (2,42)
En cuarto lugar, en esta revisión sistemática los estudios de H. Park et. al (2010), E. Chung et. al (2015), T. Debnath et. al (2015), M. Sheykhhasan et. al (2015), A.Wahl et. al (2015) utilizan ensayos metabólicos para evaluar la proliferación y citotoxicidad celular de células adiposas sobre matrices de quitosán y fibrina tales como Picogreen, WST-1, MTS y MTT. Por otro lado, M. Mohamed et. al (2015) y L. Girandon et. al (2011) se limitan a utilizar el ensayo de viabilidad celular LIVE/DEAD. Estos ensayos arrojan información de vital importancia de cómo influyen los biomateriales en la proliferación celular. Una de las grandes ventajas de los ensayos metabólicos es que permite obtener resultados e interpretaciones cuantitativas en valores de absorbancia o porcentajes. Mientras que la prueba de LIVE/DEAD en los estudios reportados en este trabajo los autores se limitan a hacer una interpretación cualitativa y semicuantitativa sin arrojar datos estadísticamente significativos.
Adicional a esto, otro hallazgo importante que se pudo extraer de la presente investigación fue la repercusión que tienen la combinación de diferentes ensayos metabólicos en el mismo estudio. Estas combinaciones proporcionan datos relevantes y sólidos los cuales aportan mejor calidad de evidencia científica. Tal es el caso de los estudios realizados por Debnath et. al quién combina ensayos de 5,5’, 6,6’-tetrachloro-1,1’, 3,3’-tetraethylbenzimidazolcarbocyanine iodide (JC-1) el cual es una técnica que permite evaluar la integridad de la membrana mitocondrial (43), con LDH y MTT. Y el estudio realizado por A.Wahl et. al combina ensayos metabólicos de WST-1 y LDH.
A la luz de estos resultados se puede dilucidar que los ensayos metabólicos o combinación de ellos se posicionan como herramientas fundamentales para evaluar la proliferación y citotoxicidad celular. Estos hallazgos están en contraposición a aquellos estudios que no utilizan este tipo de pruebas. (44, 45, 46).
Discutiendo el quinto punto de los requisitos para considerar como relevante un estudio de proliferación celular sobre matrices, en este trabajo se pudo evidenciar que los estudios que plantean diferentes tiempos para la realización de sus experimentos cumplen con rigurosidad científica. Los hallazgos encontrados en esta revisión sobre todos los trabajos seleccionados proponían dentro de su diseño experimental para evaluar proliferación rangos de tiempo representados en 1, 3, 7 y 14 días principalmente. Sin embargo, ensayos como el LIVE/DEAD, WST-1, MTT también se pueden plantear en rangos de horas 24, 48, 72 y 96 horas tal como lo demuestran varios estudios de viabilidad celular (47, 48).
Los resultados encontrados en estos estudios ponen de manifiesto que la mejor taza de proliferación y viabilidad celular está contemplada en un periodo de 7 a 14 días sobre los matrices de fibrina y quitosán (2,41,49–53).
Estos hallazgos están en concordancia con trabajos previamente reportados los cuales evalúan proliferación celular a diferentes rangos de días (10, 21,40).
Vale la pena resaltar que en esta investigación se descartaron varios estudios debido a que no cumplieron con rigurosidad metodológica. Algunos reportes presentaron combinación de diferentes biomateriales como poly(lactic-co-glycolic acid) (PLGA), nanopartículas de hidroxiapatita dopadas con zinc y colágeno (54).
El análisis de la calidad de los estudios seleccionados permitió determinar que deben existir unos criterios mínimos a la hora de plantear investigaciones in vitro encaminadas a la evaluación de la proliferación sobre matrices utilizados en ingeniería tisular y medicina regenerativa. Dichos criterios son: 1. describir la caracterización celular. 2. describir el subcultivo utilizado. 3. Analizar la morfología celular. 4. Usar o combinar ensayos metabólicos. 5. Plantear diferentes tiempos de desarrollo de los experimentos.
En este sentido, los siete trabajos seleccionados en esta revisión pusieron en evidencia que los matrices de fibrina y quitosán presentan características ideales para la proliferación celular. Además, los matrices de fibrina y quitosán se perfilan como biomateriales con buenas características en cuanto a biocompatibilidad para ser tenidos en cuenta en procesos de regeneración (2, 41,49-53). Sin embargo, solo cuatro estudios presentaron rigurosa metodología para sustentar estas afirmaciones en condiciones in vitro. Con el fin de contribuir a la rigurosidad científica se recomienda a los investigadores plantear diseños metodológicos que permitan obtener resultados de validez investigativa. Adicional a esto, también se hace necesario plantear estudios in vivo y ensayos clínicos aleatorizados controlados.
5. CONCLUSIÓN
Los estudios seleccionados en este trabajo de investigación que cumplieron con la rigurosidad metodológica demuestran las ventajas biológicas y mecánicas de los biomateriales de fibrina y quitosán y su capacidad para estimular la proliferación celular. Estos biomateriales podrían ser considerados como opciones para ser utilizados como matrices en protocolos de ingeniería tisular y medicina regenerativa.
Futuras investigaciones sobre evaluación de la proliferación celular sobre cualquier biomaterial deben estar direccionadas en plantear rigurosa metodología que permita la obtención de resultados fiables considerando: la descripción de la caracterización celular cuando se utilizan células mesenquimales, mencionar el subcultivo utilizado en los ensayos, analizar la morfología celular mediante técnicas microscópicas, contemplar la utilización de diferentes ensayos que evalúen la proliferación celular y tener en cuenta los tiempos en que se va a desarrollar la experimentación.
REFERENCIAS BIBLIOGRÁFICAS
- ↑De La Puente P, Ludeña D, Fernández A, Aranda JL, Varela G, Iglesias J. Autologous fibrin scaffolds cultured dermal fibroblasts and enriched with encapsulated bFGF for tissue engineering. J Biomed Mater Res – Part A. 2011;99 A(4):648–54. DOI: 10.1002/jbm.a.33231
- ↑Sheykhhasan M, Qomi RT, Kalhor N, Mehdizadeh M, Ghiasi M. Evaluation of the ability of natural and synthetic scaffolds in providing an appropriate environment for growth and chondrogenic differentiation of adipose-derived mesenchymal stem cel. Indian J Orthop. 2015;49(5):561–8. DOI: 10.4103/0019-5413.164043
- ↑Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini FC, Krause DS, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315–7. DOI: 10.1080/14653240600855905
- ↑Hsieh WC, Liau JJ, Li YJ. Characterization and cell culture of a grafted chitosan scaffold for tissue engineering. Int J Polym Sci. 2015;2015. https://doi.org/10.1155/2015/935305
- ↑Singaravelu S, Ramanathan G, Raja MD, Nagiah N, Padmapriya P, Kaveri K, et al. Biomimetic interconnected porous keratin-fibrin-gelatin 3D sponge for tissue engineering application. Int J Biol Macromol. 2016;86:810–9. DOI: 10.1016/j.ijbiomac.2016.02.021
- ↑Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells: Characterization, differentiation, and application in cell and gene therapy. J Cell Mol Med. 2004;8:301–16. DOI: 10.1111/j.1582-4934.2004.tb00320.x
- ↑Chun HJ, Kim GW, Kim CH. Fabrication of porous chitosan scaffold in order to improve biocompatibility. J Phys Chem Solids. 2008;69(5–6):1573–6. DOI: 10.1080/09205063.2014.979386
- ↑Girandon L, Kregar-Velikonja N, Božikov K, Barlič A. In vitro models for adipose tissue engineering with adipose-derived stem cells using different scaffolds of natural origin. Folia Biol (Czech Republic). 2011;57(2):47–56. Disponible en: https://pubmed.ncbi.nlm.nih.gov/21631961/
- ↑Edwards RG. Stem cells today: A. Origin and potential of embryo stem cells. Reprod Biomed Online. 2004;8(3):275–306. DOI: 10.1016/s1472-6483(10)60910-8
- ↑Bhat S, Kumar A. Cell proliferation on three-dimensional chitosan-agarose-gelatin cryogel scaffolds for tissue engineering applications. J Biosci Bioeng. 2012;114(6):663–70. DOI: 10.1016/j.jbiosc.2012.07.005
- ↑Pezeshki-Modaress M, Rajabi-Zeleti S, Zandi M, Mirzadeh H, Sodeifi N, Nekookar A, et al. Cell-loaded gelatin/chitosan scaffolds fabricated by salt-leaching/lyophilization for skin tissue engineering: In vitro and in vivo study. J Biomed Mater Res – Part A. 2014;102(11):3908–17. DOI: 10.1002/jbm.a.35054
- ↑Ma J, Wang H, He B, Chen J. A preliminary in vitro study on the fabrication and tissue engineering applications of a novel chitosan bilayer material as a scaffold of human neofetal dermal fibroblasts. Biomaterials. 2001;22(4):331–6. DOI: 10.1016/s0142-9612(00)00188-5
- ↑Zhang YF, Cheng XR, Chen Y, Shi B, Chen XH, Xu DX, et al. Three-dimensional nanohydroxyapatite/chitosan scaffolds as potential tissue engineered periodontal tissue. J Biomater Appl. 2007;21(4):333–49. https://doi.org/10.1177/0885328206063853
- ↑Liu C, Xia Z, Czernuszka JT. Design and development of three-dimensional scaffolds for tissue engineering. Chem Eng Res Des. 2007;85(7 A):1051–64. https://doi.org/10.1205/cherd06196
- ↑Snima KS, Jayakumar R, Lakshmanan VK. In vitro and in vivo biological evaluation of o-carboxymethyl chitosan encapsulated metformin nanoparticles for pancreatic cancer therapy. Pharm Res. 2014;31(12):3361–70. DOI: 10.1007/s11095-014-1425-0
- ↑Saintigny G, Bonnard M, Damour O, Collombel C. Reconstruction of epidermis on a chitosan cross-linked collagen-GAG lattice: Effect of fibroblasts. Acta Derm Venereol. 1993;73(3):175–80. DOI: 10.2340/0001555573175180
- ↑Katalinich M. Characterization of Chitosan Films for Cell Culture Applications. 2001;1–196. https://digitalcommons.library.umaine.edu/etd/245
- ↑Zhu Y, Liu T, Song K, Jiang B, Ma X, Cui Z. Collagen-chitosan polymer as a scaffold for the proliferation of human adipose tissue-derived stem cells. J Mater Sci Mater Med. 2009;20(3):799–808. DOI: 10.1007/s10856-008-3636-6
- ↑Shimojo AAM, Perez AGM, Galdames SEM, Brissac ICDS, Santana MHA. Performance of PRP associated with porous chitosan as a composite scaffold for regenerative medicine. Sci World J. 2015;2015:396131. DOI: 10.1155/2015/396131
- ↑Zakhem E, Bitar K. Development of Chitosan Scaffolds with Enhanced Mechanical Properties for Intestinal Tissue Engineering Applications. J Funct Biomater. 2015;6(4):999–1011. DOI: 10.3390/jfb6040999
- ↑Sánchez-Muñoz I, Granados R, Holguín Holgado P, García-Vela JA, Casares C, Casares M. The use of adipose mesenchymal stem cells and human umbilical vascular endothelial cells on a fibrin matrix for endothelialized skin substitute. Tissue Eng – Part A. 2015;21(1–2):214–23. DOI: 10.1089/ten.TEA.2013.0626
- ↑Gomathysankar S, Halim AS, Yaacob NS, Noor NM, Mohamed M. Compatibility of porous Chitosan Scaffold with the attachment and proliferation of human adipose-derived stem cells in vitro. J Stem Cells Regen Med. 2016;12(2):79–86. DOI: 10.46582/jsrm.1202012
- ↑Kuci S, Kuci Z, Latifi-Pupovci H, Niethammer D, Handgretinger R, Schumm M, et al. Adult Stem Cells as an Alternative Source of Multipotential (Pluripotential) Cells in Regenerative Medicine. Curr Stem Cell Res Ther. 2009;4(2):107–17. DOI: 10.2174/157488809788167427
- ↑Breitbart AS, Mason JM, Urmacher C, Barcia M, Grant RT, Pergolizzi RG, et al. Gene-enhanced tissue engineering: applications for wound healing using cultured dermal fibroblast transduced retrovirally with the PDGF-B gene. Ann Plast Surg. 1999;43(6):632-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/10597824/
- ↑Iyer P, Walker KJ, Madihally S V. Increased matrix synthesis by fibroblasts with decreased proliferation on synthetic chitosan-gelatin porous structures. Biotechnol Bioeng. 2012 May;109(5):1314–25. DOI: 10.1002/bit.24396
- ↑Chung E, Nam SY, Ricles LM, Emelianov SY, Suggs LJ. Evaluation of gold nanotracers to track adipose-derived stem cells in a PEGylated fibrin gel for dermal tissue engineering applications. Int J Nanomed. 2013 Jan 17;8:325–36. DOI: 10.2147/IJN.S36711
- ↑Pineda C, Londoño P. Adipose tissue derived mesenchymal stem cells, isolation and differentiation into osteogenic lineage. Rev. Ing Biomed. 2009;3(5):58-65. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S1909-97622009000100010
- ↑Zhu Y, Liu T, Song K, Fan X, Ma X, Cui Z. Adipose-derived stem cell: A better stem cell than BMSC. Cell Biochem Funct. 2008;26(6):664–75. DOI: 10.1002/cbf.1488
- ↑Vedakumari WS, Ayaz N, Karthick AS, Senthil R, Sastry TP. Quercetin impregnated chitosan–fibrin composite scaffolds as potential wound dressing materials — Fabrication, characterization and in vivo analysis. Eur J Pharm Sci. 2017;97:106–12. DOI: 10.1016/j.ejps.2016.11.012
- ↑Han CM, Zhang LP, Sun JZ, Shi HF, Zhou J, Gao CY. Application of collagen-chitosan/fibrin glue asymmetric scaffolds in skin tissue engineering. J Zhejiang Univ Sci B. 2010;11(7):524–30. DOI: 10.1631/jzus.B0900400
- ↑Wang ZH, Zhang J, Zhang Q, Gao Y, Yan J, Zhao XY, et al. Evaluation of bone matrix gelatin/fibrin glue and chitosan/gelatin composite scaffolds for cartilage tissue engineering. Genet Mol Res. 2016;15(3). DOI: 10.4238/gmr.15038431
- ↑Devi MP, Sekar M, Chamundeswari M, Moorthy A, Krithiga G, Murugan NS, et al. A novel wound dressing material- Fibrin-chitosan-sodium alginate composite sheet. Bull Mater Sci. 2012;35(7):1157–63. DOI: 10.4238/gmr.15038431
- ↑Albanna MZ, Bou-Akl TH, Walters HL, Matthew HWT. Improving the mechanical properties of chitosan-based heart valve scaffolds using chitosan fibers. J Mech Behav Biomed Mater. 2012;5(1):171–80. DOI: 10.1016/j.jmbbm.2011.08.021
- ↑Bodek KH, Nowak KM, Kozakiewicz M, Bodek A, Michalska M. Evaluation of Microcrystalline Chitosan and Fibrin Membranes as Platelet-Derived Growth Factor-BB Carriers with Amoxicillin. Int J Polym Sci. 2015;2015. DOI: 10.1186/s13065-019-0574-y
- ↑Maxson S, Lopez EA, Yoo D, Danilkovitch-Miagkova A, LeRoux MA. Concise Review: Role of Mesenchymal Stem Cells in Wound Repair. Stem Cells Transl Med. 2012;1(2):142–9. DOI: 10.5966/sctm.2011-0018
- ↑Jackson WM, Nesti LJ, Tuan RS. Concise Review: Clinical Translation of Wound Healing Therapies Based on Mesenchymal Stem Cells. Stem Cells Transl Med. 2012;1(1):44–50. DOI: 10.5966/sctm.2011-0024
- ↑Martin-Piedra MA, Garzon I, Oliveira AC, Alfonso-Rodriguez CA, Sanchez-Quevedo MC, Campos A, et al. Average cell viability levels of human dental pulp stem cells: An accurate combinatorial index for quality control in tissue engineering. Cytotherapy. 2013;15(4):507–18. https://doi.org/10.1016/j.jcyt.2012.11.017
- ↑Leipzig ND, Shoichet MS. The effect of substrate stiffness on adult neural stem cell behavior. Biomaterials. 2009;30(36):6867–78. DOI: 10.1016/j.biomaterials.2009.09.002
- ↑Ji C, Annabi N, Khademhosseini A, Dehghani F. Fabrication of porous chitosan scaffolds for soft tissue engineering using dense gas CO2. Acta Biomater. 2011;7(4):1653–64. DOI: 10.1016/j.actbio.2010.11.043
- ↑Sangsanoh P, Suwantong O, Neamnark A, Cheepsunthorn P, Pavasant P, Supaphol P. In vitro biocompatibility of electrospun and solvent-cast chitosan substrata towards Schwann, osteoblast, keratinocyte and fibroblast cells. Eur Polym J. 2010 Mar 1;46(3):428–40. https://doi.org/10.1021/bm061152a
- ↑Debnath T, Ghosh S, Potlapuvu US, Kona L, Kamaraju SR, Sarkar S, et al. Proliferation and differentiation potential of human adipose-derived stem cells grown on chitosan hydrogel. PLoS One. 2015;10(3):1-14. DOI: 10.1371/journal.pone.0120803
- ↑Wang W, He N, Feng C, Liu V, Zhang L, Wang F, et al. Human adipose-derived mesenchymal progenitor cells engraft into rabbit articular cartilage. Int J Mol Sci. 2015;16(6):12076–91. DOI: 10.3390/ijms160612076
- ↑Cossarizza A, Baccarani-Contri M, Kalashnikova G, Franceschi C. A new method for the cytofluorometric analysis of mitochondrial membrane potential using the J-aggregate forming lipophilic cation 5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzim idazolcarbocyanine iodide (JC-1). Biochem Biophys Res Commun. 1993;197(1):40–5. DOI: 10.1006/bbrc.1993.2438
- ↑Mahmoud AA, Salama AH. Norfloxacin-loaded collagen/chitosan scaffolds for skin reconstruction: Preparation, evaluation and in-vivo wound healing assessment. Eur J Pharm Sci. 2016;83:155–65. DOI: 10.1016/j.ejps.2015.12.026
- ↑Fukuda J, Khademhosseini A, Yeo Y, Yang X, Yeh J, Eng G, et al. Micromolding of photocrosslinkable chitosan hydrogel for spheroid microarray and co-cultures. Biomaterials. 2006;27(30):5259–67. DOI: 10.1016/j.biomaterials.2006.05.044
- ↑Kim MS, Park SJ, Gu BK, Kim CH. Inter-connecting pores of chitosan scaffold with basic fibroblast growth factor modulate biological activity on human mesenchymal stem cells. Carbohydr Polym. 2012 Mar 1;87(4):2683–9. DOI: 10.1016/j.carbpol.2011.11.060
- ↑Martin-Piedra MA, Garzon I, Oliveira AC, Alfonso-Rodriguez CA, Carriel V, Scionti G, et al. Cell viability and proliferation capability of long-term human dental pulp stem cell cultures. Cytotherapy. 2014;16(2):266–77. DOI: 10.1016/j.jcyt.2013.10.016
- ↑Oliveira AC, Rodríguez IÁ, Garzón I, Martín-Piedra MÁ, Alfonso-Rodríguez CA, García JM, et al. An early and late cytotoxicity evaluation of lidocaine on human oral mucosa fibroblasts. Exp Biol Med. 2014;239(1):71–82. DOI: 10.1177/1535370213503274
- ↑Park H, Karajanagi S, Wolak K, Aanestad J, Daheron L, Kobler JB, et al. Three-dimensional hydrogel model using adipose-derived stem cells for vocal fold augmentation. Tissue Eng – Part A. 2010;16(2):535–43. DOI: 10.1089/ten.TEA.2009.0029
- ↑Flynn L, Prestwich GD, Semple JL, Woodhouse KA. Adipose tissue engineering with naturally derived scaffolds and adipose-derived stem cells. Biomaterials. 2007;28(26):3834–42. DOI: 10.1016/j.biomaterials.2007.05.002
- ↑Chung E, Rytlewski JA, Merchant AG, Dhada KS, Lewis EW, Suggs LJ. Fibrin-based 3D matrices induce angiogenic behavior of adipose-derived stem cells. Acta Biomater. 2015;17:78–88. DOI: 10.1016/j.actbio.2015.01.012
- ↑Mohamed M, Gomanthysankar S, Mat Saad AZ, Noorsal K, Halim AS. Viability of adipose-derived stem cells (ASCs) on porous chitosan scaffold. Int J Pharm Sci Res. 2015;6(9):3781–1787.https://doi.org/10.13040/IJPSR.0975-8232.6(9).3781-87.
- ↑Wahl E, Fierro F, Peavy T, Hopfner U, Dye J, Machens H-G, et al. In vitro evaluation of scaffolds for the delivery of mesenchymal stem cells to wounds. BioMed Research International. 2015; 1-14.DOI: 10.1155/2015/108571
- ↑Ghorbani FM, Kaffashi B, Shokrollahi P, Seyedjafari E, Ardeshirylajimi A. PCL/chitosan/Zn-doped nHA electrospun nanocomposite scaffold promotes adipose derived stem cells adhesion and proliferation. Carbohydr Polym. 2015 Mar 15;118:133–42. DOI: 10.1016/j.carbpol.2014.10.071
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Camilo Andrés Alfonso Rodríguez. Coordinador posgrado en periodoncia. Universidad Antonio Nariño. Carrera 3 Este # 47 A – 15 · Bogotá, Colombia. E-mail: kamilolfonso@uan.edu.co