Cartas al Editor
Síndrome de DRESS inducido por dronedarona
DRESS Syndrome induced by dronedarone
Actual. Med. 2013; 98: (790): 173-174
Enviado:22-10-2013
Revisado:01-12-2013
Aceptado:16-12-2013
Leer Artículo Completo
Estimado Editor,
El Síndrome DRESS (Drug Related Eosinophylia with Sistemic Symptoms) constituye una reacción medicamentosa potencialmente fatal con una tríada formada por rash, alteraciones hematológicas (eosinofilia y adenopatías) y compromiso visceral (hepatitis, nefritis, neumonitis o carditis) (1),(2). Tiene una mortalidad del 10 al 30% (3).
Se presenta el caso de un paciente varón de 52 años de edad, con antecedentes personales de hipertensión arterial e hiperuricemia en tratamiento habitual con bisoprolol, torasemida, ramipril, alopurinol, AINEs e IECAs. Acude al servicio de urgencias por malestar general acompañado de eritrodermia y fiebre. El paciente refirió que cuatro semanas antes había iniciado tratamiento con dronedarona y acenocumarol por un episodio de fibrilación auricular paroxística.
A la exploración física destacaba un paciente eritrodérmico con afectación de más del 80% de la superficie corporal. Sobre el fondo eritrodérmico se apreciaban pápulas confluentes algunas de ellas foliculares distribuidas en tronco y miembros superiores e inferiores, en algunas zonas dejando islotes de piel sana. A nivel facial fue llamativa la descamación (Figura 1). No se evidenció afectación palmo plantar ni de mucosas.
Figura 1 (a y b). En la exploración física destaca la presencia de pápulas confluentes sobre una base eritematosa en parte superior de tronco y brazos, dejando en algunas zonas islotes de piel sana. Destaca la descamación facial.
En la analítica de urgencias destacó una esosinofilia del 14% así como una marcada elevación de las transaminasas GOT 432 UI/l, GPT 537 UI/l, GGT 537 UI/l y lactato deshidrogenasa (LDH) 2179 UI/l. Se realizó ecografía hepática en la que se observó esteatosis hepática moderada. Serologías de VIH, CMV, VHB, VHA, VHC y Epstein Barr negativas. Se realizó una biopsia cutánea que mostró epidermis con ligera espongiosis, abundantes queratinocitos apoptóticos, ligero edema de dermis superficial e infiltrado linfocitario denso (Figura2). Se solicitó un test de transformación linfocitaria siendo el resultado negativo para dronedarona y acenocumarol. Ante este resultado se realizaron las pruebas del parche con dronedarona y acenocumarol siendo positiva para dronedarona compatible con el diagnostico de síndrome de DRESS inducido por dronedarona.
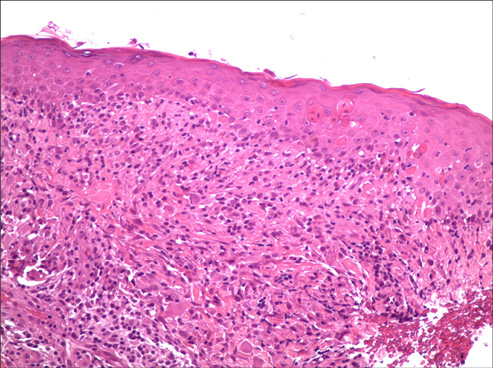
Figura 2. En el estudio histológico podemos observar la epidermis con ligera espongiosis, abundantes queratinocitos apoptóticos, ligero edema de dermis superficial e infiltrado linfocitario denso (Hematoxilina- eosina x 100)
Al ingreso se retiraron los fármacos sospechosos: dronedarona así como acenocumarol por INR de 7.4. Se inició tratamiento sintomático y de soporte con antipiréticos orales (paracetamol 1 g/8 h), anticoagulación con enoxaparina 4000 UI cada 24 horas y 40 mg diarios de prednisona.
A lo largo de su evolución las transaminasas fueron disminuyendo, y el paciente mejoró de la sintomatología, desapareciendo la fiebre y resolviéndose el cuadro dermatológico en aproximadamente 10 días.
El síndrome de DRESS presenta manifestaciones cutáneas en más del 90% de los casos. Por definición, los medicamentos son la causa del DRESS, habitualmente de 1 a 6 semanas posterior a la exposición del individuo a éstos. Existe una alta prevalencia de erupción secundaria a drogas en pacientes con infección por virus, aunque su mecanismo aún no es bien conocido. Se menciona que las infecciones virales pueden cambiar el metabolismo de los medicamentos o actuar como señal de alarma activando la respuesta inmune del huésped. Los virus implicados son virus herpes tipo 6, Epstein Barr, citomegalovirus, y VIH (4),(5).
La piel es un órgano que contiene isotipos del citocromo p450, además de ser un órgano inmunológicamente activo por la presencia de células de Langerhans, lo que la hace susceptible a reacciones secundarias a medicamentos. Se sugiere además la implicación de mecanismos de hipersensibilidad celular o de tipo IV mediada por linfocitos T (6).
El tratamiento más efectivo del síndrome de DRESS es la suspensión del fármaco desencadenante, el soporte sistémico (adecuado suministro de oxígeno, hidratación, compensación hemodinámica, entre otros), así como el inicio de terapia con corticoides (13). La dosis recomendada de esteroides varía de 0,5 a 1mg/kg. Este tratamiento mejora rápidamente los síntomas y los parámetros alterados de laboratorio, pero su impacto a largo plazo en el curso de la enfermedad no es conocido.
Puede que el efecto beneficioso de los glucocorticoides se deba a la inhibición de la IL5 en el proceso de acumulación de eosinófilos, como se ha demostrado en el síndrome hipereosinofílico (7),(8).
Otras posibilidades son: ciclosporina, inmunoglobulina humana, talidomida, interferón y n-acetilcisteína, que ha sido empleada para la detoxificación de múltiples medicamentos (9).
El test de transformación linfocitaria tiene una sensibilidad general en el intervalo de 60-70% y un conjunto especificidad de al menos 85%. Un resultado positivo LTT ayuda para definir el fármaco causante en la reacción de hipersensibilidad al fármaco, sin embargo, como la sensibilidad de la LTT es limitada, un resultado negativo no puede excluir hipersensibilidad al fármaco (10). Consecuentemente, el diagnóstico de fármaco hipersensibilidad debe basarse en una combinación de la historia y diferentes pruebas, ya que ninguna de las pruebas disponibles solo tiene sensibilidad suficientemente bueno.
Ante un paciente que ha introducido recientemente varios fármacos a la vez se recomienda la realización de la prueba del parche, que es barata e inocua para el paciente.
En nuestro paciente se obtuvo una evolución favorable con la suspensión del fármaco implicado más la corticoterapia inmediata y las medidas de sostén. Hasta la fecha no hay casos publicados de síndrome de DRESS asociados a dronedarona.
REFERENCIAS
- Rademarker M.: Drug Hypersensivity Syndrome. The New Zeland Dermatological Society Incorporated, 2005.
- Mikko T, Yoko Y, Masaki Y y col.Severe hypersensivity syndrome due to sulfasalazine associated with reactivation of Human Herpes Virus 6. Arch Dermatol 1998; 134: 1113-1117.
- Ghislain PD, Roujeau JC. Treatment of severe drug reactions: Stevens-Johnson Syndrome, Toxic Epidermal Necrolysis and Hypersensitivity syndrome. Dermatology Online Journal 2002; 8 (1): 5
- Wong GA, Shear NH : Is a drug alone sufficient to cause the drug hypersensivity syndrome?. Arch Dermatol 2004; 140: 226-30.
- Yong Chang J, Soo-Chan K.: Anticonvulsivant Hypersensitivity syndrome associated with Epstein Barr Virus Reaction. Yonsei Med J 2007, 48: (2) 317-320.
- Shapiro L, Shear N. : Mechanisms of drug reactions: the metabolic track. Sem Cutan Surg 1996; 15:217-27.
- Weller PF, Bubley GJ.: The idiopathic hypereosinophilic syndrome. Blood 1994;83: 2759-79.
- Redondo P, De Felipe I, De la Pena A. y col.: Drug Induced hypersensitivity syndrome and toxic epidermal necrolysis: Treatment with N- acetylcisteine. Br J Dermatol 1997;136: 645-6
- Krauss G.: Current Understanding of Delayed Anticonvulsant Hypersensitivity Reactions. Epilepsy Currents 2006; 6 (2): 33-37
- Pichler WJ, Tilch J. The lymphocyte transformation test in the diagnosis of drug hypersensitivity. Allergy. 2004;59:809-20
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Cristina Garrido Colmenero. Dermatología Médico Quirúrgica y Venereología. Hospital Universitario Virgen de las Nieves. Avda. Fuerzas Armadas, 2 · 18012 Granada. E-mail: cristinagarrido86@gmail.com