Original
Rendimiento Diagnóstico de las Arteriografías de Control en las Hemorragias Subaracnoideas Angiográficamente Negativas
Diagnostic value of control arteriographs in angiographically negative subaracnoidal hemorrhages
Actual. Med. 2017; 102: (800). Supl. 19-48
RESUMEN
La hemorragia subaracnoidea (HSA) espontánea supone el 5% de los accidentes cerebrovasculares, es uno de los más graves, y continúa teniendo una importante morbimortalidad pese a los grandes avances médicos. La mayoría son consecuencia de la rotura de un aneurisma cerebral, pero en algunos casos no se encuentra la causa subyacente.
Objetivos: Evaluar la utilidad de la arteriografía cerebral de control en las HSA angiográficamente negativas, y valorar qué pacientes se beneficiarían de un estudio de control.
Métodos: Se realizó un estudio retrospectivo y descriptivo los pacientes diagnosticados de HSA (CIE-10=160) en el Hospital Universitario Puerta del Mar de Cádiz, en el período comprendido entre enero de 2008 y octubre de 2014. Se recogieron las variables sociodemográficas de cada paciente, y se realizó un análisis estadístico con contraste de hipótesis.
Resultados: 188 de 261 pacientes diagnosticados de HSA (72%), fueron sometidos a una arteriografía inicial, de las cuales 59 fueron negativas. De estos 59 pacientes, 19 fueron sometidos a una arteriografía de control, que resultó negativa en todos los casos (Media de tiempo interestudio: 6 meses. Rango: 3 -12 meses).
Conclusiones: La arteriografía de control realizada a los 3-12 meses tras la arteriografía inicial no es una herramienta de utilidad en el seguimiento diagnóstico en pacientes con HSA idiopática. Sin embargo podrían ser candidatos a un estudio de control aquellos pacientes con un sangrado difuso, altos grados de Fisher y Hunt y Hess, y en los que fuera posible repetir la prueba antes de los 30 días.
Palabras clave: Hemorragia subaracnoidea espontánea, arteriografía cerebral, aneurisma intracraneal.
ABSTRACT
Spontaneous subarachnoid haemorrhage (SAH) accounts for 5% of strokes, is one of the most serious, and continues to have a significant morbidity and mortality despite major medical advances. Most are the result of a ruptured cerebral aneurysm, but in some cases the underlying cause is not found.
Objectives: To evaluate the usefulness of control cerebral arteriography in angiographically negative SAH, and to assess which patients may benefit from a control study.
Methods: A retrospective and descriptive study was carried out on the patients diagnosed with SAH (ICD-10 = 160) at the Puerta del Mar University Hospital, in Cadiz, from January 2008 to October 2014. The sociodemographic variables of each patient were collected, and a statistical analysis was performed with hypothesis contrast.
Results: 188 of 261 patients diagnosed with SAH (72%) underwent an initial arteriography, of which 59 were negative. Of these 59 patients, 19 underwent a control arteriography, which was negative in all cases (Time between studies: 6 months. Range: 3 – 12 months).
Conclusions: Control arteriography performed at 3-12 months after initial arteriography is not a useful tool for diagnostic follow-up in patients with idiopathic SAH. However, patients with diffuse bleeding, high degrees of Fisher and Hunt and Hess scale, and in whom it was possible to repeat the test before 30 days, could be candidates for a control study.
Keywords: vertebral artery, arteriovenous fistula, covered stent
Leer Artículo Completo
INTRODUCCIÓN
La hemorragia subaracnoidea (HSA) espontánea constituye hoy en día una de las enfermedades cerebrovasculares más graves (1). La mayoría son consecuencia de la rotura de un aneurisma cerebral (80-90%) (3-8,10,11). Su incidencia es de aproximadamente 10 casos por cada 100.000 habitantes y año (1) (con grandes diferencias entre países) (2); y conlleva un 45% de mortalidad en el primer mes (3-8). De éstos, el 10-15% fallece antes de llegar al hospital, un 37% dentro de las primeras 24 horas, el 60% en las primeras 48h, y el 75% en la primera semana (2). Sobre un 10-15% muere antes de poder recibir atención médica7. Además, un 10-20% de los supervivientes queda con una discapacidad importante9.
Ante la sospecha clínica de HSA, la primera prueba diagnóstica a realizar es una tomografía axial computarizada (TAC) cerebral, la cual tiene una sensibilidad del 95% realizada en las primeras 24h del evento; En caso de negatividad se realiza una punción lumbar. La condición clínica se clasifica según la escala pronóstica de Hunt y Hess, y la cantidad de sangre observada en la TAC según la escala de Fisher (7).
Tras establecer el diagnóstico de HSA, se debe realizar un estudio vascular con el objetivo de investigar el origen de la misma, puesto que como hemos dicho, un 80-90% son consecuencia de la rotura de un aneurisma cerebral (3-8.10,12). Hoy en día existen tres métodos: la angiografía por TAC (Angio-TC), la angiografía por resonancia magnética (Angio-RM) y la angiografía por cateterización intraarterial directa (arteriografía convencional) (7). Diversos estudios han evaluado la eficacia, riesgos y ventajas de dichos métodos, tanto de forma aislada como combinados entre sí (3-7). Comparando con la AngioRM, la AngioTC conlleva una exposición radiológica y precisa de la inyección de un contraste yodado, pero es mucho más simple de realizar, y existe una mayor disponibilidad de dicha prueba en la mayoría de los servicios de urgencias (10). La arteriografía cerebral continúa siendo la principal prueba diagnóstica (gold standard), pero es la más invasiva de las tres.
En un 3 a 36% de los casos los exámenes neurovasculares iniciales son negativos, es decir, que no revelan ninguna causa vascular subyacente (3-6). Según datos publicados por el Grupo de Trabajo de Patología Vascular de la Sociedad Española de Neurocirugía la frecuencia de enfermos con HSA idiopática (HSAi) o, lo que es lo mismo, en los que no se encuentra la causa subyacente del sangrado, es mayor en España que en otros países (14,15).
Por otra parte, aquellos pacientes ya diagnosticados de HSA con estudio arteriográfico negativo inicial, no siempre tienen una buena evolución (11,16-18). Se han diferenciado dos tipos de HSA dentro de este grupo, principalmente las HSA perimesencefálicas y las HSA difusas (3-6,10,17-20). Los pacientes con patrón difuso pueden desarrollar isquemia secundaria y tienen un 10% de riesgo de resangrado, mientras que en las perimesencefálicas la evolución suele ser mejor (11,21-24). Sólo el 76% de los pacientes con patrón difuso logran una recuperación completa, comparado con el 96,7% alcanzado por los pacientes con patrón perimesencefálico (15). Por ello, algunos autores consideran que no es preciso repetir la arteriografía en pacientes con HSA perimesencefálica (3-6,19,20,26). Sin embargos otros aconsejan una segunda valoración de las arteriografías negativas por otro especialista (e incluso por el mismo especialista en un segundo tiempo) (3,8,12,17). La recomendación más habitual, descrita en la literatura, es la realización de la arteriografía de control ante un primer estudio negativo (3-6,11,12,18,23,29).
Objetivos
Pretendemos evaluar la utilidad de la arteriografía cerebral de control en las HSA angiográficamente negativas. También se intentará analizar los factores que pudiesen influir en un resultado negativo en la arteriografía inicial y así intentar determinar qué pacientes serían candidatos ideales para una arteriografía de control.
MATERIAL Y MÉTODO
Diseño.
Se realizó un estudio descriptivo y retrospectivo, de una serie de longitudinal de pacientes con HSA espontánea en la provincia de Cádiz, España. El presente estudio se ha llevado a cabo en servicio de Neurocirugía del Hospital Universitario Puerta del Mar (HUPM) de Cádiz que atiende a una población de alrededor de un millón trescientos mil habitantes, pues se suman las poblaciones de Ceuta y Gibraltar.
Se seleccionaron todos los pacientes diagnosticados de HSA (Clasificación Internacional de enfermedades: CIE-10 = 160) y que cumplieron los demás criterios de inclusión y exclusión (Tabla 1), en el periodo comprendido entre el 1 de enero de 2008 hasta el 31 de octubre de 2014 en el HUPM de Cádiz.
Tabla 1. Criterios de Inclusión y Exclusión.
Las arteriografías se realizaron con el sistema de radiología convencional Siemens Artis Zee floor-mounted® 2008 (Múnich, Baviera, Alemania). De cada paciente se obtuvieron las imágenes en los planos anteroposterior, lateral y rotacional. Posteriormente se llevó a cabo una reconstrucción en 3D con la estación de trabajo Siemens Leonardo® (Múnich, Baviera, Alemania). El contraste empleado en todos los casos fue iodixanol Visipaque® (contraste yodado hidrosoluble 320 mg/ml).
Variables de investigación.
Las variables recogidas fueron las siguientes: Sexo, edad, fecha de ingreso, fecha de inicio de la HSA, presencia de factores de riesgo (dislipemia, diabetes mellitus, tabaquismo, hipertensión arterial (HTA), antecedentes familiares de aneurismas, otros antecedentes importantes), localización/hallazgos de la TAC (Normal – TAC negativo, perimesencefálica, difusa, surco periférico), grado de la escala de Hunt & Hess (I, II, III, IV, V), grado de la escala de Fisher (I, II, III, IV), descripción de si fue realizado un Angio-TC (sí o no), descripción de si fue realizada una arteriografía (sí o no), fecha de primera arteriografía, descripción original de los resultados de la primera arteriografía (positiva o negativa), descripción de la segunda valoración de la primera arteriografía (positiva o negativa), reacciones adversas a la arteriografía, prueba vascular realizada tras la primera arteriografía negativa (ninguna, arteriografía convencional, angio-RM, angio-TC, arteriografía convencional + angioRM, arteriografía convencional + angio-TC, angio-RM + angio-TC), fecha de segunda arteriografía convencional, descripción original de los resultados de la segunda arteriografía (positiva o negativa), descripción de la segunda valoración de la segunda arteriografía (positiva o negativa), fecha del alta hospitalaria, fecha del exitus.
Metodología de la revisión bibliográfica.
Se realizó una búsqueda bibliográfica en MEDLINE (PubMed) con los siguientes MeSH (Medical Subject Headings): “subarachnoid haemorrhage”, “intracranial aneurysm”, “aneurysm, ruptured”, “angiography”, y se combinaron con las palabras “negative”, “diffuse”, “perimesencephalic”, “idiopathic”. La búsqueda se limitó para artículos referentes a humanos, revisiones sistemáticas y presentaciones de casos, y que se encontraran como artículos completos.
Recogida y análisis de los datos
Los datos demográficos, así como los datos del ingreso de cada paciente, se obtuvieron del Sistema Integrado de Documentación Estación Clínica DAE® v.3.14.1. Las imágenes radiológicas se revisaron a partir del sistema de visualización DICOM IRE Rad Vision Pro® (San Sebastián de los Reyes, Madrid, España). Se recogió la información en una base de datos confeccionada con el programa Microsoft Access 2010 (Redmond, WA, EEUU), que incluyó todas las variables definidas anteriormente.
Cada arteriografía (tanto las iniciales como las de control) fue revisada por un facultativo diferente al que emitió el primer diagnóstico, con especial atención al territorio vascular correspondiente a la zona de sangrado, y se contrastaron los informes para confirmar su negatividad y la concordancia interobservador (índice Kappa). Éste último fue superior al 95%.
El análisis descriptivo se realizó con el programa SPSS® v.15 (IBM Chicago, IL, EEUU), valorando principalmente la media, mediana, moda, desviación típica y el coeficiente de variación para las variables numéricas. Para contrastar variables se utilizaron tablas de contingencia para las variables categóricas, gráficos comparativos y de dispersión para variables mixtas (cuantitativas y categóricas), y análisis multivariable para variables cuantitativas. Los resultados de las variables cualitativas se expresaron como números absolutos o porcentajes. Los resultados de las variables cuantitativas se expresaron mediante medias e intervalo de confianza al 95%. La comparación de las variables categóricas se hizo mediante la prueba de Chi cuadrado con corrección de Yates o mediante el test exacto de Fisher. La comparación de variables cuantitativa y cualitativa se realizó mediante en test ANOVA en las variables no dicotómicas y T de Student en las dicotómicas; cuando no se cumplieron las condiciones de homogeneidad de la varianza se utilizaron los tests no paramétricos de Kruskal-Wallis y de la U de Mann Whitney. La influencia de la asociación entre los parámetros cuantitativos determinados se evaluó mediante el coeficiente de correlación de Pearson. La variabilidad interobservador fue valorada con el coeficiente Kappa. Se estableció previamente el nivel de significatividad en el del 95% (p<0.05).
RESULTADOS
Se presentaron un total de 261 pacientes con HSA espontánea en la provincia de Cádiz durante el período estudiado. La media de edad fue de 54.6 años (la moda fue 51, la mediana 54, y el rango fue de 20 a 108 años). 116 pacientes fueron hombres (44.4%) y 145 fueron mujeres (55.5%). Se obtuvo una imagen de TAC de todos los pacientes el día de ingreso (261 TC).
188 pacientes (72% de las HSA) fueron sometidos a una arteriografía inicial. De éstos, 59 pacientes (el 21.4% de los 188 pacientes con arteriografía inicial) presentaron un resultado negativo, es decir, no se observó ninguna causa vascular subyacente (la mayoría de estos fueron sometidos previamente a un Angio-TC, que fue negativo en todos los casos).
De estos 59 pacientes, 36 fueron hombres (61%) y 23 fueron mujeres (39%). La media de edad fue de 56 años, con dos modas (48 y 69 años); la mediana fue 54 años, con un rango de edad comprendido entre 30 y 76 años.
En cuanto a la localización del sangrado, la imagen obtenida por TAC fue negativa en 2 casos, 18 pacientes presentaron una hemorragia perimesencefálica, 37 un patrón difuso, y tan solo 2 pacientes presentaron una hemorragia limitada a surcos periféricos (3.4%, 30.5%, 62.7% y 3.4% respectivamente).
A pesar de que la arteriografía de control fue negativa para causa vascular, 15 pacientes (25.4%) presentaron alguna variante de la normalidad igualmente presente en la arteriografía inicial (espasmo arterial, dilatación infundibular, origen arterial fetal, hipoplasia, higroma subdural).
7 de estos 59 pacientes presentaron complicaciones asociadas a la HSA (11.9% frente al 45.7% de complicaciones en aquellos con arteriografía inicial positiva): tres de ellos presentaron hidrocefalia, dos vasoespasmo y, dos con hidrocefalia y vasoespasmo; de los cuales, cuatro pacientes presentaron además paresia de pares craneales, bacteriemia, disfasia y estenosis de arterias cerebrales.
19 de estos 59 pacientes (32.2%) fueron sometidos a una segunda arteriografía, con una media de tiempo transcurrido entre ésta y la primera arteriografía de 6 meses (moda de 3 meses, y rango comprendido entre los 3 y 12 meses). Los pacientes con HSA perimesencefálica fueron sometidos a una segunda arteriografía con una frecuencia ligeramente superior que aquellos con un patrón difuso (33.3% frente al 32.4%, respectivamente). Todos los pacientes obtuvieron un resultado negativo en la segunda arteriografía.
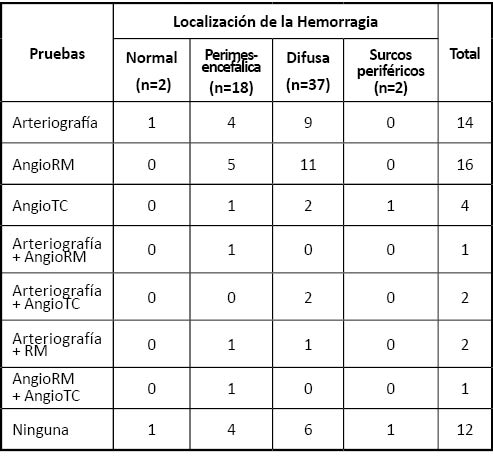
En la Tabla 2 se expone la localización de las HSA observadas y las pruebas a las que fueron sometidos los pacientes que tuvieron un resultado negativo en la primera arteriografía.
Tabla 2. Pruebas realizadas tras la arteriografía inicial negativa según el patrón de la HSA
Todas las pruebas realizadas tras la primera arteriografía negativa fueron igualmente negativas para una causa vascular de la hemorragia. Ningún paciente fue sometido a una tercera arteriografía.
Se realizó un contraste de hipótesis con el test de chi-cuadrado entre la negatividad de la primera arteriografía y distintas variables: Al comparar con el grado de Fisher en la TAC inicial, se observó una mayor proporción de hemorragias grado II y III en las arteriografías negativas, siendo menos frecuente el grado IV (p=0.008). Al comparar con el grado de Hunt & Hess, se observó una mayor proporción de pacientes con grados I y II (p=0.00). También se realizó el contraste con el sexo, observándose una mayor proporción de varones; así como el contraste con los antecedentes del paciente, observándose una mayor proporción de estudios negativos en no hipertensos, no fumadores y en alcohólicos (p=0.004, p=0.011, p=0.001 y p=0.045, respectivamente). La presencia de vasoespasmo y de otras complicaciones fueron menos frecuentes en paciente con arteriografía negativa (p=0.02 y p=0.001, respectivamente). No se demostró relación estadísticamente significativa con el antecedente de dislipemia/obesidad, diabetes mellitus, drogas, otros antecedentes y la presencia de hidrocefalia durante el ingreso. Al aplicar la prueba T de student, no hallamos una relación estadísticamente significativa entre la primera arteriografía negativa y la edad del paciente (p=0.314).
En el análisis de contraste de hipótesis para relacionar las mismas variables expuestas en el párrafo anterior con la realización de la segunda arteriografía (resultado negativo), encontrándose una relación estadísticamente significativa solo para el tabaquismo, específicamente con los no fumadores (p=0.025). No se halló relación con ninguna de las demás variables.
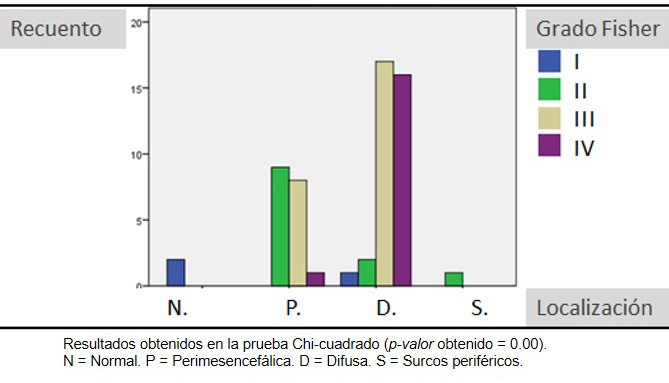
En cuanto al contraste entre el patrón de sangrado en la TAC y las demás variables estudiadas, se observó una clara relación entre ésta y el grado de la escala de Fisher (p=0.00) (Figura 1). Los pacientes con una hemorragia difusa tuvieron un grado Fisher más elevado (III y IV) que aquellos con un patrón perimesencefálico (II y, menos frecuente, III).
Figura 1.
El coeficiente de concordancia interobservador Kappa fue del 100% para la negatividad de las arteriografías.
Sólo dos pacientes presentaron alguna reacción adversa a la arteriografía: reacción alérgica al contraste yodado (no especificada) y una estenosis de la arteria femoral. Ningún paciente presentó ceguera cortical transitoria secundaria a la arteriografía.
DISCUSIÓN
El porcentaje de HSA idiopáticas (HSAi), 21.4%, es similar al presentado por estudios españoles e italianos, y ligeramente por encima de los resultados presentados en otros países (Estados Unidos, Canadá, Korea del Sur, Gran Bretaña) (3-7,10-12,14-24,29).
A pesar de que la incidencia de HSA es mayor en mujeres que en hombres, la incidencia de HSAi es mayor en hombres que en mujeres (61% frente al 39%), tal como lo refieren la mayoría de estudios (2-7,9,10,14-,17,20,22-24). La media de edad entre los pacientes con HSAi (56 años) también es similar (3-6,11,1518,21-24,26). De igual modo, la proporción de los diferentes patrones de sangrado en las HSAi se corresponde, de forma aproximada, con lo descrito hasta ahora en la literatura (4,5,10,15-17,20-23).
Entre las características de los pacientes que más influyen en un resultado negativo en la primera arteriografía se encuentran: los grados intermedios de Fisher y los bajos de Hunt & Hess, los pacientes varones, los no hipertensos, los no fumadores y los alcohólicos.
La menor frecuencia de vasoespasmo y de otras complicaciones, puede indicar que pacientes con este perfil se beneficiarían de otra prueba vascular diagnóstica en lugar de una arteriografía, como la angioRM o el angioTC. Por otro lado, tan solo encontramos un falso negativo que fue positivo en el angioTC posterior, lo cual corrobora la baja tasa de falsos negativos de la arteriografía inicial descrita en la bibliografía (17,18), y el posible beneficio de otra prueba menos invasiva en su lugar.
En cuanto a la realización de una segunda arteriografía, podríamos decir que menos pacientes de lo esperado fueron sometidos a ella. Dentro de las razones se halló que no llegó a realizarse la segunda arteriografía solicitada (por haber fallecido, o cambiar de área hospitalaria), o porque se solicitó otro estudio en su lugar (angioRM o angioTC). A pesar de ello, encontramos un 0% de segundas arteriografías positivas, es decir, no se encontró ninguna causa vascular de la hemorragia en ninguna de las arteriografías de control realizadas. Estos resultados no se corresponden, en general, con estudios anteriores en los que encontramos un rendimiento diagnóstico bajo de una segunda arteriografía (aproximadamente un 10%) (5,6,12,17-20), pero tan ínfimos como el 0% descrito en nuestra serie.
Sin embargo, estas conclusiones no son del todo fiables, debido al carácter retrospectivo del estudio, probablemente el tiempo transcurrido entre la primera y la segunda arteriografía (puesto que en la mayoría de estudios no supera los treinta días (5-7,12,16-18,22,23,29), frente a los seis meses de media obtenidos), y no existir una homogeneidad en las proporciones de arteriografías de control en los distintos patrones de HSA (se observó una pequeña mayor proporción de segundas arteriografías en pacientes con HSA perimesencefálicas). En relación a esto último, muchos autores recomiendan únicamente el seguimiento diagnóstico con arteriografía en determinadas HSA perimesencefálicas (aquellas en las que el radiólogo sospeche causa vascular a pesar de la negatividad del estudio inicial) (5,6,10,16-20,22,23,26) y, por el contrario, en las HSA difusas se recomienda un seguimiento con un estudio de imagen vascular (en la mayoría de los casos invasivo, la arteriografía convencional) (1,4-7,10,12.13,16-18,23,24,26,29). Otra razón de baja fiabilidad es la presencia de variantes de la normalidad, no considerados como patologías vasculares en sí. Estas variantes fueron halladas en un 25.4% de los pacientes con arteriografía inicial negativa, y podrían asociarse al sangrado según la hipótesis ya referida en varios estudios (1,3-6,10-12,16-18,22,26).
Observamos que en todas las arteriografías de control (100% negativas), todos los pacientes fueron no fumadores, lo cual hace que nos preguntemos nuevamente si la condición de no fumador indicaría un posible beneficio a favor de otras pruebas menos agresivas que la arteriografía.
El bajo porcentaje de complicaciones del sangrado, el menor grado de Fisher observados en pacientes con arteriografía inicial negativa (sobre todo el bajo grado de Fisher de las HSA perimesencefálicas respecto a las difusas), en comparación con el hallado en pacientes con arteriografía positiva, confirma una vez más la menor morbilidad de las HSAi (7,10,11,14-17,20-,22,24,26,29).
CONCLUSIONES
La arteriografía de control tras la arteriografía inicial, no es una herramienta de utilidad en el seguimiento de pacientes con HSAi.
A pesar de la alta morbilidad y mortalidad de la HSA en general, los pacientes con bajo grado en la escala de Fisher (concretamente con patrón de sangrado perimesencefálico) y de Hunt & Hess, varones, alcohólicos, no hipertensos, y no fumadores, podrían beneficiarse de otra prueba (angioRM, angioTC) en lugar de la arteriografía convencional. Por tanto, los pacientes candidatos a una arteriografía de control podrían ser aquellos con un sangrado difuso, con alto grado Fisher y Hunt & Hess, y en los que fuera posible repetir la prueba de forma precoz (antes de los 30 días).
AGRADECIMIENTOS
Nuestro agradecimiento y reconocimiento al Servicio de Radiología del Hospital Puerta del Mar de Cádiz.
REFERENCIAS
- Kirkpatrick PJ. Subarachnoid haemorrhage and intracranial aneurysms: what neurologists need to know. J Neurol Neurosurg Psychiatry [revista electrónica]. 2002;73(Suppl I):i28–i33 [consultado 27 Abr 2015]. disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1765595/
- Ingall T, Asplund K, Mähönen M, Bonita R. A Multinational Comparison of Subarachnoid Hemorrhage Epidemiology in the WHO MONICA Stroke Study. Stroke [revista electrónica]. 2000;31(5):1054–61 [consultado 27 Abr 2015] Disponible en: http://stroke.ahajournals.org/content/31/5/1054
- Delgado Almandoz JE, Crandall BM, Fease JL, Scholz JM, Anderson RE, Kadkhodayan Y, et al. Diagnostic yield of catheter angiography in patients with subarachnoid hemorrhage and negative initial noninvasive neurovascular examinations. AJNR Am J Neuroradiol [revista electrónica]. 2013;34(4):833–9 [consultado 27 Abr 2015]. Disponible en: http://www.ajnr.org/content/34/4/833.long
- Delgado Almandoz JE, Jagadeesan BD, Refai D, Moran CJ, Cross DT, Chicoine MR, et al. Diagnostic yield of computed tomography angiography and magnetic resonance angiography in patients with catheter angiography-negative subarachnoid hemorrhage. J Neurosurg [revista electrónica]. 2012; 117(2):309–15 [consultado 27 Abr 2015]. Disponible en: http://thejns.org/doi/full/10.3171/2012.4.JNS112306
- Delgado Almandoz JE, Jagadeesan BD, Refai D, Moran CJ, Cross DT, Chicoine MR, et al. Diagnostic yield of repeat catheter angiography in patients with catheter and computed tomography angiography negative subarachnoid hemorrhage. Neurosurgery. 2012;70(5):1135-42.
- Delgado Almandoz JE, Kadkhodayan Y, Crandall BM, Scholz JM, Fease JL, Anderson RE, et al. Diagnostic yield of delayed neurovascular imaging in patients with subarachnoid hemorrhage, negative initial CT and catheter
- angiograms, and a negative 7 day repeat catheter angiogram. J Neurointerv Surg [revista electrónica]. 2014;6(8):637-42 [consultado 22 Abr 2015]. Disponible en: http://jnis.bmj.com/content/early/2013/10/22/neurintsurg-2013-010896.long
- Brisman JL, Song JK, Newell DW. Cerebral aneurysms. N Engl J Med [revista electrónica]. 2006;355(9):928–39 [consultado 27 Abr 2015]. Disponible en: http://www.nejm.org/doi/full/10.1056/NEJMra052760
- Westerlaan HE, van Dijk JM, Jansen-van der Weide MC, de Groot JC, Groen RJ, Mooij JJ, et al. Intracranial aneurysms in patients with subarachnoid hemorrhage: CT angiography as a primary examination tool for diagnosis. Systematic review and meta-analysis. Radiology [revista electrónica]. 2011;258(1):134-45 [consultado 27 Abr 2015]. Disponible en: http://pubs.rsna.org/doi/full/10.1148/radiol.10092373
- Hop JW, Rinkel GJ, Algra A, van Gijn J. Case-fatality rates and functional outcome after subarachnoid hemorrhage: a systematic review. Stroke [revisa electrónica]. 1997;28(3):660-4 [consultado 27 Abr 2015]. Disponible en: http://stroke.ahajournals.org/content/28/3/660.long
- van Gijn J, Rinkel GJ. Subarachnoid haemorrhage: diagnosis, causes and management. Brain [revista electrónica]. 2001;124(Pt 2):249-78 [consultado 27 Abr 2015]. Disponible en: http://brain.oxfordjournals.org/content/124/2/249.long
- Boswell S, Thorell W, Gogela S, Lyden E, Surdell D. Angiogram-negative subarachnoid hemorrhage: outcomes data and review of the literature. J Stroke Cerebrovasc Dis [revista electrónica]. 2013;22(6):750-7 [consultado 27 Abr 2015]. Disponible en: http://www.strokejournal.org/article/S10523057(12)00038-9/fulltext
- Bakker NA, Groen RJ, Foumani M, Uyttenboogaart M, Eshghi OS, Metzemaekers JD, et al. Repeat digital subtraction angiography after a negative baseline assessment in nonperimesencephalic subarachnoid hemorrhage: a pooled data meta-analysis. A systematic review. J Neurosurg [revista electrónica]. 2014;120(1):99-103 [consultado 27 Abr 2015]. Disponible en: http://thejns.org/doi/pdf/10.3171/2013.9.JNS131337
- Lim LK, Dowling RJ, Yan B, Mitchell PJ. Can CT angiography rule out aneurysmal subarachnoid haemorrhage in CT scan-negative subarachnoid haemorrhage patients? J Clin Neurosci [revista electrónica]. 2014;21(1):191-3 [consultado 27 Abr 2015]. Disponible en: http://www.jocnjournal.com/article/S0967-5868(13)00267-1/fulltext
- Lagares A, Toledo P de, Fernández-Alén JA, Ibáñez J, Arikan F, Sarabia R, et al. Base de datos multicéntrica de hemorragia subaracnoidea espontánea del Grupo de Trabajo de Patología Vascular de la Sociedad Española de
- Neurocirugía: presentación, criterios de inclusión y desarrollo de una base de datos en internet. Neurocirugía [revista electrónica]. 2008;19(5):405-15 [consultado 27 Abr 2015]. Disponible en: http://scielo.isciii.es/scielo.php?pid=S113014732008000500001&script=sci_arttext
- Sarabia R, Lagares A, Fernández-Alén JA, Arikan F, Vilalta J, Ibáñez J, et al. Idiopathic subarachnoid hemorrhage: a multicentre series of 220 patients. Neurocirugía [revista electrónica]. 2010;21:441-451 [consultado 27 Abr 2015]. Disponible en: http://www.sciencedirect.com/science/article/pii/S1130147310700944
- Fontanella M, Rainero I, Panciani PP, Schatlo B, Benevello C, Garbossa D, et al. Subarachnoid hemorrhage and negative angiography: clinical course and long-term follow-up. Neurosurg Rev. 2011;34(4):477-84.
- Khan AA, Smith JD, Kirkman MA, Robertson FJ, Wong K, Dott C, et al. Angiogram negative subarachnoid haemorrhage: outcomes and the role of repeat angiography. Clin Neurol Neurosurg [revista electrónica]. 2013;115(8):1470-5 [consultado 27 Abr 2015]. Disponible en: http://www.clineujournal.com/article/S0303-8467(13)00055-3/fulltext
- Yu DW, Jung YJ, Choi BY, Chang CH. Subarachnoid hemorrhage with negative baseline digital subtraction angiography: is repeat digital subtraction angiography necessary? J Cerebrovasc Endovasc Neurosurg [revista electrónica]. 2012;14(3):210-5 [consultado 27 Abr 2015]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3491216/
- Kalra VB, Wu X, Matouk CC, Malhotra A. Use of follow-up imaging in isolated perimesencephalic subarachnoid hemorrhage: a meta-analysis. Stroke [revista electrónica]. 2015;46(2):401-6 [consultado 27 Abr 2015]. Disponible en: http://stroke.ahajournals.org/content/46/2/401.full
- Kapadia A, Schweizer TA, Spears J, Cusimano M, Macdonald RL. Nonaneurysmal perimesencephalic subarachnoid hemorrhage: diagnosis, pathophysiology, clinical characteristics, and long-term outcome. World Neurosurg [revista electrónica]. 2014;82(6):1131-43 [consultado 27 Abr 2015]. Disponible en: http://www.worldneurosurgery.org/article/S18788750(14)00664-0/fulltext
- Kang DH, Park J, Lee SH, Park SH, Kim YS, Hamm IS. Does non perimesencephalic type non-aneurysmal subarachnoid hemorrhage have a benign prognosis? J Clin Neurosci [revista electrónica]. 2009;16(7):904-8 [consultado 27 Abr 2015]. Disponible en: http://www.jocnjournal.com/article/S0967-5868(08)00596-1/fulltext
- Lin N, Zenonos G, Kim AH, Nalbach SV, Du R, Frerichs KU. Angiogram Negative Subarachnoid Hemorrhage: Relationship Between Bleeding Pattern and Clinical Outcome. Neurocrit Care. 2012;16(3):389-98.
- Topcuoglu MA, Ogilvy CS, Carter BS, Buonanno FS, Koroshetz WJ, Singhal AB. Subarachnoid hemorrhage without evident cause on initial angiography studies: diagnostic yield of subsequent angiography and other neuroimaging tests. J Neurosurg [revista electrónica]. 2003;98(6):1235-40 [consultado 27 Abr 2015]. Disponible en: http://thejns.org/doi/pdf/10.3171/jns.2003.98.6.1235
- Woodfield J, Rane N, Cudlip S, Byrne JV. Value of delayed MRI in angiogram negative subarachnoid haemorrhage. Clin Radiol [revista electrónica]. 2014;69(4):350-6 [consultado 27 Abr 2015]. Disponible en: http://www.clinicalradiologyonline.net/article/S0009-9260(13)00515-1/fulltext
- Hui FK, Tumialán LM, Tanaka T, Cawley CM, Zhang YJ. Clinical Differences Between Angiographically Negative, Diffuse Subarachnoid Hemorrhage and Perimesencephalic Subarachnoid Hemorrhage. Neurocrit Care [revista electrónica]. 2009;11(1):64-70 [Abstract] [consultado 27 Abr 2015]. Disponible en: http://www.clinicalradiologyonline.net/article/S0009-9260(13)00515-1/fulltext
- Jung JY, Kim YB, Lee JW, Huh SK, Lee KC. Spontaneous subarachnoid haemorrhage with negative initial angiography: A review of 143 cases. J Clin Neurosci [revista electrónica]. 2006;13(10):1011-7 [consultado 27 Abr 2015]. Disponible en: http://www.jocn-journal.com/article/S0967-5868(06)002232/fulltext
- Vivancos J, Gilo F, Frutos R, Maestre J, García-Pastor A, Quintana F, et al. Guía de actuación clínica en la hemorragia subaracnoidea. Sistemática diagnóstica y tratamiento. Neurología [revista electrónica]. 2014. doi:10.1016/jnrl.2012.07.009 [consultado 27 Abr 2015]. Disponible en: http://www.redheracles.net/media/upload/research/pdf/23044408_Guia1390308599.pdf
- Cardentey-Pereda AL, Pérez-Falero RA. Hemorragia subaracnoidea. Rev Neurol [revista electrónica]. 2002;34(10):954-66 [consultado 27 Abr 2015]. Disponible en: http://www.hapmd.com/home/hapmdcom/public_html/wpcontent/uploads/2009/03/interna/jueves-terapeutica/20110418_hsa_rev_mex.pdf
- Grannan BL, Yanamadala V, Walcott BP, Stapleton CJ, Ogilvy CS. Repeated neurovascular imaging in subarachnoid hemorrhage when initial studies are negative. J Clin Neurosci [revista electrónica]. 2014;21(6):993-6 [consultado 27 Abr 2015]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0967586813006152
- Hunt WE, Hess RM. Surgical risk as related to time of intervention in the repair of intracranial aneurysms. J Neurosurg. 1968; 28: 14-20.
- Guerrero F, Linde CM de la, Pino FI. Manejo general en Cuidados Intensivos del paciente con hemorragia subaracnoidea espontánea. Med Intensiva [revista electrónica]. 2008,32(7):342-353 [consultado 27 Abr 2015]. Disponible en: http://scielo.isciii.es/scielo.php?pid=S021056912008000700004&script=sci_arttext
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Alicia Godoy-Hurtado. Telf 660084911. e-mail: aliciagodoyhurtado@gmail.com