Original
Análisis de biocompatibilidad de cementos ionómero de vidrio de alta viscosidad
Analysis of the biocompatibility of high viscosity glass ionomer cements
Actual. Med. 2017; 102: (802): 151-155 DOI: 10.15568/am.2017.802.or04
Enviado: 07-10-2017
Revisado: 10-10-2017
Aceptado: 08-11-2017
RESUMEN
Objetivo: El objetivo del presente trabajo ha sido analizar la biocompatibilidad de dos cementos ionomero de vidrio de alta viscosidad (CIVAV) en un modelo experimental in vitro de fibroblastos gingivales humanos utilizando criterios morfológicos, bioquímicos y metabólicos.
Metodos: Fibroblastos gingivales humanos fueron cultivados en placa de 24 pocillos en una concentración de 2×105 células/500 µl de medio cultivo DMEM. Las células fueron expuestas, durante 72 horas, a discos de 2 mm de diámetro y 1 mm de espesor de dos CIVAV EQUIA Forte Fil (EFT) (GC Corporation, Japan) y EQUIA Fil (EFL) (GC Corporation, Japan). Para analizar las posibles alteraciones morfológicas, las células fueron examinadas mediante microscopía óptica. Se utilizó para analizar proliferación celular la técnica de WTS-1 y para detectar alteraciones en la membrana nuclear se utilizó test de ADN libre. El control positivo fue fibroblastos cultivados en medio DMEM (CM) y el control negativo fue fibroblastos incubados en 2% tritón X-100 (CT). Para determinar diferencias globales entre todos los grupos experimentales se empleó la prueba de Kruskal-Wallis y una p< 0,05.
Resultados: La microscopía óptica no mostró alteraciones morfológicas en las células expuestas a los ionómeros analizados. Asimismo, la identificación de ADN mostró un comportamiento homogeneo entre EFT, EFL y el control positivo no existiendo diferencias estadísticamente significativas (p<0,05). El análisis de proliferación celular resultó en EFT: 95,73 % y en EFL: 82,61 %, mostrando diferencias estadísticamente significativas entre todos los grupos experimentales (p<0,001).
Conclusión: Los CIVAV muestran un comportamiento de biocompatibilidad aceptable en un modelo experimental in vitro de fibroblastos gingivales humanos. Estos biomateriales podrían ser materiales de elección para resolver de manera más simple obturaciones que necesitan realizarse en cavidades en dentina profunda.
Palabras clave: Biocompatibilidad, cementos de ionómero de vidrio, fibroblastos gingivales humanos.
ABSTRACT
Objetive: The objetive of this study was to analize the biocompatibility of two high viscosity glass ionomer cements (CIVAV) in in vitro experimental model of human gingival fibroblast using by metabolic, biochemical and morphology criteria.
Methods: Human gingival fibroblasts were plated on 24-well plate inserts at final concentration of 2×105 cells/500 ul of DMEM culture medium were used. Cells were exposed during 72 hours to discs of 2 mm diameter and 1 mm of thickness of a CIVAV EQUIA Forte Fil (EFT) (GC Corporation, Japan), and EQUIA Fil (EFL) (GC Corporation). To analyze morphological alterations, cells were examined by light microscopy. In addition, for cell proliferation analysis, WTS-1 technique was used and nuclear membrane alterations were determined by quantification of free DNA. The fibroblasts cultured in DMEM medium (CM) were positive control and fibroblasts incubated in 2% Triton X (CT) were negative control. To determine global differences between the experimental groups Kruskal-Wallis test was used (p<0.05).
Results: The results did not show significant morphological changes in cells exposed to biomaterials. Moreover, DNA test showed similar result in EFT, EFL and positive control without differences statistically significant (p<0.05). The results in cell proliferation assays were: EFT: 95.73 % and EFL: 82.61 %, and showed differences statistically significant between the experimental groups (p<0.001).
Conclusion: CIVAV showed an acceptable behavior of biocompatibility in the in vitro experimental model of human gingival fibroblasts. These biomaterials could be selected in restauration of cavities with highly compromised dentine surface.
Keywords: Biocompatibility, glass ionomer cements, human gingival fibroblasts.
Leer Artículo Completo
INTRODUCCIÓN
Los cementos ionómero de vidrio son biomateriales utilizados en la protección y sellado del complejo dentinopulpar debido a su capacidad para adherirse a estructuras dentales, en especial a la dentina (1, 2). En este contexto, los biomateriales, además de sus buenas propiedades físicas, deben ser biocompatibles con la finalidad de promover la preservación del tejido pulpar y su normal funcionalidad. En este sentido, estudios previos han demostrado que los cementos ionómero de vidrio modificados con resina son más citotóxicos que los cementos ionómero de vidrio convencionales, esto es debido a la presencia de monómeros resinosos en su composición (3). Asimismo, se ha demostrado que los monómeros resinosos como el HEMA (2-hidroxietilmetacrilato), BIS-GMA (bis-glicidil- metacrilato), TEGDMA (trietilenglicoldimetacrilato) y UDMA (uretanodimetacrilato), son citotóxicos, al analizarlos por separado o bien en forma combinada, en dosis y tiempos diferentes sobre distintas líneas celulares (4-7). En consecuencia, esto exige por parte del profesional seleccionar el material adecuado para cada situación clínica valorando además el sustrato dentario donde va tomar contacto el biomaterial.
En la actualidad han surgido nuevos cementos ionómero de vidrio convencionales de alta viscosidad que permiten obturar en bloque de hasta 4 mm del biomaterial en una cavidad dentaria y de esta manera simplificar las maniobras operatorias. Esto es posible ya que se incorporaron cambios en la composición de estos biomateriales con la finalidad de aumentar la dureza, la resistencia y además mejorar su translucidez y coloración natural (8). De manera que estos biomateriales además de ser utilizados en dentina profunda como protectores del complejo dentino-pulpar, permiten en forma simultánea funcionar como materiales de restauración de una preparación cavitaria.
Los cambios en la composición de estos biomateriales exige realizar un control de calidad de los mismos analizando entre otras las propiedades de biocompatibilidad (9). En el control de calidad de la biocompatibilidad de biomateriales odontológicos los modelos experimentales in vitro son necesarios y recomendados por ANSI/ADA para conocer en profundidad los mecanismos de acción de los mismos (10); y en este sentido, en la actualidad se disponen de distintos ensayos que analizan la viabilidad celular teniendo en cuenta criterios morfológicos, bioquímicos y metabólicos (6, 11).
A partir de lo expuesto en este trabajo nuestro objetivo ha sido analizar la biocompatibilidad de dos cementos ionómero de vidrio convencionales de alta viscosidad en un modelo experimental in vitro de fibroblastos gingivales humanos utilizando criterios morfológicos, bioquímicos y metabólicos.
MATERIAL Y MÉTODOS
Cultivo celular y tratamiento.
Fibroblastos gingivales humanos fueron cultivados en un medio de cultivo DMEM rico en glucosa (Sigma-Aldrich Ref. D5796) suplementado con antibióticos-antimicóticos (100U/ml de penicilina G, 100 mg/ml de estreptomicina y 0.25mg/ml de anfotericina B; Sigma-Aldrich Ref. A5955) y suero bovino fetal (SBF) (Sigma-Aldrich Ref. F9665) al 10.0 %. Las células luego fueron cultivadas en placas de 24 pocillos a una concentración de 20000 células/500 µl de medio de cultivo DMEM, con 10.0 % SBF y antibióticos y se incubaron a 37º C con un 5.0 % de dióxido de carbono durante 24 horas. Cumplido este tiempo y obtenida la adhesión de las células a la base de cada uno de los pocillos, fueron lavados con PBS y recibieron 500 µl de medio de cultivo DMEM.
Los biomateriales utilizados fueron el cemento ionómero de vidrio EQUIA Forte Fil (EFT) (GC Corporation, Japan) y EQUIA Fil (EFL) (GC Corporation, Japan). Los mismos fueron preparados según las recomendaciones del fabricante e insertados en moldes siliconados cilíndricos con una apertura de 2 mm de diámetro y 1 mm de espesor. Los mismos fueron polimerizados por reacción química a los 5 minutos y posteriormente fueron extraídos de los moldes siliconados y colocados sobre un inserto (Transwell) que posee una membrana de poliester microporosa en la base con poros de 0,4 µm (Costar, Corning; Corning, NY, USA). Se incorporó a cada pocillo, con las células y los insertos, 1500 µl de medio de cultivo hasta cubrir el biomaterial. De esta manera se garantizó que las partículas del biomaterial que se desprendieran fluyeran a través de la membrana y tomaran contacto con las células. Las células sometidas a la acción de los distintos cementos ionómero de vidrio fueron analizadas a las 72 horas. Como control positivo (100% citotóxico) se utilizó Control Tritón X-100 al 2.0% (Sigma-Aldrich) (CT) y como control negativo (no citotóxico) se utilizó medio de cultivo DMEM (CM).
Análisis Morfológico.
Con el objetivo de analizar las posibles alteraciones morfológicas de los fibroblastos gingivales humanos tras la exposición a los diferentes cementos ionómero de vidrio las células adheridas a la superficie de los pocillos fueron observadas y analizadas con un microscopio óptico de luz invertida (Nikon Eclipse 90i, Tokio, Japan), como previamente fue descrito (3)
Análisis de proliferación celular mediante test WST-1.
Se determinó la biocompatibilidad de los distintos cementos de ionómero de vidrio usando el test de WST-1; para ello se retiró el sobrenadante del medio de cultivo de cada pocillo y las células fueron lavadas con PBS. Posteriormente se agregó a los pocillos una alícuota del reactivo de WST-1 (Roche, Germany) en una concentración de 10.0 µL en 100.0 µL de medio de cultivo. Las células fueron incubadas en esa solución durante 4 horas y posteriormente se evaluó la viabilidad usando un lector de placas (Biochrom® Asys UVM340) estableciendo como longitud de onda un rango de 450-620 nm.
Test de cuantificación de ADN libre.
Se identificó y cuantificó el ADN liberado al medio de cultivo como consecuencia de la muerte celular. Para ello, se tomó del sobrenadante de cada pocillo donde las células habían sido cultivadas, 10.0µL de medio y se llevó a un espectofotometro Thermo Scientific Nano drop 2000 (longitud de onda260-280 nm.).
Análisis estadístico.
Para determinar diferencias globales entre todos los grupos experimentales se empleó la prueba de Kruskal-Wallis. Los resultados con un valor de p < 0,05 se consideró como estadísticamente significativo.
RESULTADOS
Analisis morfológicos
Los fibroblastos gingivales humanos pertenecientes al control negativo (CM) y a los distintos cementos ionomero de vidrio EFT y EFL, se muestran con una morfología normal caracterizada por células con formas de finas prolongaciones alargadas o estrelladas (Figura 1 A, B, C). Por el contrario, las células del control positivo (CT) se muestran con alteraciones morfológicas caracterizadas por poseer formas esféricas y ruptura de sus membranas celulares (Figura 1 D).
Figura 1. Se observan las características morfológicas de los fibroblastos gingivales humanos de los grupos experimentales control negativo (A), control positivo (B), y de la exposición de las mismas a los cementos ionómero de vidrio de alta viscosidad Equia Fill (C) y Equia Forte (D) durante 72 horas.
Análisis de proliferación celular mediante test WST-1
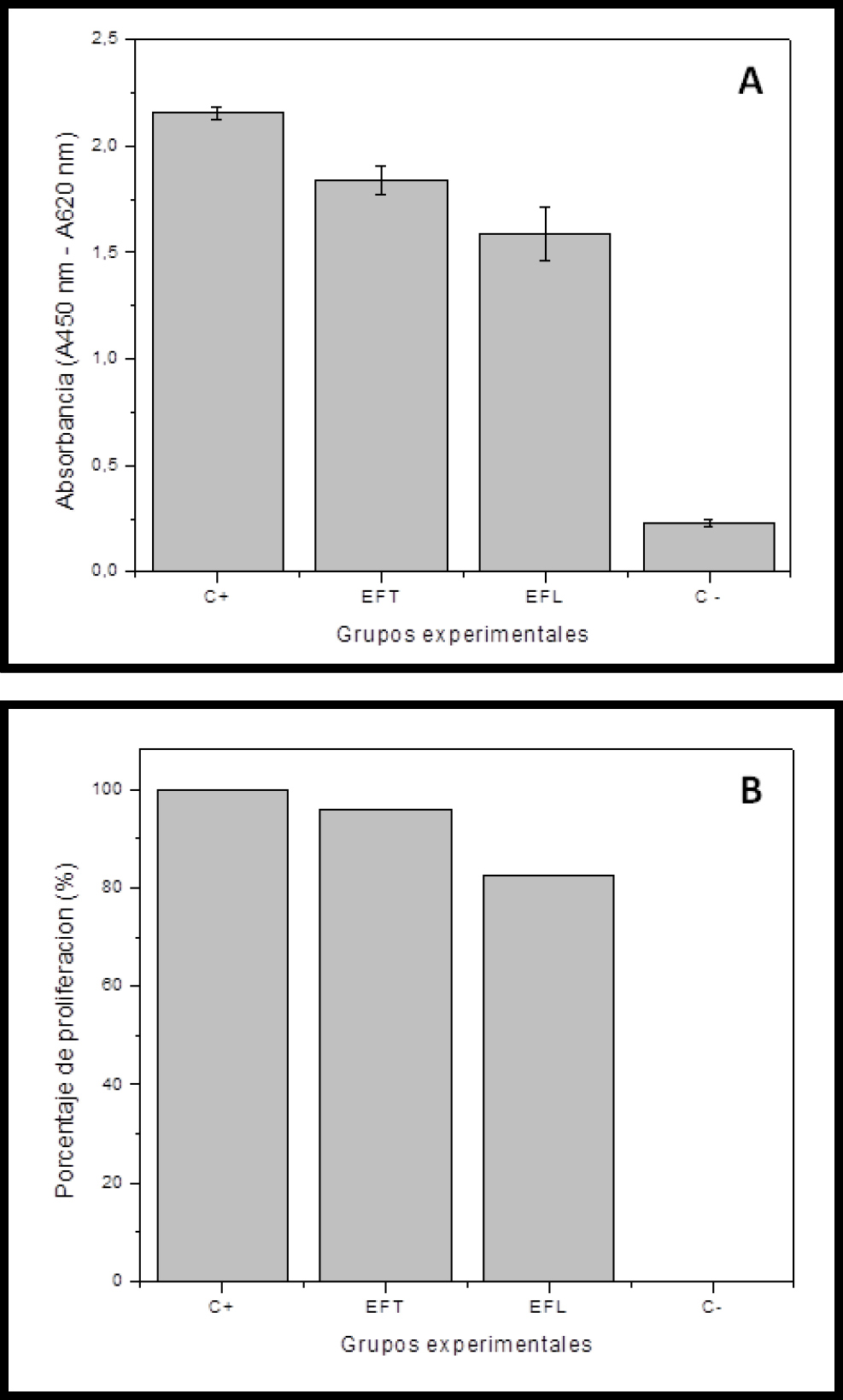
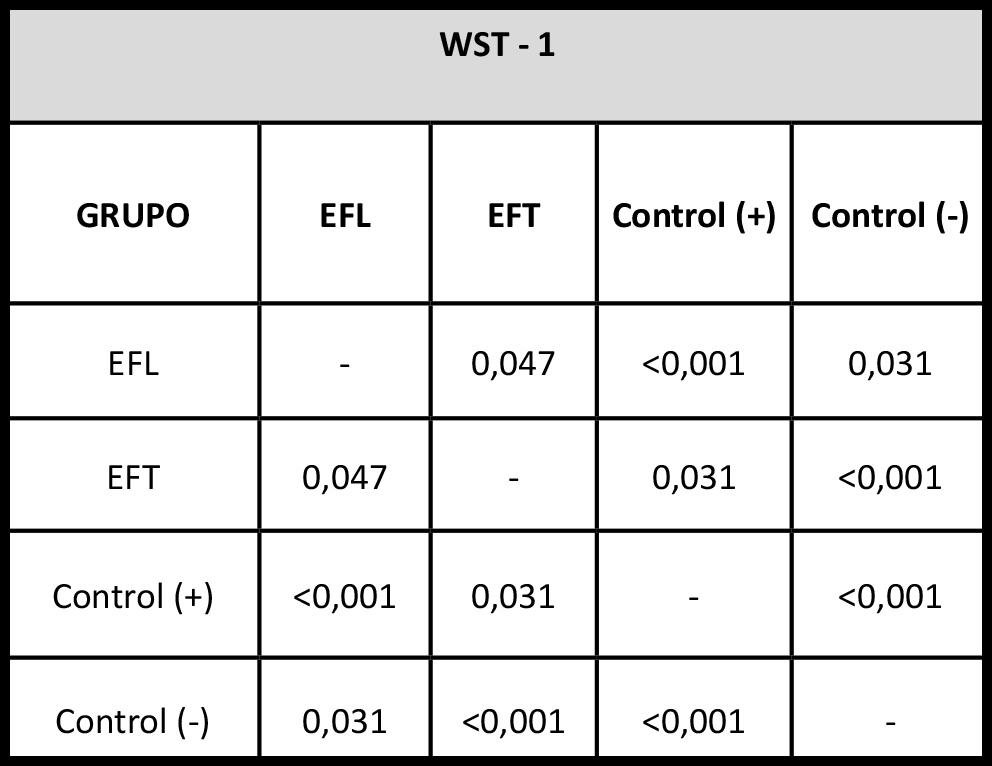
Cuando evaluamos los fibroblastos gingivales humanos expuestos al cemento ionómero de vidrio EFT observamos valores de absorbancia de 1.840 ± 0.14 y un equivalente a proliferación celular del 95.73 %, mientras que cuando esas células son expuestas a EFL los valores de absorbancia fueron de 1.587 ± 0.086 y la proliferación celular del 82.61 %. Para el control positivo la absorbancia fue de 2.156 ± 0.032 y la proliferación celular del 100.0 %, mientras que para el control negativo los resultados fueron 0.23 de absorbancia y 0.0 % de proliferación celular (Figuras 2a y 2b, Tabla 1). Todos los grupos se diferenciaron significativamente entre sí (p<0.05).
Figura 2. Se representan los resultados de WST-1 expresados en valores de absorbancia (2A) y en porcentaje de proliferación celular (2B) de fibroblastos gingivales humanos expuestos a distintos cementos ionómero de vidrio de alta viscosidad Equia Forte (EFT) y Equia Fill (EFL) y de los controles positivo y negativo.
Tabla 1. Se observan los valores de significación estadística de contrastes múltiples entre grupos (p-valores) obtenidos mediante el test de Kruskal Wallis sobre los resultados de absorbancia del test de WST-1.
Test de cuantificación de ADN libre
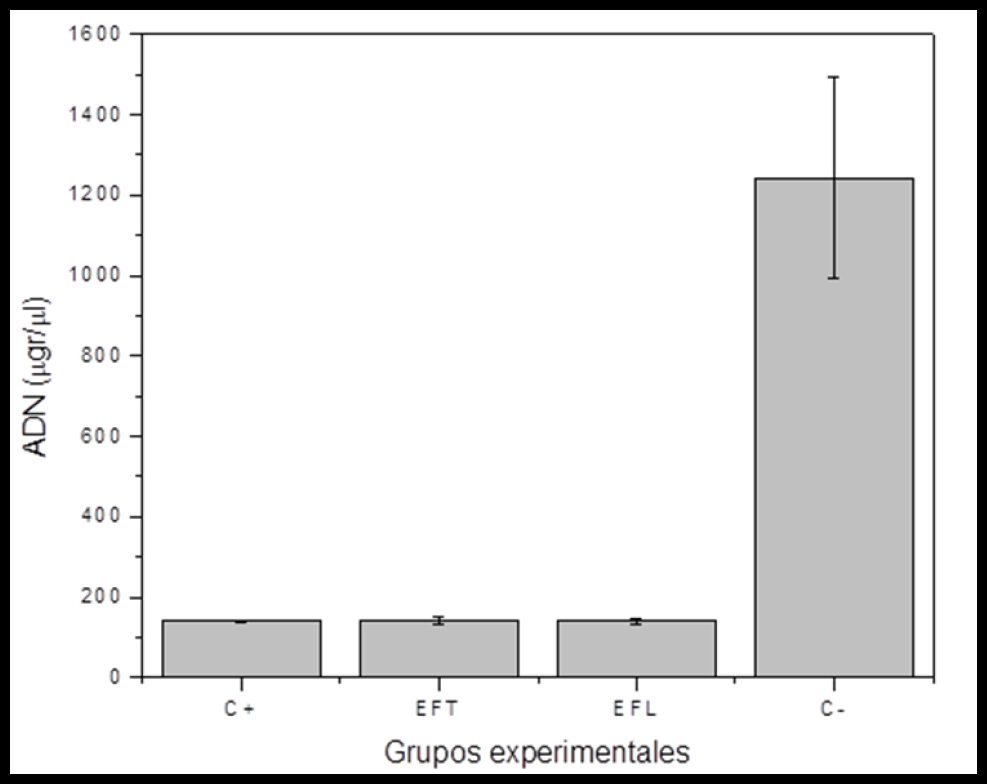
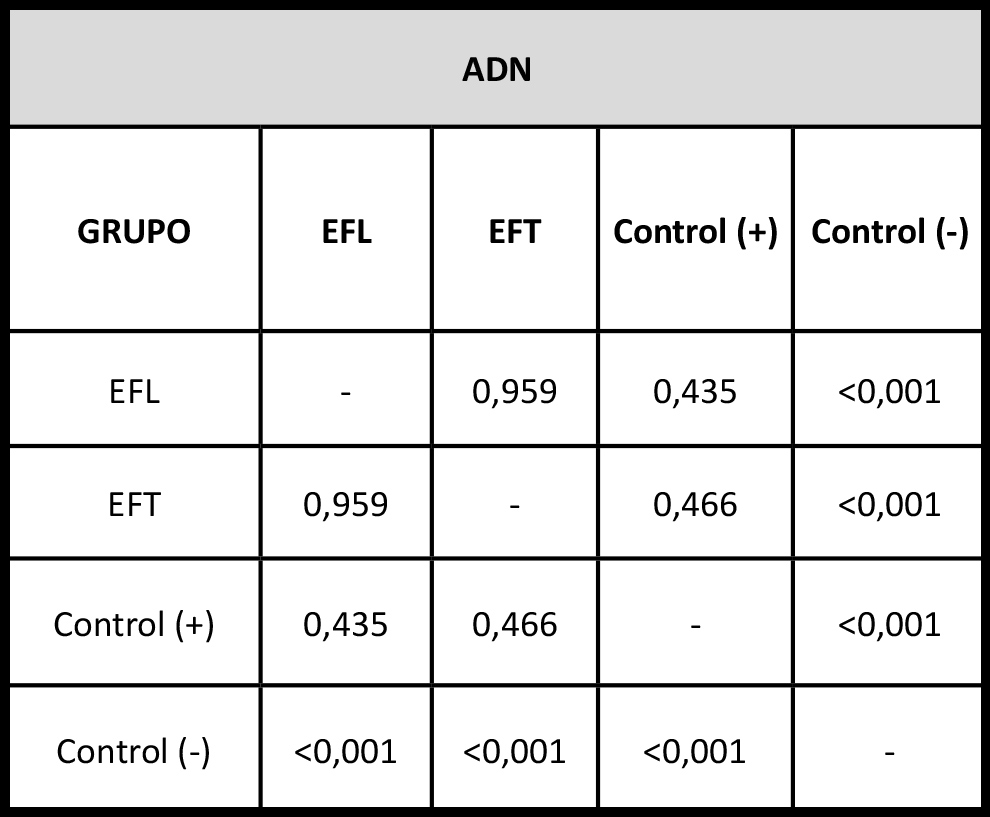
La identificación de ADN liberado al medio de cultivo mostró que las muestras en la cual las células fueron expuestas a EFT (142.7 ± 5,5 µg), EFL (140 ± 2 µg) y el control positivo (139.6 ± 1.9 µg) constituyen un grupo homogéneo, sin diferencias estadísticamente significativas (p<0.05). Este grupo homogéneo si posee diferencias estadísticamente significativas (p>0.001) cuando se lo compara con el control negative (1241.7 ± 95.2 µg), en el cual se observan mayores concentraciones de ADN liberado al medio de cultivo (Figura 3, Tabla 2).
Figura 3. Se expresa la liberación de ADN al medio (μgr/μl) de fibroblastos gingivales humanos expuestos a distintos cementos ionómero de vidrio de alta viscosidad Equia Fill (EFL) y Equia Forte (EFT) y se exponen los resultados de los controles positivo y negativos.
Tabla 2. Se observan los valores de significación estadística de contrastes múltiples entre grupos (p-valores) obtenidos mediante el test de Kruskal Wallis sobre la concentración de ADN (μg/mL) liberado al medio de cultivo.
DISCUSIÓN
Nuestros resultados permitieron determinar que los cementos ionómero de vidrio de alta viscosidad analizados en un modelo experimental in vitro de fibroblastos gingivales humanos mostraron niveles aceptables de biocompatibilidad.
Las razones por las que hemos utilizado fibroblastos gingivales humanos se deben a que diversos autores han demostrado que es un modelo experimental idóneo para valorar biocompatibilidad de biomateriales odontológicos, en especial cementos ionómero de vidrios, porque las mismas pertenecen a un entorno bucal y porque permiten realizar determinaciones morfológicas, bioquímicas y metabólicas con un alto grado de fiabilidad (3, 7, 12, 13).
Seleccionamos en este trabajo dos cementos de ionómero de vidrio de alta viscosidad, en este caso EFT y EFL, que son dos biomateriales que, si bien tienen el mismo objetivo, es decir, obturar una cavidad en bloque de 4.0mm y así simplificar las maniobras operatorias, poseen algunas variaciones en su composición química. En este sentido, (8) han valorado la citotoxicidad de ionomeros convencionales, pero ha incorporado una variante que es agregar a esos biomateriales nanoparticulas de hidroxiapatita y sílice con la finalidad de simular ionomeros de alta viscosidad.
Cuando analizamos la biocompatibilidad mediante la microscopia óptica para valorar determinaciones morfológicas, observamos que las células del control positivo y las expuestas a los ionómeros EFT y EFL presentaban formas ortotípicas caracterizadas por fibroblastos con aspectos ahusados o estrellados. Estos resultados coinciden con los mostrados por Rodriguez o Noorani donde los mismos observan que células en contacto con cementos ionómero de vidrio convencionales a las 72 horas presentaban las mismas formas. Asimismo, Noorani muestra similares resultados cuando pone en contacto un cemento ionómero de vidrio convencional de alta viscosidad. Sin embargo, cuando los cementos ionómero de vidrio incorporan resina en su composición, diversos autores han mostrado que las células sufren alteraciones morfológicas que se caracterizan por la presencia de células con formas redondas y ruptura de la membrana plasmática (3, 14, 15).
Cuando analizamos la proliferación celular observamos que con EFT fue del orden del 95,73% y EFL de 82,61 %, en ambos casos la viabilidad celular es alta, más si se la compara con el control negativo. De todas maneras, cuando a estos biomateriales los comparamos con el control positivo, observamos que la disminución de la viabilidad la diferencia fue estadísticamente significativa. Esa ligera disminución en la viabilidad podría deberse a la presencia de pequeñas partículas de aluminio y otros iones metálicos, entre ellos el zinc, presentes en los cementos ionómero de vidrio convencionales (16, 17). Nuestros hallazgos coinciden con Costa et al 1999, quienes utilizando el test MTT, un método con una misma fundamentación técnica a la por nosotros desarrollada, observaron que un cemento ionómero de vidrio convencional producía a las 72 horas citotoxicidad sobre células odontoblasticas MDPC-23, de todas maneras esa citotoxicidad era marcadamente inferior a la observada con los cementos ionómero de vidrio modificados con resinas.
En este trabajo se utilizó también para valorar viabilidad celular el test de ADN. Este método que permite detectar por espectrofotometría los fragmentos de ADN liberados al medio de cultivo ha sido utilizado por otros autores y ha mostrado un alto nivel de fiabillidad (18). En nuestro trabajo al analizar la biocompatibilidad mediante este test, se observó que los fibroblastos expuestos a los ionómeros EFT y EFL mostraban niveles de ADN similares al control negativo. Esto permite interpretar que tanto EFT y EFL no afectan la permeabilidad de la membrana nuclear de las células y por tanto confirman el carácter inocuo de estos biomateriales.
CONCLUSIÓN
La incorporación a los cementos ionómero de vidrio de hidroxiapatita y sílice no genera alteraciones celulares de magnitud en un modelo experimental in vitro de fibroblastos gingivales humanos. En este sentido, los cementos ionómero de vidrio de alta viscosidad podrían ser materiales de elección para resolver de manera más simple obturaciones que necesitan realizarse en cavidades en dentina profunda.
BIBLIOGRAFÍA
- Powis DR, Folleras T, Merson SA, Wilson AD. Improved adhesion of a glass ionomer cement to dentin and enamel. J Dent Res. 1982;61(12):1416-22.
- Smith DC. Development of glass-ionomer cement systems. Biomaterials. 1998;19(6):467-78.
- Rodriguez IA, Ferrara CA, Campos-Sanchez F, Alaminos M, Echevarria JU, Campos A. An in vitro biocompatibility study of conventional and resin-modified glass ionomer cements. J Adhes Dent. 2013;15(6):541-6.
- Ratanasathien S, Wataha JC, Hanks CT, Dennison JB. Cytotoxic interactive effects of dentin bonding components on mouse fibroblasts. J Dent Res. 1995;74(9):1602-6.
- Bouillaguet S, Wataha JC, Virgillito M, Gonzalez L, Rakich DR, Meyer JM. Effect of sub-lethal concentrations of HEMA (2-hydroxyethyl methacrylate) on THP-1 human monocyte-macrophages, in vitro. Dent Mater. 2000;16(3):213-7.
- Rodriguez IA, Fernandez-Segura E, Ceballos G, Arrebola F, del Carmen Sanchez-Quevedo M, Campos A. Hybrid cell death induced by exposure to 2-hydroxyethyl methacrylate (HEMA): an ultrastructural and X-ray microanalytical study. J Adhes Dent. 2008;10(2):105-11.
- Rodriguez IA, Lopez-Gonzalez G, Rodriguez MA, Campos-Sanchez F, Alaminos M. Biological evaluation of 2-hydroxyethylmethacrylate (HEMA) toxicity in human gingival fibroblasts with histochemical X-ray microanalysis. J Adhes Dent. 2011;13(4):375-81.
- Noorani TY, Luddin N, Rahman IA, Masudi SM. In Vitro Cytotoxicity Evaluation of Novel Nano-Hydroxyapatite-Silica Incorporated Glass Ionomer Cement. J Clin Diagn Res. 2017;11(4):ZC105-ZC9.
- Arita K, Yamamoto A, Shinonaga Y, Harada K, Abe Y, Nakagawa K, et al. Hydroxyapatite particle characteristics influence the enhancement of the mechanical and chemical properties of conventional restorative glass ionomer cement. Dent Mater J. 2011;30(5):672-83.
- Costa CA, Vaerten MA, Edwards CA, Hanks CT. Cytotoxic effects of current dental adhesive systems on immortalized odontoblast cell line MDPC-23. Dent Mater. 1999;15(6):434-41.
- Oliveira AC, Rodriguez IA, Garzon I, Martin-Piedra MA, Alfonso-Rodriguez CA, Garcia JM, et al. An early and late cytotoxicity evaluation of lidocaine on human oral mucosa fibroblasts. Exp Biol Med (Maywood). 2014;239(1):71-82.
- Issa Y, Watts DC, Brunton PA, Waters CM, Duxbury AJ. Resin composite monomers alter MTT and LDH activity of human gingival fibroblasts in vitro. Dent Mater. 2004;20(1):12-20.
- Reichl FX, Esters M, Simon S, Seiss M, Kehe K, Kleinsasser N, et al. Cell death effects of resin-based dental material compounds and mercurials in human gingival fibroblasts. Arch Toxicol. 2006;80(6):370-7.
- de Souza Costa CA, Hebling J, Garcia-Godoy F, Hanks CT. In vitro cytotoxicity of five glass-ionomer cements. Biomaterials. 2003;24(21):3853-8.
- Aranha AM, Giro EM, Souza PP, Hebling J, de Souza Costa CA. Effect of curing regime on the cytotoxicity of resin-modified glass-ionomer lining cements applied to an odontoblast-cell line. Dent Mater. 2006;22(9):864-9.
- Soheili Majd E, Goldberg M, Stanislawski L. In vitro effects of ascorbate and Trolox on the biocompatibility of dental restorative materials. Biomaterials. 2003;24(1):3-9.
- Stanislawski L, Daniau X, Lauti A, Goldberg M. Factors responsible for pulp cell cytotoxicity induced by resin-modified glass ionomer cements. J Biomed Mater Res. 1999;48(3):277-88.
- Bortner CD, Oldenburg NB, Cidlowski JA. The role of DNA fragmentation in apoptosis. Trends Cell Biol. 1995;5(1):21-6.
INFORMACIÓN DEL ARTÍCULO
Agradecimientos: Este trabajo ha sido financiado por: SECYT Codigo 313/16
Autor para la correspondencia Ismael Angel Rodriguez. Dirección: Calle Haya de la Torre s/n, Facultad de Odontología, Universidad Nacional de Córdoba, República Argentina. Email: ismaelrodriguez18@hotmail.com. Te: 00543514333033/32.