Revisión
Aplicación de la ingeniería tisular en la Enfermedad de Crohn perianal
Application of tissue engineering in perianal Crohn´s Disease
Actual. Med. 2019; 104: (807): 112-117 DOI: 10.15568/am.2019.807.re01
Enviado: 10-07-2019
Revisado: 18-07-2019
Aceptado: 10-08-2019
RESUMEN
En este trabajo se ha realizado una revisión bibliográfica de los artículos más relevantes que han sido publicados en revistas científicas de impacto durante los últimos años con el objetivo de conocer las nuevas opciones terapéuticas en el tratamiento de las complicaciones fistulosas de la Enfermedad de Crohn que repercuten de forma importante en la calidad de vida de los pacientes que la padecen. Las Terapias Avanzadas en este campo, se centran en las células madre como nuevo enfoque en el tratamiento de las fístulas perianales de los enfermos de Crohn. Dentro de la Ingeniería Tisular, el método empleado es la transferencia de células que pueden proceder de diferentes fuentes (mesenquimales o hematopoyéticas) y con diferentes formas de aplicación (local o sistémica) además de distinto origen (alogénico o autólogo). Las células madre pueden obtenerse de tejido adiposo, médula ósea o de origen hematopoyético. La forma más frecuente empleada es a partir de tejido adiposo alogénico administrándolas de forma local en el trayecto de la fístula ya que de esta manera existen menos efectos adversos y la obtención tiene menor morbimortalidad en comparación con el resto de métodos. Las células de origen hematopoyético, hasta hoy, tienen un número relativamente elevado de efectos adversos que no las convierten en una opción aceptable en el tratamiento de estas complicaciones. Actualmente, a pesar de ser una opción de tratamiento aparentemente eficaz y segura, son necesarios más estudios que impliquen mayor número de pacientes con muestras más homogéneas y con un seguimiento mayor en el tiempo.
Palabras clave: Enfermedad de Crohn; fístula perianal; Ingeniería Tisular; Células Madre.
ABSTRACT
In this work we have reviewed the most relevant articles that have been published in scientific journals of great impact for the last years in order to know the new therapeutic options in the treatment of the fistulous complications in Crohn’s Disease, which widely affect to the quality of life in those patients who suffer from it. Advanced Therapies in this field focus on stem cells as a new approach in the treatment of perianal fistulas of Crohn’s patients. Within Tissue Engineering, the method used is the transfer of cells that can come from different sources (mesenchymal or hematopoietic) and with different ways of application (local or systemic) as well as from different origin (allogeneic or autologous). Stem cells can be obtained from adipose tissue, bone marrow or hematopoietic origin. The most frequent form used is from allogenic adipose tissue, administering them locally in the path of the fistula since, this way, there are fewer adverse effects and its obtaining has lower morbidity and mortality compared to the rest of the methods. Cells of hematopoietic origin, up to now, have a relatively high number of adverse effects that do not make them an acceptable option in the treatment of these complications. Currently, despite being an apparently effective and safe treatment, it is completely necessary to have more patients with more homogeneous samples and a longer follow-up over time.
Keywords: Crohn´s Disease; perianal fistula; Tissue Engineering; Stem cells.
Leer Artículo Completo
INTRODUCCIÓN
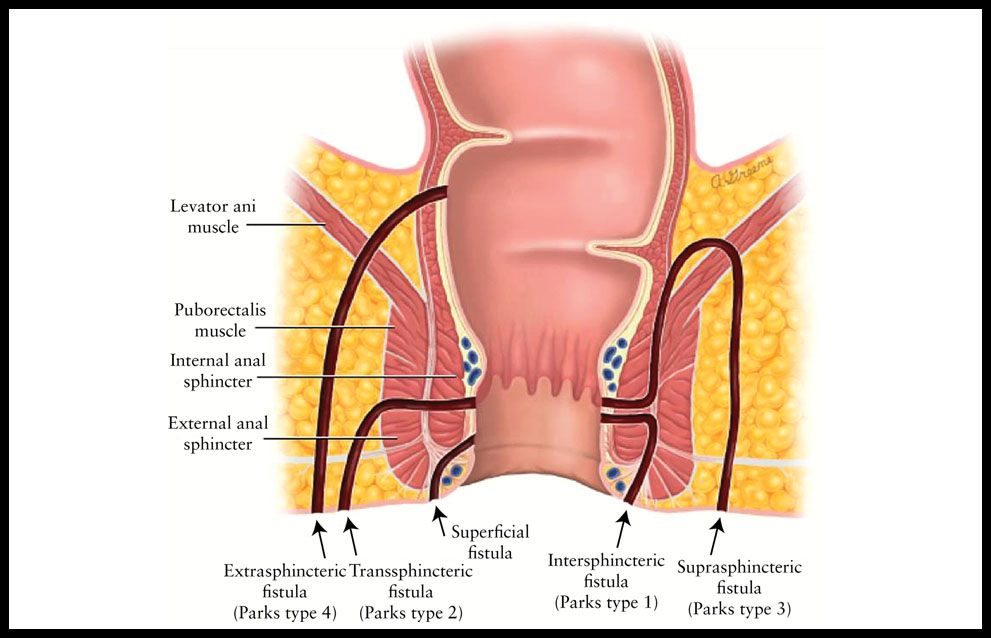
La enfermedad de Crohn (EC) es una patología crónica con un origen desconocido, aunque con gran implicación inmunológica, que se caracteriza por la inflamación transmural de la pared intestinal. Sus manifestaciones clínicas responden a diferentes patrones entre las que se destacan la enfermedad estenosante (fibrosis cicatricial) o la fistulizante (fístulas de diferente localización, perianal, enterocutánea, enteroentérica, rectovaginal, etc) (1) (Figura 1).
Figura 1.
En la actualidad no existe un tratamiento definitivo para la EC y es aquí donde radica su impacto sobre la población afecta.
Existen varias opciones terapéuticas que alivian el dolor o la sintomatología pero sin descartar por completo la aparición de crisis intermitentes características de esta enfermedad, lo que implica numerosos ingresos con repercusión, por tanto, en la calidad de vida de los pacientes con dicha enfermedad (1).
Una de las complicaciones más relevantes que pueden presentar estos pacientes es el desarrollo de fístulas perianales. Se estima que el 26% de los pacientes con EC las desarrollaran en las dos primeras décadas tras el diagnóstico (1,2). Entre las opciones de tratamiento llevadas a la práctica actualmente, se encuentran las terapias médicas con mesalazina, corticoesteroides sistémicos, anti-TNF o la cirugía. También existen opciones quirúrgicas como son el drenaje de abscesos perianales, la tutorización de fístulas o las derivaciones (ostomías), teniendo éstas últimas una mayor morbimortalidad y disminuyendo de forma importante la calidad de vida del paciente (2). Sin embargo, a pesar de las opciones de tratamiento comentadas, un 25% de los pacientes son refractarios a todas ellas y el 50% no responden a ninguna siendo la solución definitiva una cirugía agresiva a edades muy tempranas de la vida (3)
Por tanto, hasta ahora los enfoques terapéuticos en el tratamiento de la EC no tienen una eficacia del 100%, y existe la necesidad de estudio en nuevos campos como son las Terapias Avanzadas y, concretamente, es en la Ingeniería Tisular donde surge una nueva posibilidad terapéutica. Se define la Ingeniería Tisular como un campo interdisciplinar que aplica la ingeniería y las ciencias de la vida para el desarrollo de sustitutos biológicos que restauran, mantienen o mejoran la función de los tejidos utilizando para ello diferentes métodos como la transferencia (células), la inducción (biomateriales), elaboración de constructos (células y biomateriales) y descelularización (4). Desde este nuevo punto de vista de las Terapias Avanzadas, la terapia con células madre procedentes de distintas fuentes (mesenquimales o hematopoyéticas) y con diferentes formas de administración (local o sistémica) pueden constituir una nueva opción terapéutica en las complicaciones perianales de la EC.
El objetivo del presente trabajo es la revisión de las publicaciones científicas que se centran en el uso de las células madre como terapia local o sistémica en el tratamiento de fístulas perianales que suponen una de las complicaciones más relevantes en el contexto de la EC.
SÍNTESIS DE LA REVISIÓN
Tras la revisión de la literatura científica se han recuperado 29 trabajos correspondientes a artículos y revisiones relevantes empleando la base de datos de investigación biomédica PubMed hasta mayo de 2019. Los términos que se han empleado en la búsqueda son “Crohn’s disease and stem cell”, “perianal fistula and stem cell”, “perianal disease and stem cell”, “Crohn’s disease and advanced therapies”, “perianal fistula and advanced therapies”, “perianal disease and advanced therapies”. Prácticamente, la totalidad de la literatura consultada hace referencia a nuevos enfoques terapéuticos basados en la aplicación de células madre (terapia celular) para el manejo de fístulas perianales. Dependiendo del origen de las células madre empleadas en el tratamiento de las fístulas perianales en la EC, podemos dividirlas en células de origen mesenquimal o hematopoyético, que a continuación se describen.
Terapias avanzadas con células de origen mesenquimal:
En la médula ósea humana podemos distinguir dos tipos de poblaciones de células progenitoras, por un lado, las estromales, mesenquimales o no hematopoyéticas y por otro lado las hematopoyéticas (5).
Las células madre mesenquimales (MSC) también conocidas como células madre estromales, son células multipotenciales que proceden del mesodermo y que presentan una alta plasticidad para diferenciarse in vitro bajo condiciones estándar de cultivo a osteoblastos, adipocitos y condrocitos, así como tasas de proliferación elevadas que las hacen especialmente interesantes en las aplicaciones de la ingeniería tisular (6, 7). Estas células tiene una gran capacidad inmunoreguladora y reparadora, por lo que se han empleado como terapias avanzadas en enfermedades refractarias al tratamiento existente hasta ahora, como son las complicaciones perianales en la EC (8).
Dentro de las MSC, la gran mayoría de trabajos han utilizado poblaciones celulares derivadas del tejido a adiposo y derivadas de médula ósea.
a) Células madre derivadas del tejido adiposo (ADSC)
La fuente principal de las ADSC es el tejido adiposo del cual pueden aislarse a partir de un lipoaspirado, que constituye un procedimiento con una morbimortalidad baja. Además, el tejido adiposo ofrece alto número de ADSC por volumen de lipoaspirado. Por otro lado, y a parte de tener una fácil obtención, las ADSC poseen la capacidad de diferenciarse hacia distintas células tanto de origen mesodérmico, endodérmico y ectodérmico, sugiriendo la pluripotencialidad de esta población celular (9,10).
Prácticamente la totalidad de los trabajos que han estudiado la administración de las ADSC en la fístula perianal en la EC, han realizado dicha aplicación de forma local, mediante inyecciones en el tracto de la fístula (11-16).
Asimismo, las ADSC empleadas para el tratamiento de la enfermedad de Crohn pueden administrarse bien de forma alogénica (obtenidas de una persona distinta al paciente) o bien de forma autóloga (obtenidas del propio paciente).
En cuanto al origen alogénico, las células madre mesenquimales del adulto se consideran células inmunológicamente privilegiadas por presentar bajo niveles de HLA de clase I y carecer de HLA de clase II, CD80, CD40 y CD86, lo que contribuye a una respuesta inmunitaria innata y adaptativa reducida por parte del sistema inmune del receptor (11, 17). Estas características, por tanto, apoyan el uso de ADSC alogénicas sin necesidad de supresión de la inmunidad del huésped.
En este sentido De la Portilla et al, en un ensayo en fase I y II, aplicó una inyección intralesional con 20 millones de ADSC alogénicas con un seguimiento posterior de 12 semanas y repitiendo la aplicación de la inyección con 40 millones de dichas células si la fístula se encontraba parcialmente cerrada siguiendo al paciente hasta la semana 24. El 69,2% de los pacientes presentó una reducción en el número de fístulas y un 30% de los pacientes presentó el cierre completo de los trayectos fistulosos (11). Por otro lado Panés et al realizó un ensayo doble ciego donde asignó al azar el tratamiento mediante una sola inyección de 120 millones de ADSC frente a un grupo control que recibió 24 mL de solución salina y evaluó la respuesta a la semana 24 con un resultado de remisión, definida como el cierre de todos los orificios fistulosos externos y ausencia de colecciones mayores de 2 cm, del 50% frente al 34% respectivamente (12). Este mismo grupo de trabajo amplió el tiempo de seguimiento hasta la semana 52 de los pacientes tratados publicando, a los dos años, los resultados obtenidos teniendo un 56,3% de remisión en los que recibieron tratamiento local con células madre frente a un 38,6% en los controles (13).
En relación a los efectos adversos registrados, los más frecuentes fueron el absceso perianal (13%) o la proctalgia (9%) (12,13) que tuvieron una mayor incidencia en el grupo que no fue tratado con células madre (13).
Así la eficacia y seguridad en los estudios con este tipo de células apoyan que el empleo de inyecciones locales intralesionales en la fístula perianal de la EC es un procedimiento relativamente seguro y con mayor eficacia cuando se compara frente a terapias convencionales o placebo.
Además de la aplicación en el tracto de la fístula perianal también existen estudios que administran las ADSC de forma alogénica en fístulas de localización rectovaginal en el contexto de la EC. Mediante la inyección intralesional de 20 millones de células madre en la fístula rectovaginal se obtiene un 60% de curación registrado a la semana 52 tras el tratamiento, sin aparición de ningún efecto adverso (14), lo que también sugiere la seguridad y eficacia de estos tratamientos con terapias avanzadas en el manejo de otras complicaciones fistulosas de la EC.
Por otro lado, la aplicación de las ADSC en este tipo de tratamientos pueden provenir del mismo paciente a tratar, es decir, de forma autóloga. García-Olmo et al publica en 2003 el primer ensayo con ADSC autólogas donde se trató a una paciente de 33 años con diagnóstico de enfermedad de Crohn de 11 años de evolución con fístula rectovaginal recurrente con mala respuesta al tratamiento quirúrgico. Se emplearon 9 millones de células procedentes de la misma paciente, de tejido adiposo, localmente sobre la fístula presentando esta resolución sin recaída posterior tras tres meses de seguimiento (16).
Posteriormente, García-Olmo et al llevó a cabo un ensayo clínico en fase I para comprobar la viabilidad y seguridad de la inyección de 30 millones de células madre en este caso procedentes del mismo paciente en varios tipos de fístulas (rectovaginal, enterocutánea y perianal). El 75% de las fístulas se consideraron curadas por presentar un orificio fistuloso de salida cerrado por completo con una media de seguimiento de 22 meses. Además ninguno de los pacientes presentó efectos adversos relevantes durante el estudio (15). Con este estudio no se puede afirmar la eficacia de la terapia, pero sí la seguridad del lipoaspirado de origen autólogo en el tratamiento de las complicaciones fistulosas en la EC. A pesar de esto, es necesaria la publicación de estudios con un mayor número de pacientes.
En 2008, se publicó un trabajo donde se comparó la administración en la fístula perianal de ADSC autólogas junto con pegamento de fibrina, frente a la aplicación de pegamento solo en un ensayo controlado aleatorizado de 49 pacientes (14 con enfermedad de Crohn) evidenciando una diferencia significativa en la curación, siendo del 71% en los pacientes a los que se les aplicó ADSC frente al 16% en el grupo control. Los autores del estudio sugieren que las ADSC autólogas pueden tener tanto un efecto antiinflamatorio como reparador siendo efectivas en el tratamiento de la enfermedad perianal en la EC (18,19).
Así, el origen autólogo de las ADSC podría utilizarse también como posible fuente para obtener material terapeútico en las fístulas en la EC ya no sólo perianales sino también en otras localizaciones como la rectovaginal. La aplicación autóloga de células, por tanto, supone una nueva opción terapéutica libre de riesgo inmunológico en pacientes de EC.
b) Células madre derivadas de la médula ósea (BMSC)
Las BMSC fueron las primeras MSC en descubrirse, en la médula ósea, y a partir de aquí se han descrito en otros lugares como el cordón umbilical, el tejido adiposo, la pulpa dental o el músculo, todas ellas con demostrada multipotencialidad. La obtención de BMSC es más compleja y con mayor morbimortalidad que las ADSC ya que es preciso un método más invasivo, generalmente mediante punción y aspirado de médula en la cresta ilíaca. Como se ha mencionado anteriormente, la obtención de ADSC se realiza normalmente mediante lipoaspirado o, en contadas ocasiones, en forma de biopsia grasa y, por tanto, es un método más asequible para el paciente. Por otro lado y al igual que las ADSC, las BMSC pueden tener origen alogénico o autólogo (20,21).
En primer lugar, y respecto al origen alogénico, Molendijk et al publicaron un ensayo en el que participaron 21 pacientes refractarios a tratamientos convencionales de la EC como son anti-TNF, antibioterapia, esteroides, metotrexato, cirugía o combinación de varios. Los pacientes se asignaron aleatoriamente a varios grupos que recibieron 1 millón (grupo 1), 3 millones (grupo 2) y 9 millones (grupo 3) de BMSC respectivamente frente a un grupo control al que se le aplicó una solución de NaCl al 0,9%. En todos los grupos la aplicación fue mediante inyección local en el trayecto fistuloso. La evaluación de los resultados clínicos se realizó después de 6, 12 y 24 semanas. La curación se consideró como la ausencia de drenaje y menos de 2 cm de absceso perianal, este último determinado por resonancia magnética. Después de 6 semanas de tratamiento, se observó la curación en el 60% de los pacientes del grupo 1, en el 80% del grupo 2, y en el 20% del grupo 3, frente al 16,7% del grupo que no recibió BMSC. En la semana 12, la curación se observó en el 40% del grupo 1, 80% en el grupo 2, y 20% en el grupo 3, frente a 2 pacientes en el grupo control (33,3%). Estos efectos se mantuvieron hasta la semana 24 y aumentaron hasta un 80% de curación en el grupo 1 (22). Estos resultados no sólo sugieren la efectividad de la aplicación de células madre mesenquimales de forma local en la remisión de las complicaciones perianales de la EC, sino que además, este efecto es dosis-dependiente, al no ser igual la respuesta en los diferentes grupos experimentales.
En cuanto a la seguridad del procedimiento, todos los pacientes incluidos en el ensayo refirieron proctalgia en la primera semana tras el tratamiento. Un paciente de cada uno de los cuatro grupos, desarrolló un absceso perianal que precisó drenaje quirúrgico. No se describieron otros efectos adversos graves durante el ensayo (22).
Podemos concluir que la aplicación de BMSC local alogénicas en la fístula perianal de la EC es un procedimiento seguro y que la aplicación de 3 millones de BMSC parece promover con más eficacia, en comparación con el resto de grupos, la curación de la fístula. Sin embargo, se requiere más investigación en este sentido para profundizar en la efectividad y seguridad de este tipo de tratamiento de terapia celular.
Por otro lado, también se ha descrito la aplicación de las BMSC de forma autóloga. Ciccocioppo et al publicaron un estudio prospectivo con el objetivo de estudiar la viabilidad, seguridad y eficacia de la inyección intrafistular de BMSC autólogas en pacientes que ya habían recibido tratamientos convencionales para las complicaciones de la EC incluyendo anticuerpos monoclonales y anti-TNF que fueron refractarios a todos ellos y que no suspendieron durante el ensayo. Se administraron 50 millones de BMSC en el trayecto fistuloso en 10 pacientes cada 4 semanas que fueron seguidos durante 12 meses con revaluaciones a los 3, 6 y 12 meses. En cuanto a la eficacia, siete de diez pacientes presentaron “remisión”, entendiendo como “remisión”, la incapacidad para introducir un estilete a través de los orificios fistulosos sin drenaje a pesar de compresión sobre el trayecto. Tres de los diez pacientes presentaron “mejora” de la enfermedad, entendiendo como “mejora”, la reducción al 50% del número de trayectos fistulosos. Además en este trabajo, se evaluó mediante RMN la presencia de mayor tejido regenerativo y disminución de tejido fibrótico en los tractos de las fístulas teniendo una implicación positiva en cuanto a la funcionalidad de los esfínteres. Con controles endoscópicos también se pudo evaluar el estado de la mucosa rectal que presentó mejoría de la inflamación en todos los casos. Estos resultados observados con la RMN se pudieron evidenciar a partir de la segunda inyección de BMSC que parece estar en relación con el aumento de células T reguladoras circulantes que se mantuvieron durante todo el tratamiento y seguimiento. Según este estudio, las BMSC influyen en el retraso de la apoptosis de células T reguladoras haciendo que estas medien en la patogenia de la EC.
Respecto a la seguridad, no se evidenció ningún efecto adverso durante la administración de las BMSC (8).
Estos mismos autores publicaron años más tarde los resultados obtenidos en el seguimiento de estos pacientes durante cinco años con el objetivo de evaluar la seguridad y eficacia a largo plazo de esta terapia teniendo en cuenta la aparición de recidiva o remisión sin empleo de tratamiento médico ni quirúrgico. Los pacientes fueron evaluados anualmente tras el tratamiento ya recibido. Los resultados obtenidos en cuanto al periodo libre de recaída (entendiéndola como ausencia de clínica relacionada con la fístula perianal) fueron del 88% de los pacientes el primer año, el 50% a los dos años y 37% a los 4 años. Durante todo el periodo evaluado se recogieron efectos adversos como dolor abdominal, cefalea, proctalgia, diarrea, eritema, náuseas y fiebre no atribuyéndose con la terapia de BMSC (23).
Parece seguro y relativamente eficaz a largo plazo la administración autóloga local de BMSC en la enfermedad perianal refractaria de la EC. Sin embargo, es necesario tener en cuenta, que durante el ensayo realizado por Ciccocioppo et al, los pacientes no suspendieron sus tratamientos habituales como son los anticuerpos monoclonales o la terapia con anti-TNF, por lo que no podemos concluir que la ingeniería tisular, en este caso, esté potenciada por las terapias convencionales o viceversa.
Terapias avanzadas con células de origen hematopoyético:
El mecanismo fundamental de las células de origen hematopoyético es el restablecimiento del sistema inmune (SI) eliminando las células linfocitarias tipo T mediante quimioterapia con la posterior reconstitución de la población linfocitaria a partir de las células madre. Si el origen de las células es autólogo, la predisposición genética del paciente a padecer la enfermedad no varía, por lo que podrían aparecer crisis recurrentes. Sin embargo, cuando se trata de células alogénicas, se reemplaza el SI por el del donante, pero dada la elevada morbimortalidad no se acepta esta vía de tratamiento en enfermedades no tumorales (24). Éstas células se administran mediante trasplante de precursores hematopoyéticos (TPHA) que consiste en quimioterapia seguida de infusión intravenosa de los precursores autólogos (3).
Los primeros casos descritos en la literatura son pacientes con EC que recibieron TPHA por otro motivo y mejoraron clínicamente de la EC. Posteriormente se comenzó a publicar pequeñas series de casos con TPHA dirigido a la propia EC (3).
Hernanz et al realizaron un estudio retrospectivo de los pacientes que habían recibido TPHA autólogo con EC refractaria. Todos los pacientes habían sido refractarios a al menos 6 terapias médicas o cirugía. Los siete pacientes incluidos en el estudio habían sido sometidos a varias etapas durante el tratamiento: movilización, aféresis y criopreservación, acondicionamiento e implante intravenoso de 2-4 × 106 células CD34+ / kg. Tras 6 meses, el 43% de los pacientes presentaron remisión clínica y endoscópica, el 14% presentó mejoría clínica sin remisión y el 43% presentaban enfermedad activa que requirió el reinicio del tratamiento convencional. Tras 30 meses después del tratamiento 5 de los 7 pacientes (71%) presentaron recidiva de la enfermedad con necesidad de reintroducir tratamiento médico. Al final del seguimiento, a los 48 meses, un 42,8% de los pacientes presentaba remisión clínica con tratamiento médico y un 28,6% remisión clínica sin tratamiento médico.
En cuanto a las complicaciones, destacaron la neutropenia febril, la mucositis (86%) y una infección por Clostridium difficile. No se describieron neoplasias u otras enfermedades autoinmunes (3).
Tras la revisión de estos resultados se puede sugerir que el TPHA puede estar en relación con la remisión de la EC pero que además puede hacer que tratamientos médicos que ya no resultaban eficaces en algunos pacientes, vuelvan a serlo tras el trasplante. El principal problema de este tratamiento, no obstante, sigue siendo su toxicidad.
En 2015, Hawkey et al publicaron en el ensayo ASTIC, un ensayo aleatorizado de grupos paralelos que se llevó a cabo en seis países europeos, en el que se comparó el TPHA autólogo frente a los tratamientos convencionales de la EC refractaria. 23 pacientes se sometieron a movilización, aféresis, acondicionamiento e infusión de, mínimo, 3 × 106 CD34+ células / kg frente a 22 pacientes con terapia convencional con un seguimiento de 1 año. No hubo ninguna diferencia estadísticamente significativa entre los grupos en la proporción de pacientes que cumplieron la definición del estudio de la remisión de la enfermedad sostenida siendo del 8,7% en el grupo de TPHA frente al 4,5% en el grupo control, entendiendo remisión sostenida de la enfermedad como la no utilización de fármacos en los últimos 3 meses y ninguna evidencia de enfermedad activa ni endoscópica ni radiológica.
En relación a la seguridad del estudio, se describieron frecuentes eventos adversos. 76 pacientes en el grupo que recibió TPHA frente a 38 en el grupo control además de una muerte en el grupo del trasplante por síndrome obstructivo sinusoidal. Probablemente, el objetivo del ensayo ASTIC se planteó de forma muy exigente, por lo que los resultados obtenidos no apoyaron el empleo de precursores hematopoyéticos como una terapia alternativa en la EC refractaria (25).
Por otra parte, López García et al, realizaron el TPHA autólogo en 29 pacientes seguidos durante 12 meses. A los 6 meses, el 70% de ellos, alcanzó la remisión clínica entendida como ausencia de tratamiento médico, al año, el 61% y a los 5 años el 15%. Tras la recaída se reintrodujo el tratamiento convencional teniendo mejor respuesta que previamente al trasplante (80% remisión). Entre los efectos adversos más relevantes destacó la muerte de un paciente debida a infección por Citomegalovirus. Aunque la recaída ocurrió en la mayoría de los pacientes, la respuesta al tratamiento médico retomado mejoró significativamente (26).
Por otro lado, Brierley et al publicaron un ensayo donde se trasplantaron 89 pacientes con un porcentaje de remisión o mejoría clínica del 64% entendido como ausencia de dolor abdominal y heces normales. En el 4% de los pacientes la enfermedad empeoró respecto al estado previo. Los efectos adversos fueron similares a los publicados en enfermedades como mieloma o linfoma (27).
Snowden et al publicó resultados similares a los descritos, en los que la carga de efectos adversos tras el TPHA era alta. Sin embargo, los pacientes respondían mejor a la terapia convencional que había sido suspendida previa al trasplante y a la que eran refractarios en un principio (28). Otros ensayos, como el de Lindsay et al recogen resultados de efectos adversos frecuentes y graves tras el trasplante como la muerte de un paciente por síndrome sinusoidal (29).
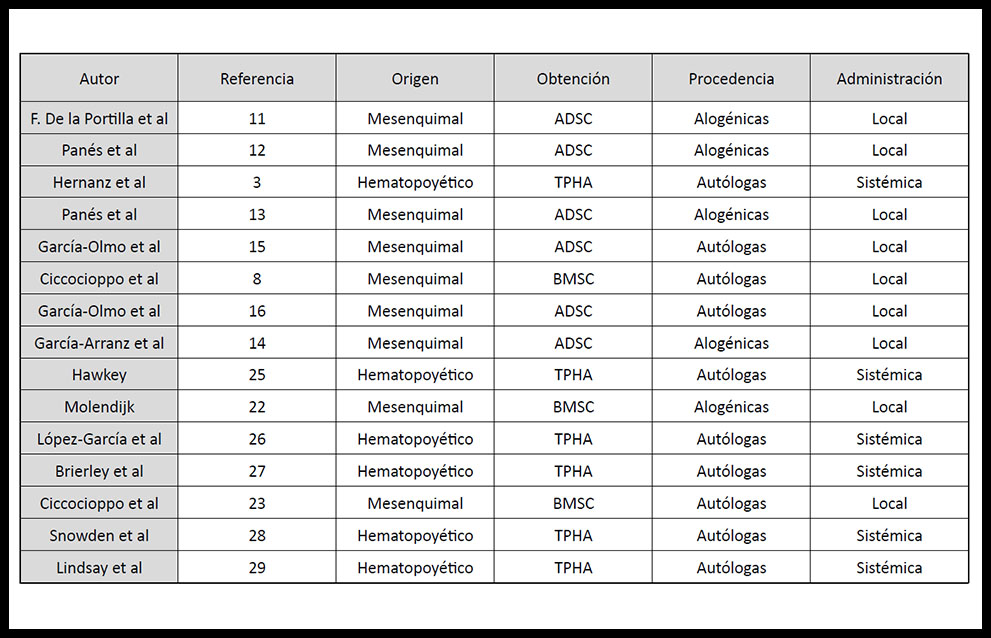
Tabla 1. Artículos revisados acerca de la aplicación de células madre en la enfermedad perianal en enfermos de Crohn
CONCLUSIONES
La EC es una patología conocida pero, en cuanto a sus complicaciones fistulosas, ya sean perianales o en otras localizaciones, el tratamiento actual no tiene resultados lo suficientemente satisfactorios. Estas complicaciones generan un importante impacto en la calidad de vida de los pacientes que la padecen. En este sentido, las Terapias Avanzadas podrían suponer una nueva solución a la terapéutica de las fístulas perianales de los pacientes con EC. Concretamente, dentro del marco de las Terapias Avanzadas y la Ingeniería Tisular, la transferencia celular es el método empleado con mayor frecuencia en los diferentes trabajos publicados. La literatura revisada emplea células madre mesenquimales o hematopoyéticas, dentro de las cuales, se pueden utilizar de forma alogénica o autóloga. Además en cuanto a las MSC, éstas se pueden obtener de tejido adiposo o de médula ósea.
En general, la gran mayoría de ensayos realizados, emplean las ADSC alogénicas con administración local en el trayecto fistuloso. La obtención de dichas células de tejido adiposo supone una menor morbimortalidad con respecto a otras fuentes de células madre, y ofrece gran cantidad de células con respecto al volumen de tejido. Esto hace que sean una fuente celular ideal para este propósito. Además, es más frecuente emplearlas de forma alogénica por ser células inmunológicamente privilegiadas (bajos niveles de HLA I y carecer de HLA II). Por otro lado, es un procedimiento relativamente seguro con escasa aparición de efectos adversos.
En relación a la utilización de progenitores hematopoyéticos, el principal inconveniente del TPHA es la toxicidad, siendo relativamente frecuente los efectos adversos graves.
En definitiva, son necesarios más ensayos en este ámbito con un mayor número de pacientes. Los resultados obtenidos hasta ahora apoyan que las Terapias Avanzadas podrían ser una nueva herramienta en el tratamiento de las complicaciones fistulosas (perianales y en otras localizaciones) de la EC. Además sería interesante ampliar el conocimiento en otras áreas de la Ingeniería Tisular, empleando otros métodos como pueden ser la elaboración de constructos a partir de células y biomateriales.
REFERENCIAS BIBLIOGRÁFICAS
- Panes J, Reinisch W, Rupniewska E, et al. Burden and outcomes for complex perianal fistulas in Crohn’s disease: Systematic review. World J Gastroenterol. 2018;24(42):4821–4834
- Lightner AL, Faubion WA. Mesenchymal stem cell injections for the treatment of perianal Crohn’s disease:what we have accomplished and what we still need to do. J Crohns Colitis. 2017;11:1267–1276
- Hernanz N, Sierra M, Volpato N et al. Autologous haematopoietic stem cell transplantation in refractory Crohn’s disease: Experience in our centre. Gastroenterol Hepatol. 2019;42(1):16-22
- Langer R, Vacanti JP. Tissue engineering. Science. 1993;260:920–6
- Mishra PJ, Banerjee D. Activation and Differentiation of Mesenchymal Stem Cells. Methods Mol Biol. 2017. 1554:201-209
- Guadix JA, Zugaza JL, Galvez-Martin P. Characteristics, applications and prospects of mesenchymal stem cells in cell therapy. Med Clin. 2017; 148:408–14
- Zhang X.M, Zhang Y.J, Wang W, Wei Y.Q, Deng H.X. Mesenchymal Stem Cells to Treat Crohn’s Disease with Fistula. Hum. Gene Ther. 2017;28:534–540
- Ciccocioppo R, Bernardo M. E, Sgarella A, et al. Autologous bone marrow-derived mesenchymal stromal cells in the treatment of fistulising Crohn’s disease. Gut. 2011;60(6):788–798
- Naderi N, Combellack E. J, Griffin M, et al. The regenerative role of adipose-derived stem cells (ADSC) in plastic and reconstructive surgery. Int Wound J. 2017;14(1):112–124
- Martin-Piedra MA, Alfonso-Rodriguez CA, Zapater A et al. Effective use of mesenchymal stem cells in human skin substitutes generated by tissue engineering. Eur Cell Mater. 2019;29;37:233-249
- De la Portilla F, Alba F, Garcia-Olmo D, Herrerias J.M, Gonzalez F.X, Galindo A. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn’s disease: Results from a multicenter phase I/IIa clinical trial. Int. J. Colorectal. Dis. 2013;28:313–323
- Panés J, García-Olmo D, Van Assche G et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet. 2016;388:1281–1290
- Panés J, García-Olmo D, Van Assche G et al. Long-term Efficacy and Safety of Stem Cell Therapy (Cx601) for Complex Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology. 2018;154:1334–1342
- Garcia-Arranz M, et al. Treatment of Crohn’s-Related Rectovaginal Fistula With Allogeneic Expanded-Adipose Derived Stem Cells: A Phase I-IIa Clinical Trial. Stem Cells Transl Med. 2016;5:1441–1446
- García-Olmo D, García-Arranz M, Herreros D, Pascual I, Peiro C, Rodríguez-Montes JA. A phase I clinical trial of the treatment of crohn’s fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rect. (2005) 48:1416–23
- Garcia-Olmo D, et al. Autologous stem cell transplantation for treatment of rectovaginal fistula in perianal Crohn’s disease: a new cell-based therapy. Int J Colorectal Dis. 2003;18:451–454
- Lightner AL, Wang Z, Zubair AC, Dozois EJ. A Systematic Review and Meta-analysis of Mesenchymal Stem Cell Injections for the Treatment of Perianal Crohn’s Disease: Progress Made and Future Directions. Dis Colon Rectum. 2018;61:629–640
- Garcia‐Olmo D, Garcia‐Arranz M, Herreros D. Expanded adipose‐derived stem cells for the treatment of complex perianal fistula including Crohn’s disease. Expert Opin Biol Ther. 2008;8:1417–23
- Tozer PJ, Burling D, Gupta A. et al. Review article: medical, surgical and radiological management of perianal Crohn’s fistulas. Aliment Pharmacol Ther 2011;33:5–22
- Kagami H, Agata H, Tojo A. Bone marrow stromal cells (bone marrow-derived multipotent mesenchymal stromal cells) for bone tissue engineering: basic science to clinical translation. Int J Biochem Cell Biol. 2011;43:286–9
- Bianco P., Robey P. G., Simmons P. J. Mesenchymal stem cells: revisiting history, concepts, and assays. Cell Stem Cell. 2008;2(4):313–319
- Molendijk I, Bonsing BA, Roelofs H, Peeters KC, Wasser MN, Dijkstra G. et al. Allogeneic Bone Marrow-Derived Mesenchymal Stromal Cells Promote Healing of Refractory Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology. 2015;149:918–27
- Ciccocioppo R, Gallia A, Sgarella A, Kruzliak P, Gobbi PG, Corazza GR. Long-term follow-up of Crohn disease fistulas after local injections of bone marrow-derived mesenchymal stem cells. Mayo Clin Proc. 2015;90(6):747–755
- Turse EP, Dailey FE, Naseer M, Partyka EK, Bragg JD, Tahan V. Stem cells for luminal, fistulizing, and perianal inflammatory bowel disease: a comprehensive updated review of the literature. Stem Cells Cloning. 2018;11:95-113
- Hawkey CJ, Allez M, Clark MM et al. Autologous Hematopoetic Stem Cell Transplantation for Refractory Crohn Disease: A Randomized Clinical Trial. JAMA. 2015;314(23):2524-34
- López-García A, Rovira M, Jauregui-Amezaga A, et al. Autologous haematopoietic stem cell transplantation for refractory Crohn’s disease: efficacy in a single-centre cohort. J Crohns Colitis. 2017;11(10):1161–1168
- Brierley CK. Castilla-Llorente C. Labopin M, et al. A retrospective survey of long-term outcomes from the European Society for Blood and Marrow Transplantation. J Crohns Colitis. 2018;12(9): 1097–1103
- Snowden JA, Panés J, Alexander T, et al. Autologous haematopoietic stem cell transplantation (AHSCT) in severe Crohn’s disease: a review on behalf of ECCO and EBMT. J Crohns Colitis. 2018;12(4):476–488
- Lindsay JO, Allez M, Clark M, et al. Autologous stem-cell transplantation in treatment-refractory Crohn’s disease: an analysis of pooled data from the ASTIC trial. Lancet Gastroenterol Hepatol. 2017;2(6):399–406
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Saioa Ercoreca Tejada. Hospital Universitario Virgen de las Nieves. Granada, Andalucía. E-mail: saioa_erkoreka@hotmail.com Teléfono: 620061375