Original
Diagnóstico clínico en pacientes con anticuerpos antifosfolípidos positivos
Clinical diagnosis in patients with positive antiphospholipid antibodies
Actual. Med. 2020; 105 : (810): 90-95 DOI: 10.15568/am.2020.810.or02
Enviado: 31-10-2019
Revisado: 03-06-2020
Aceptado: 17-06-2020
Resumen
Objetivo: Conocer la relación entre la presencia de tres anticuerpos antifosfolípido: el anticoagulante lúpico y los anticardiolipina de isotipo IgM e IgG con el desarrollo de eventos trombóticos y de alteraciones en la coagulación y analizar el entorno clínico en el que aparecen dichos anticuerpos.
Material y métodos: Estudio descriptivo transversal en el que se han analizado de forma retrospectiva, en 123 pacientes con resultados positivos para al menos uno de los anticuerpos antifosfolípido en estudio, sus alteraciones en la coagulación, si padecen o han padecido algún evento trombótico, y el entorno clínico en el que se presentan estos anticuerpos.
Resultados: El 52,1% de los pacientes con anticoagulante lúpico positivo presentan algún tipo de alteración en las pruebas de la coagulación, frente al 43,75% de los pacientes con anticardiolipina de isotipo IgG y el 24,64% de los pacientes con anticardiolipina de isotipo IgM. El anticuerpo más frecuente en los pacientes con síndrome antifosfolípido primario es el anticardiolipina de isotipo IgM, que aparece en el 75%, mientras que en el caso de los pacientes con síndrome antifosfolípido secundario a lupus eritematoso sistémico, el anticuerpo más frecuente es el anticardiolipina de isotipo IgG, el cual se detecta en un 46,7%. De los pacientes que sufrieron evento trombótico, en el 45,94% se detectó anticardiolipina de isotipo IgM, frente al 43,24% con anticoagulante lúpico, y únicamente en el 16,22% se observó la presencia de anticardiolipina de isotipo IgG.
Conclusiones: El anticuerpo antifosfolípido que altera en mayor medida las pruebas de coagulación es el anticoagulante lúpico. Los anticuerpos anticardiolipinas de isotipo IgM son los más frecuentes en síndrome antifosfolípido primario, mientras que los anticardiolipina de isotipo IgG se asocian en mayor grado a SAF secundario, especialmente en pacientes con lupus eritematoso sistémico. Los anticuerpos anticardiolipinas de isotipo IgM representan un mayor riesgo de padecer eventos trombóticos en pacientes con anticuerpos antifosfolípidos positivos.
Palabras clave: Anticuerpo; Trombosis; Antifosfolípido.
Abstract
Objective: To know the relationship between the presence of three antiphospholipid antibodies: lupus anticoagulant and the anticardiolipin of isotypes IgM and IgG with the development of thrombotic events and alterations in coagulation and also, study the clinical environment in which those antibodies appear.
Material and methods: Cross-sectional descriptive study in which we have analyzed retrospectively, in 123 patients with positive results for at least one of the antiphospholipid antibodies under study, their alterations in coagulation, if they suffer or have suffered any thrombotic event and the clinical environment in which these antibodies appear and.
Results: 52,1% of patients with positive lupus anticoagulant have some type of abnormality in coagulation tests, compared with 43,75% of patients with anticardiolipin of isotype IgG and 24,64% of patients with anticardiolipin of isotypes IgM. The most frequent antibody in patients with primary antiphospholipid syndrome is anticardiolipin of isotypes IgM, which appears in 75%, while in the case of patients with secondary antiphospholipid syndrome due to erythematosus systemic lupus, the most frequent antibody is anticardiolipin of isotypes IgG, which is detected in 46,7%. Among the patients who suffered thrombotic event, in 45,94% anticardiolipin of isotypes IgM was detected, compared with 43,24% with lupus anticoagulant, and only 16,22% with anticardiolipin of isotype IgG.
Conclusions: The antiphospholipid antibodies that alters coagulation tests to a greater extent is the lupus anticoagulant. Anticardiolipin of isotype IgM antibodies are the most frequent in primary antiphospholipid syndrome while anticardiolipin of isotype IgG are associated in a greater degree with secondary antiphospholipid syndrome, especially in patients with erythematosus systemic lupus. Anticardiolipin of isotype IgM antibodies represent a higher risk of thrombotic events in patients with positive antiphospholipid antibodies.
Keywords: Antibody; Thrombosis; Antiphospholipid.
Leer Artículo Completo
INTRODUCCIÓN
Anticuerpos Antifosfolípido
Los anticuerpos antifosfolípido (aFL) representan un grupo heterogéneo de inmunoglobulinas que pueden ser de isotipos IgA, IgM o IgG dirigidos contra componentes de carácter lipídico de la membrana celular(1). Estos fosfolípidos pueden ser de carácter lipídico como la cardiolipina o proteínas plasmáticas de unión a fosfolípidos como la β2-glicoproteína 1 (β2GPI) y/o los complejos que se forman por la unión de ambos (1). Existen diferentes fosfolípidos frente a los que actúan los aFL y algunos resultan cada vez más importantes en la patogenia asociada con fenómenos trombóticos, como la cardiolipina, fosfatidilserina, fosfatidilinositol o fosfatidilcolina (1). Además, los aFL también pueden actuar frente a proteínas de unión a fosfolípidos o cofactores, como la β2GP1, anexina V, proteínas C y S o la proteína de unión a la protrombina C4b (1).
Dentro de este grupo de anticuerpos, los más importantes son los anticardiolipinas (aCL) y los anti-β2GP 1, aunque existen otros tipos, como la anti-protrombina y anti-fosfatidilserina. Los dos primeros se detectan mediante técnicas de enzimo-inmunoanálisis(2) y con el anticoagulante lúpico (AL) constituyen los criterios de laboratorio para el diagnóstico del síndrome antifosfolípido (SAF) (3).
El AL no constituye un anticuerpo reconocido contra una estructura concreta, es un fenómeno por el cual los aFL interfieren y alterar in vitro determinaciones analíticas basadas en los tiempos de coagulación que dependen de la presencia de fosfolípidos, prologándolos (1). Fundamentalmente el tiempo de tromboplastina parcial activado (TTPA) que mide la actividad de las vías intrínseca y común de la coagulación, tiempo de coagulación con caolín, tiempo de veneno de víbora de Russell diluido (esta sustancia es capaz de inducir trombosis) y activador de la fase de contacto de la vía intrínseca (1).
El presente trabajo se centra en el estudio de los aFL y su relación con el SAF primario, además de enfermedades reumatológicas o vasculares en las que pueden aparecer. Los aCL se dirigen contra un fosfolípido aniónico conocido como cardiolipina. No obstante, estos pueden reaccionar con otras moléculas, como β2-GP1, protrombina y fosfatidilinositol (3). Se pueden clasificar según el isotipo en IgM, IgG o IgA y en función de si son dependientes o independientes de la β2-GP1. Los aCL dependientes de la β2-GP1 se observan con más frecuencia en el SAF, mientras que aquellos que son independientes del cofactor suelen aparecer de forma transitoria en las enfermedades infecciosas (3).
Los aCL y el AL son las determinaciones analíticas más utilizadas para el diagnóstico del SAF. No obstante, los aFL también aparecen en otras enfermedades autoinmunes, en infecciones, cáncer, consumo de determinados fármacos e incluso en pacientes sanos. La presencia aislada de aFL en un paciente asintomático, especialmente en una ocasión, no permite establecer el diagnóstico de SAF (2).
La concordancia entre la presencia de AL y aCL es de aproximadamente un 85% (3). En muchos casos, sin embargo, el AL incluye una población diferente de anticuerpos (3). Por lo tanto, las pruebas se deben realizar tanto para AL como para aCL y anti-β2GPI si se sospecha SAF sobre una base clínica (3).
MATERIAL Y MÉTODOS
Se trata de un estudio descriptivo transversal, llevado a cabo en el Hospital General Universitario de Ciudad Real (HGUCR), en el que se han revisado las historias clínicas de un grupo de pacientes seleccionados por presentar resultados positivos en la determinación de aCL y AL.
Pacientes
Se estudiaron pacientes con resultados positivos para aCL y/o AL durante un periodo de seis meses, con el objeto de analizar las alteraciones en la coagulación, la relación entre aCL y AL y el entorno clínico en el que se presentan estos autoanticuerpos.
Para acceder a los datos clínicos y analíticos de los pacientes, se han utilizado los sistemas de historia clínica electrónica MAMBRINO XXI y de Laboratorio SIGLO, respectivamente. Se recogieron datos analíticos acerca del perfil de coagulación básico (tiempo de protrombina, TTPA y fibrinógeno) que se realizaron utilizando las técnicas habituales en el laboratorio de hematología. En cuanto a los aspectos clínicos se recogieron datos correspondientes a los diagnósticos y la presencia o no de eventos trombóticos.
Determinación del anticoagulante lúpico (AL)
Para su detección se ha utilizado el test del veneno de víbora de Russell. Este test se basa en la capacidad de esta sustancia para inducir la activación de la coagulación en presencia de fosfolípidos. El principio coagulante presente en el veneno es una enzima que activa directamente al factor X de la cascada de la coagulación. El factor X activado cataliza la transformación de protrombina a trombina en presencia del factor V activado, calcio y fosfolípidos. En el test, se utilizan los fosfolípidos y veneno de la víbora de Russell a unas concentraciones que se encuentran en valores límites de actividad, para dar un tiempo de coagulación en torno a los 25 segundos. El utilizar estas concentraciones límite hace que el ensayo sea sensible a ligeras modificaciones en la actividad de los fosfolípidos presentes, actividad que se ve modificada por la presencia de anticuerpos antifosfolípido. Esto es debido a que estos anticuerpos interfieren con el rol promotor de la coagulación que cumplen los fosfolípidos en los ensayos in vitro’. Un TTPA prolongado (≥ 30 segundos) que no se corrige con la adición de un volumen igual de plasma normal sugiere la presencia de un AL en el plasma del paciente.
Detección de anticuerpos anti Cardiolipina (AcL)
Para la medición de los aCL IgM e IgG, se ha utilizado la técnica de ELISA para su determinación semicuantitativa en el suero (kit de Autoinmune EIA Anti-Cardiolipin Test de Bio-Rad). Las muestras de suero diluidas en un medio que contiene β2-GP1, calibradores y los controles se incuban en micropocillos recubiertos de cardiolipina. Esto permite que los aCL presentes reaccionen con el antígeno inmovilizado. Después de eliminar las proteínas séricas no unidas mediante lavado, se añaden los conjugados anti-IgG o anti-IgM humana marcados con peroxidasa de rábano picante, que forman complejos con los anticuerpos unidos a la cardiolipina. Tras un segundo lavado, el conjugado anticuerpo-enzima unida se analiza añadiendo tetrametilbencidina y agua oxígenada como sustrato cromógeno. El color se desarrolla en los pocillos a una intensidad proporcional a la concentración sérica de aCL.
Los resultados se obtienen determinando la densidad óptica de cada pocillo con un espectrofotómetro. El grado de coloración es proporcional a la cantidad de aCL presente en el suero del paciente. Las unidades se determinan en función de la coloración generada por calibradores con concentración de aCL conocidas, tanto para IgG como para IgM. La técnica realizada permite detectar la presencia de aCL tanto si se asocia con β2-GP1 como no, ya que este cofactor va añadido en el diluyente de muestras calibradoras y controles.
RESULTADOS
Pacientes
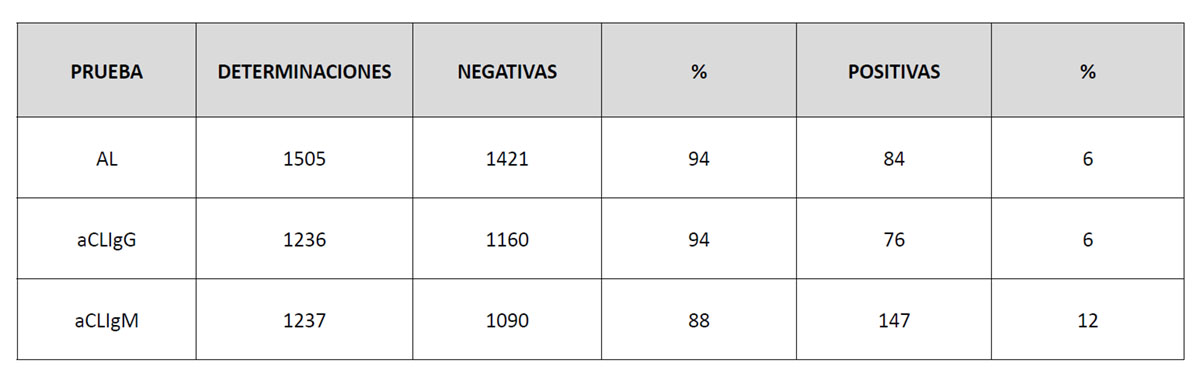
En el periodo analizado, se realizaron en el laboratorio del HGUCR solicitudes para la determinación de la presencia de aFL (AL y aCL) a aproximadamente 1500 pacientes. En la tabla 1 se presentan las solicitudes y sus resultados.
Tabla 1. Resultado de las determinaciones analíticas de anticuerpos antifosfolípido realizadas en el laboratorio de Inmunología del Hospital General Universitario de Ciudad Real.
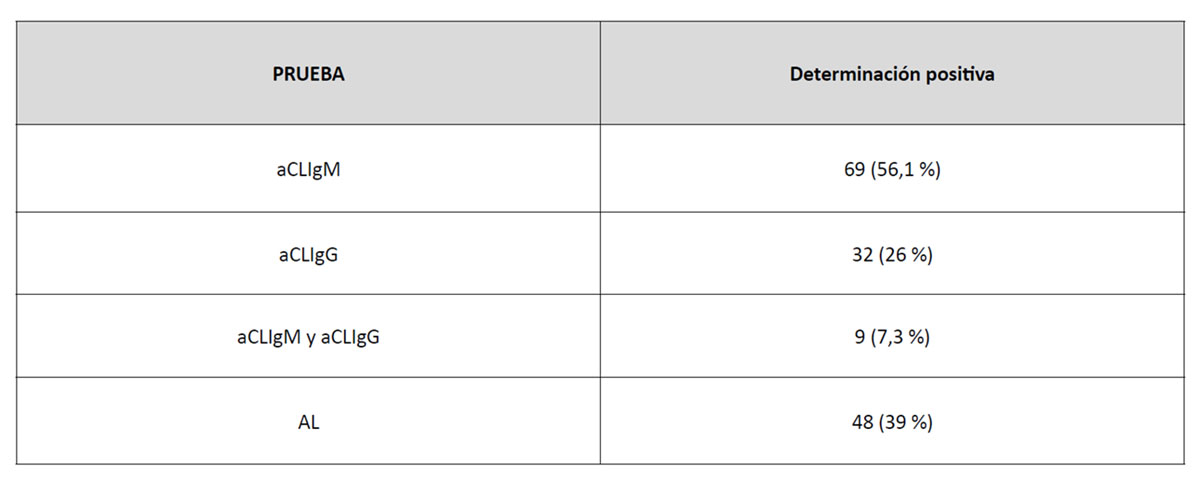
Se han seleccionado para el estudio un total de 123 pacientes que presentan aFL ya sean de los isotipos IgG o IgM y/o AL positivos tal como se muestra en la tabla 2. Se han excluido los pacientes que a pesar de tener aFL positivos, presentan una historia clínica incompleta que dificulta la interpretación de la información.
Tabla 2. Resultados de las determinaciones de anticuerpos antifosfolípido en los pacientes analizados en el estudio.
Datos demográficos de los pacientes
En cuanto a la distribución por sexos, de los 123 pacientes, 46 fueron hombres (37,4%) y 77 mujeres (62,6%). La edad promedio ha sido de 50,6 años ± 15,68 años de desviación standard. En el grupo de hombres, la media de edad ha sido de 52,9 ± 14,6 años y en el de mujeres de 49,2 años ± 16,23 años.
Alteraciones de la coagulación en función de la presencia de anticuerpos antifosfolípido
Al analizar la relación entre las pruebas de coagulación y la presencia de aFL, los resultados obtenidos fueron los siguientes:
- De todos los pacientes con determinación positiva para aCL IgM, 17 de ellos tienen algún tipo de variación en las pruebas de coagulación (24,64 %) frente a 52 cuyas pruebas son normales (75,36 %). En cuanto a los pacientes con positividad para aCL IgG, 14 de ellos han tenido alteradas las pruebas de coagulación (43,75 %) mientras que 18 no las han presentado (56,25 %). Se observa una mayor correlación del isotipo IgM de aCL con alteraciones de las pruebas in vitro de coagulación.
- En cuanto a los pacientes que han presentado pruebas positivas para la detección de AL, cabe destacar que aproximadamente la mitad de ellos poseen alguna alteración en las pruebas de coagulación (52,1 %).
Por lo tanto, el aFL que, a la vista de los datos, puede alterar más la coagulación es el AL frente a los aCL y dentro de estos, los aCL isotipo IgM se asocian con mayor alteración de la coagulación que los de isotipos IgG.
Diagnósticos asociados con la presencia de alteraciones de la coagulación y de anticuerpos antifosfolípido
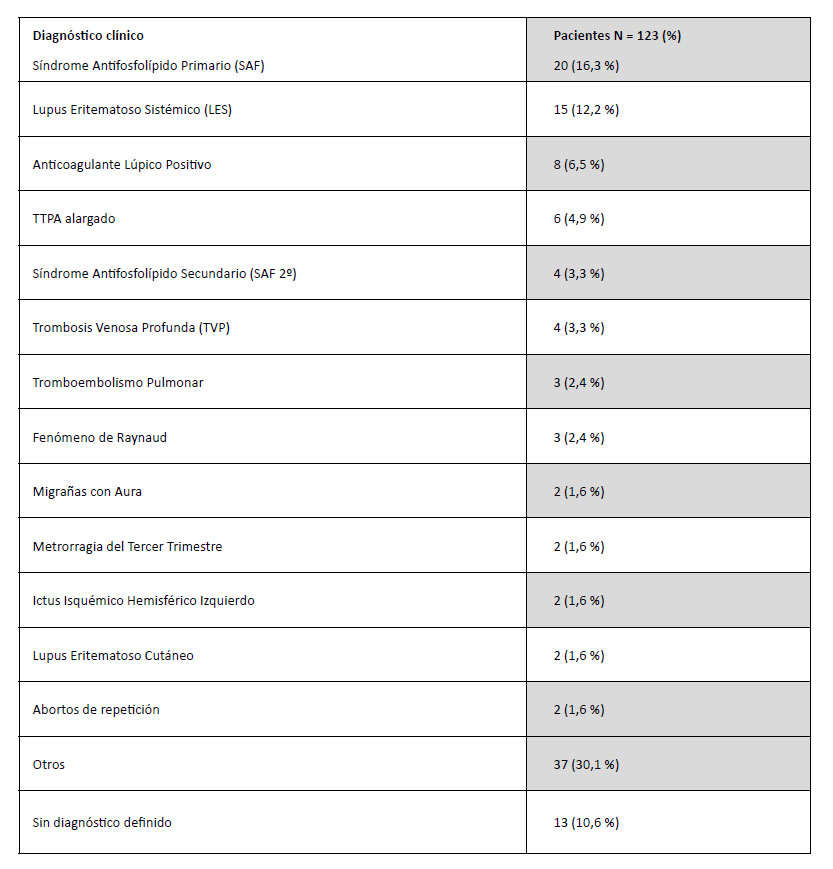
En la tabla 3, se presentan los principales diagnósticos detectados y su frecuencia en la población a estudio.
Tabla 3. Diagnósticos de la población a estudio.
Por lo tanto, los diagnósticos más frecuentes en nuestra población de estudio son el SAF primario y el lupus eritematoso sistémico (LES).
- El 75 % de los pacientes con SAF primario no presentan ninguna alteración de la coagulación y del 25 % restante que sí la presentan, cabe destacar que todos ellos tienen alterado únicamente el TTPA. En cuanto a los aFL presentes en estos pacientes, el 50 % tienen AL positivo, el 75 % presentan aCL IgM frente al 30 % con aCL IgG. Un 5 % tienen positivos ambos tipos de aCL.
- En cuanto a los pacientes con LES, el 33,3 % sí presentan alteraciones en las pruebas de coagulación, destacando que el 80 % de ellos tienen el TTPA alargado y un 20 % el TP alargado. Es muy interesante señalar que el anticuerpo más frecuente en los pacientes con LES es el aCL IgG, con un 46,7 % de los pacientes con resultado positivo, a diferencia de los pacientes con SAF primario, que presentan mayor positividad para el aCL IgM. El 6,7 % tienen los dos aCL positivos, resultado muy parecido al observado en el SAF primario. Con respecto al AL, solo el 33,3 % de los pacientes con LES presentan positividad. Los pacientes con LES presentan mayores alteraciones en la coagulación y el aFL predominante es el aCL IgG. Para corroborar estos resultados, de todos los pacientes recogidos en el estudio con SAF secundario no debido a LES, el 75% presentaban resultados positivos para aCL IgG. De los resultados se deduce que el aCL IgG puede indicar la presencia SAF asociado a otra patología autoinmune mientras que aCL IgM se asocia en mayor grado a SAF primario.
Eventos trombóticos en los pacientes
De los 123 pacientes analizados, 37 de ellos padecen o han padecido un evento trombótico (30%), mientras que 86 de ellos no (70%).
De los 37 pacientes con evento trombótico, 16 de ellos han tenido algún accidente cerebrovascular, 7 presentan o han presentado algún episodio de trombosis venosa profunda, 3 presentan tromboembolismo pulmonar, 2 han experimentado trombosis arterial, 1 ha sufrido un infarto agudo de miocardio y los 9 restantes han sufrido otros tipos de episodios trombóticos, como pueden ser el infarto renal y la disección aórtica, entre otros.
Eventos trombóticos en función de la presencia de anticuerpos antifosfolípido
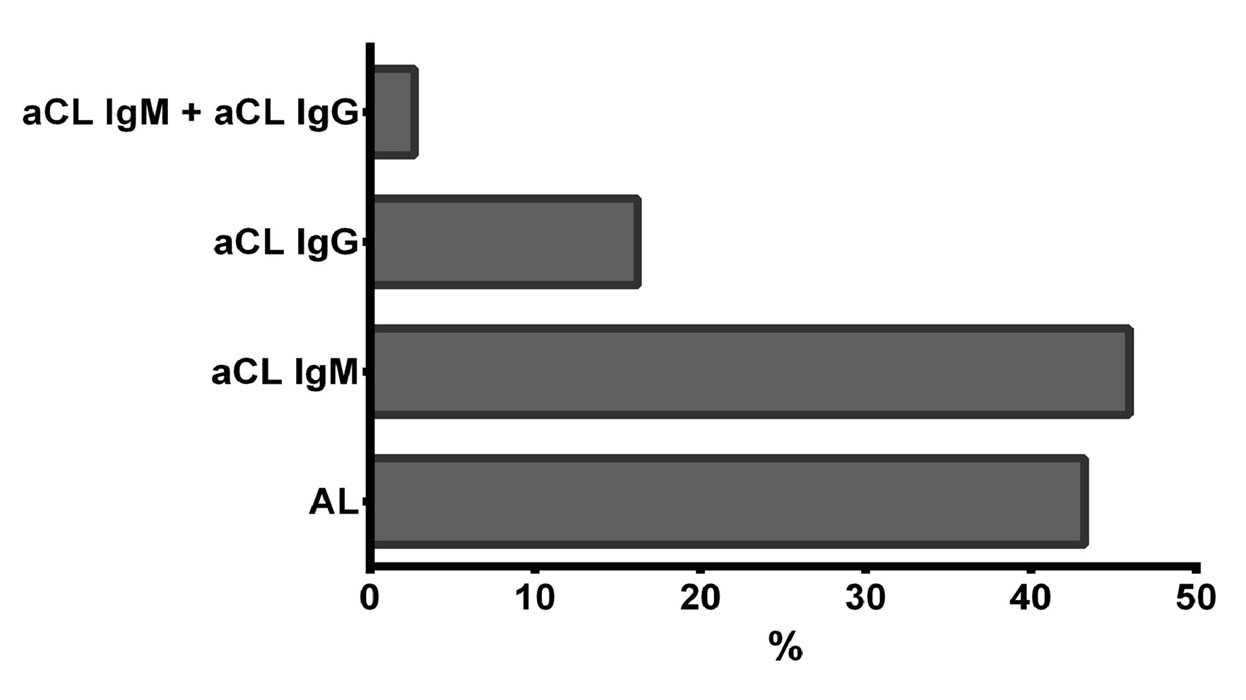
En la figura 1 se muestra el porcentaje de pacientes que, habiendo sufrido algún evento trombótico, presentan positividad para los aFL. Destaca que el mayor efecto de los aFL sobre el desarrollo de eventos trombóticos viene mediado por los aCL IgM.
Figura 1. Presencia de anticuerpos antifosfolípido en pacientes que presentan o han presentado al menos un evento trombótico.
No obstante, el AL también aparece en un porcentaje significativo de los pacientes con algún evento trombótico, en concreto en el 43,24% de los pacientes, frente al 45,94% de los pacientes que habiendo presentado algún evento trombótico, mostraban positividad para aCL IgM. Por el otro lado, el aCL IgG sólo aparece en el 16,22% de los pacientes con episodio trombótico. Resulta interesante señalar que de todos los pacientes que presentan o han presentado algún episodio de trombosis venosa profunda, solamente uno de ellos presenta positividad para aCL IgG. Destaca de estos resultados el efecto que los anticuerpos aCL IgM y en menor grado el AL tienen sobre la predisposición de sufrir eventos trombóticos.
DISCUSIÓN
La presencia de aFL es el factor de riesgo más importante para el desarrollo del SAF y se encuentra relacionado con los eventos trombóticos y los abortos de repetición. No obstante, estos anticuerpos también pueden aparecer en otros contextos clínicos, como por ejemplo en el LES. En nuestro trabajo, el aFL más frecuentemente observado en el aCL IgM, seguido de AL y de aCL IgG. Este resultado es congruente resultados de trabajos anteriores (4-11).
Con respecto al AL, cabe destacar que, debido a la naturaleza funcional de la prueba, este aFL se encuentra asociado a la presencia de otras alteraciones de la coagulación, como pueden ser las prolongaciones de los tiempos de protrombina o de cefalina. Estos resultados son lógicos teniendo en cuenta que AL es una prueba funcional de coagulación in vitro dependiente de fosfolípidos y no es una determinación de un anticuerpo específico. No obstante, dicha asociación con alteraciones de la coagulación implica una relación con la presencia de eventos trombóticos algo inferior a la presencia de aCL IgM. En nuestro trabajo, se ha observado que el aFL que más se asocia con la presencia de episodios trombóticos no es el AL, sino el aCL IgM. Este resultado concuerda con el de un estudio realizado por Locht y Wiik, en el que se llevaron a cabo determinaciones para aCL IgM y aCL IgG en 162 pacientes que habían padecido algún evento trombótico en los 6 meses anteriores al análisis, y se observó que el aFL que aparecía en un mayor número de pacientes era aCL IgM(12). No obstante, en nuestro estudio, la asociación de AL con trombosis también es significativa, aunque sea ligeramente inferior a la de aCL IgM con evento trombótico. En un estudio realizado sobre 526 pacientes suecos con LES, se determinó que el aFL más frecuentemente observado era el AL seguido de aCL IgM y aCL IgG, y además, se llegó a la conclusión de que el AL tenía una asociación significativa con la presencia de eventos trombóticos(13). Por lo tanto, podemos afirmar que tanto aCL IgM como el AL se encuentran asociados a la presencia de evento trombótico, frente a aCL IgG, cuya asociación no es significativa.
En cuanto al tipo de evento trombótico, arterial o venoso, en nuestro trabajo no se ha encontrado positividad para los aCL en los pacientes con trombosis arteriales. Sin embargo, existe una asociación de aCL IgM con eventos trombóticos venosos. Nuestros resultados concuerdan con un estudio retrospectivo sobre 130 pacientes con LES y 35 pacientes con SAF primario que encontró una asociación de aCL IgM con eventos trombóticos venosos (14).
Con respecto a la relación existente entre los aFL y las patologías más frecuentes en nuestra población de estudio, resulta interesante señalar que el aFL que se observa con mayor frecuencia en los pacientes que presentan como diagnóstico principal SAF primario es el aCL IgM, dato coincidente con el resultado de un artículo realizado por Del Ross et al, en el que se llevaron a cabo una serie de determinaciones de aFL en 106 pacientes con SAF primario y se pudo demostrar la relevancia clínica del aCL IgM en esta patología, especialmente cuando concurrían eventos trombóticos venosos y/o arteriales (15). Además, a partir de este estudio, se empiezan a considerar los anticuerpos aCL IgM y anti-β2GPI como criterios de laboratorio válidos para la clasificación del SAF primario, especialmente cuando éstos se encuentran asociados y estables con el paso del tiempo (15).
En cuanto a los pacientes con LES, el aFL que aparece con mayor frecuencia en ellos es el aCL IgG. Esta conclusión es similar a la obtenida en un estudio descriptivo transversal en el que se midieron los títulos de los anticuerpos aCL IgM y aCL IgG en 155 pacientes con LES en el este y el oeste de la India y se observó que el 32,9% de ellos presentaban determinación positiva para aCL IgG frente al 31,5% que mostraba positividad para aCL IgM y el 16,4% para ambos anticuerpos simultáneamente(16).
CONCLUSIONES
En este estudio se observa que el anticuerpo más frecuente en la población analizada fue el aCL IgM, seguido del AL y el menos frecuente, el aCL IgG, y que aquel que presentó mayor relación con alteraciones en las pruebas de coagulación in vitro era el AL, aunque esto no tuvo correlación con eventos trombóticos en los pacientes. Además, en el SAF primario, el anticuerpo más frecuente era aCL IgM, a diferencia del SAF secundario, donde el anticuerpo más frecuente era aCL IgG.
Con respecto a los diagnósticos, los más prevalentes en pacientes con aFL positivos fueron el SAF y el LES. En cuanto a los eventos trombóticos, un 30% de los pacientes con aFL positivos presentaron en algún momento al menos un fenómeno trombótico. Los fenómenos trombóticos más frecuentes en los pacientes con aFL positivos fueron los accidentes cerebrovasculares y la trombosis venosa profunda y el aFL que se asoció en mayor grado con fenómenos trombóticos fue el aCL IgM, y el menor el aCL IgG.
BIBLIOGRAFÍA
- ↑ Sobrino Grande C, Villalobos Sánchez L, Valero Expósito M, García Villanueva MJ. Síndrome antifosfolípido. Medicine – Programa de Formación Médica Continuada Acreditado. marzo de 2017;12(27):1551-9.
- ↑ Connors JM. Thrombophilia Testing and Venous Thrombosis.Longo DL, editor. N Engl J Med. 21 de septiembre de 2017;377(12):1177-87.
- ↑ Ahluwalia J, Sreedharanunni S. The Laboratory Diagnosis of the Antiphospholipid Syndrome.Indian J Hematol Blood Transfus.marzo de 2017;33(1):8-14.
- ↑ Stojanovich L, Kontic M, Djokovic A, Ilijevski N, Stanisavljevic N, Marisavljevic D. Pulmonary events in antiphospholipid syndrome: influence of antiphospholipid antibody type and levels. ScandinavianJournal of Rheumatology. mayo de 2012;41(3):223-6.
- ↑ Camargo EW, Freire PV, Silva CA, Santos NR dos, Mota LMH da, Pereira RMR, et al. Antiphospholipid syndrome plus rheumatic fever: a higher risk factor for stroke? Rheumatol Int. junio de 2012;32(6):1721-5.
- ↑ Sahebari M, Rastin M, Boostani R, Forughipour M, Hashemzadeh K, Sadeghi SH. Subtypes of Antiphospholipid Antibodies in Neurologic Disorders: An Observational Study. CRR. 12 de diciembre de 2018;15(1):59-66.
- ↑ Duarte-García A, Romero-Díaz J, Juárez S, Cicero-Casarrubias A, Fragoso-Loyo H, Núñez-Alvarez C, et al. Disease activity, autoantibodies, and inflammatory molecules in serum and cerebrospinal fluid of patients with Systemic Lupus Erythematosus and Cognitive Dysfunction.Liossis S-N, editor. PLoS ONE. 3 de mayo de 2018;13(5):e0196487.
- ↑ Hu Z, Jing X, Liu J, Li M, Ye Y, Chen Y. Simultaneous Quantification of Anticardiolipin IgG and IgM by Time Resolved Fluoroimmunoassay. D’Auria S, editor. PLoS ONE. 23 de septiembre de 2016;11(9):e0163682.
- ↑ Wysokinska EM, Wysokinski WE, Brown RD, Karnicki K, Gosk-Beirska I, Grill D, et al. Thrombophilia differences in cerebral venous sinus and lower extremity deep venous thrombosis. Neurology. 19 de febrero de 2008;70(8):627-33.
- ↑ Mehta N, Uchino K, Fakhran S, Sattar MA, Branstetter BF, Au K, et al. Platelet C4d Is Associated With Acute Ischemic Stroke and Stroke Severity. Stroke. diciembre de 2008;39(12):3236-41.
- ↑ Palomo I, Pereira J, Alarcón M, Vásquez M, Pinochet C, Vélez MT, et al. Prevalence and isotype distribution of antiphospholipid antibodies in unselected Chilean patients with venous and arterial thrombosis.Clinical Rheumatology. 1 de abril de 2004;23(2):129-33.
- ↑ Locht H, Wiik A. IgG and IgM isotypes of anti-cardiolipin and anti-β 2-glycoprotein i antibodies reflect different forms of recent thrombo-embolic events. ClinRheumatol. marzo de 2006;25(2):246-50.
- ↑ Frodlund M, Vikerfors A, Grosso G, Skogh T, Wetterö J, Elvin K, et al. Immunoglobulin A anti-phospholipid antibodies in Swedish cases of systemic lupus erythematosus: associations with disease phenotypes, vascular events and damage accrual: IgA anti-APL antibodies and clinical events in Swedish cases of SLE. ClinExpImmunol. octubre de 2018;194(1):27-38.
- ↑ Samarkos M, Davies KA, Gordon C, Loizou S. Clinical significance of IgA anticardiolipin and anti-β2-GP1 antibodies in patients with systemic lupus erythematosus and primary antiphospholipid syndrome. ClinRheumatol. marzo de 2006;25(2):199-204.
- ↑ Del Ross T, Ruffatti A, Cuffaro S, Tonello M, Calligaro A, Favaro M, et al. The clinical relevance of the IgM isotype of antiphospholipid antibodies in the vascular antiphospholipid syndrome.Thrombosis Research.noviembre de 2015;136(5):883-6.
- ↑Doley D, Kakati S, Saikia L, Rajadhyaksha A, Nadkar M, Khadilkar P, et al. A Comparitive Study of Anticardiolipin Antibodies among Systemic Lupus Erythematosus Patients from Western and Eastern India. Journal of The Association of Physicians of India. marzo de 2017;65:14-9.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Pablo Herreros Fernández-Arroyo. Servicio de Anatomía Patológica. Hospital Universitario de Ciudad Real. C/ Holanda, 14 · 13005 Ciudad Real. E-mail: pherrerosf@sescam.jccm.es