Original
Aplicación de la Hematoxilina férrica de M. Heidenhain para el estudio de cortes semifinos (adenohipófisis humana)
Application of M. Heidenhain’s ferric haematoxylin for the study of semi-thin sections (human adenohypophysis)
Actual Med. 2021; 106(812): 24-29 DOI: 10.15568/am.2021.812.or03
Recibido: 12/10/2020
Revisado: 31/01/2021
Aceptado: 15/04/2021
Resumen
La hematoxilina férrica de Heidenhain ha sido una de las técnicas citológicas clásicas de mayor utilidad. Su capacidad de teñir múltiples estructuras celulares y extracelulares al mismo tiempo la convierte en una técnica histológica general.
En el presente trabajo se describe su aplicación a cortes semifinos tomando como ejemplo la adenohipófisis humana, discutiendo sus mecanismos de tinción y demostrándose su utilidad para evidenciar la variabilidad citológica y realizar análisis de imagen.
Palabras clave: microscopía óptica; Técnica histológica; Hematoxilina férrica de heidenhain; Cortes semifinos variabilidad citológica; Análisis de imagen.
Abstract
Heidenhain´s iron hematoxylin has been one of the most useful methods of classical cytology. Its ability to stain simultaneously many cell and extracellular structures makes it a general purpose histological technique.
This current work describes its application to semithin sections, using human adenohypophysis, discussing the staining mechanism and showing his usefulness to evidence cytological variability and to perform image analysis.
Keywords: Optical microscopy; Histological technique; Heidenhain’s iron hematoxylin; Semithin sections; Cytological variability; Image analysis.
Leer Artículo Completo
INTRODUCCIÓN
En ninguna rama de las ciencias biológicas han sobrevivido tantas técnicas históricas simples en su forma original como en las técnicas microscópicas. La coloración selectiva es la manera clásica de obtener contraste e identificar estructuras en microscopía de campo claro. Una de las técnicas citológicas clásicas de mayor utilidad ha sido la hematoxilina férrica de M. Heidenhain (1891) (1,2,3,4), originalmente desarrollada por Benda (1885-1886). Pese ser una tinción monocroma (en tonos grises y negros), tiñe con excelente contraste y finura numerosas estructuras citoplásmicas y destaca muy bien en los núcleos la arquitectura de la cromatina y varios cuerpos nucleares. Su selectividad por unos u otros orgánulos depende de la modalidad de fijación y se ajusta mediante cambios en el procedimiento de tinción. La coloración original en dos tiempos utiliza primero alumbre de hierro (sulfato férrico-amónico) como mordiente por un tiempo variable y luego se realiza una impregnación en la solución de hematoxilina: El método puede ejecutarse de manera progresiva, hasta obtener el tono deseado (controlando al microscopio la intensidad dela tinción), o mediante una estrategia regresiva, tiñendo muy intensamente y retirando con cuidado el exceso de colorante (diferenciación) mediante lavados en una solución diluida de sulfato férrico amónico. Los resultados son distintos porque algunas sustancias que tardan mucho en impregnarse de colorante no lo ceden fácilmente. La imagen microscópica, por tanto, depende de la facilidad de tinción (afinidad por el sustrato) pero también de la cantidad máxima de colorante (saturación de colorante) unido a algunas estructuras y de la compactación o fuerza de adhesión del colorante al sustrato (resistencia a la extracción). El mecanismo de tinción no es simple (5).
Su mecanismo químico de afinidad por un sustrato concreto, es por tanto muy complejo y, en la práctica, muy difícil de averiguar. Sabemos que tiñe la cromatina uniéndose al DNA, pero también por su componente histónico, como el carmín-bórax de Grenacher (1879), (un colorante ácido) que también tiñe los núcleos (8). Modificando la fijación y las condiciones de ejecución pueden teñirse los centriolos, las mitocondrias, numerosos tipos de gránulos de secreción, lisosomas, fagolisosomas, citoesqueleto (queratinas), y algunos pigmentos (lipofuchsina) e inclusiones, pero en cambio no es posible teñir la región del Golgi, las áreas de retículo endoplásmico y lípidos. La utilidad de esta técnica se basa precisamente en proporcionar distintos grados de contraste a diferentes porciones del núcleo y del citoplasma, dibujando una imagen muy particular de cada tipo de célula. Esto permite agruparlas por semejanza e identificarlas por su patrón de tinción.
La técnica original no necesita de ninguna contratinción (ácida o básica) pero pueden añadirse algunas coloraciones complementarias al mismo corte, aunque, en la práctica, raramente demuestran detalles adicionales y reducen la nitidez y el contraste de la imagen. Cuando se realiza una coloración en tonos grises suaves, es posible superponer un método de inmunofluorescencia. En este caso, a la localización específica del antígeno, se añade una imagen de fondo citológica y topográfica muy superior a las coloraciones nucleares o citoplásmicas de contratinción que suelen utilizarse habitualmente.
En el presente trabajo se describe la aplicación de la técnica original de M. Heidenhain para identificar estructuras citológicas en cortes semifinos de tejidos incluidos en glicolmetacrilato. Se trata de aplicar y ajustar el método aprovechando la resolución que permite el uso de cortes semifinos y la observación con objetivos de gran aumento. Un tejido adecuado para demostrar su utilidad es la adenohipófisis por presentar múltiples tipos celulares, diferentes tipos y tamaños de gránulos de secreción, una fina red de capilares sinusoides y escaso material extracelular.
MATERIAL Y MÉTODOS
Procesamiento del tejido.
Se han utilizado fragmentos de hipófisis humana, procedentes del archivo de necropsias del Departamento de Anatomia Patologica, Biología Celular e Histología de la Facultad de Medicina de la Universidad de Cádiz. La pieza previamente fijada en formol al 10% se incluyó en finas secciones frontales de 2mm de grosor en glicolmetacrilato. La glándula no presentaba lesiones macroscópicas. Se realizó la deshidratación progresiva del tejido con acetona de gradación creciente (70%, 80%, 95% y 100%) y a 4ºC, para evitar la retracción del material. La infiltración durante 24h se produce en agitación utilizando una primera solución de glicolmetacrilato catalizada con benzoilperóxido que se cambia por otra nueva durante 12h (9). El bloque se polimeriza mediante radiación UV (luz negra) en un frasco hermético y en ausencia de oxígeno (que inhibe la polimerización), lo que evita la reacción exotérmica cuando se utiliza un polimerizante. Los cortes se practicaron en un micrótomo motorizado Leica RM2155 con cuchillas de carburo de tungsteno y a un grosor de 1-2 micras. Se recogieron sobre un portaobjetos cubierto de agua ligeramente amoniacal y se secaron sobre una platina caliente. No es necesario utilizar adhesivos.
Tinción con Hematoxilina férrica de M. Heidenhain.
Se ha realizado siguiendo el método original en dos tiempos y con una estrategia regresiva (10). Los portas se sumergen a temperatura ambiente en una solución de sulfato férrico amónico 5% recientemente preparada por un mínimo de 6h o hasta el día siguiente (aprox.24h). Se escurren ligeramente y entonces se introducen en una solución de hematoxilina de Regaud (hematoxilina 1%, sin oxidar) (4) hasta la mañana siguiente. En esta solución los cortes se saturan de colorante, deben adquirir un color negro intenso, son opacos, y no se puede observar ningún detalle al microscopio. Para retirar el exceso de colorante, se lavan agitándolos lentamente a través de dos vasos: el primero con alumbre férrico al 5% hasta que se vuelven grises y el segundo al 2,5% para continuar lentamente la diferenciación (extracción del colorante). Conviene observar los cortes al microscopio (sin cubreobjetos y con un objetivo 10x/20x) para controlar la retirada de colorante. Cuando se alcanza un color gris pálido, se pueden lavar en agua abundante, secar en platina caliente y montar un cubreobjetos con DPX u otra resina de montaje.
Microfotografía y análisis de imagen.
Las preparaciones se estudiaron en un microscopio Leica DM2500 en campo claro, ajustando la apertura numérica del condensador para la iluminación de Koehler y con los objetivos de inmersión HCX PL Fluotar 63x/NA1,2 y 100x/NA1,3. Las microfotografías digitales se realizaron con una cámara CCD LeicaDFC495 de 8 megapíxeles y fueron adquiridas mediante el software LAS (LeicaApplication Suite), ajustando el histograma y a un tamaño (sin interpolación) de 2176×1632 píxeles. Las imágenes RGB se guardaron como ficheros TIFF (sin compresión) para utilizarlos con el software imageJ (FIJI) (11). Las imágenes RGB se separaron por canales para obtener la imagen 8-bit del canal verde (G), y presentar los valores de pixel en surface-plots que permiten visualizar intuitivamente: 1) la distribución de intensidad lumínica (verde) que corresponde a los gránulos de menor tamaño, 2) la superposición de la imagen de difracción de los bordes de objetos adyacentes y 3) la densidad óptica axial de cada gránulo. No abordamos aquí los problemas ni los límites reales de los algoritmos de segmentación para objetos cuyo tamaño se encuentra en el límite de resolución.
RESULTADOS
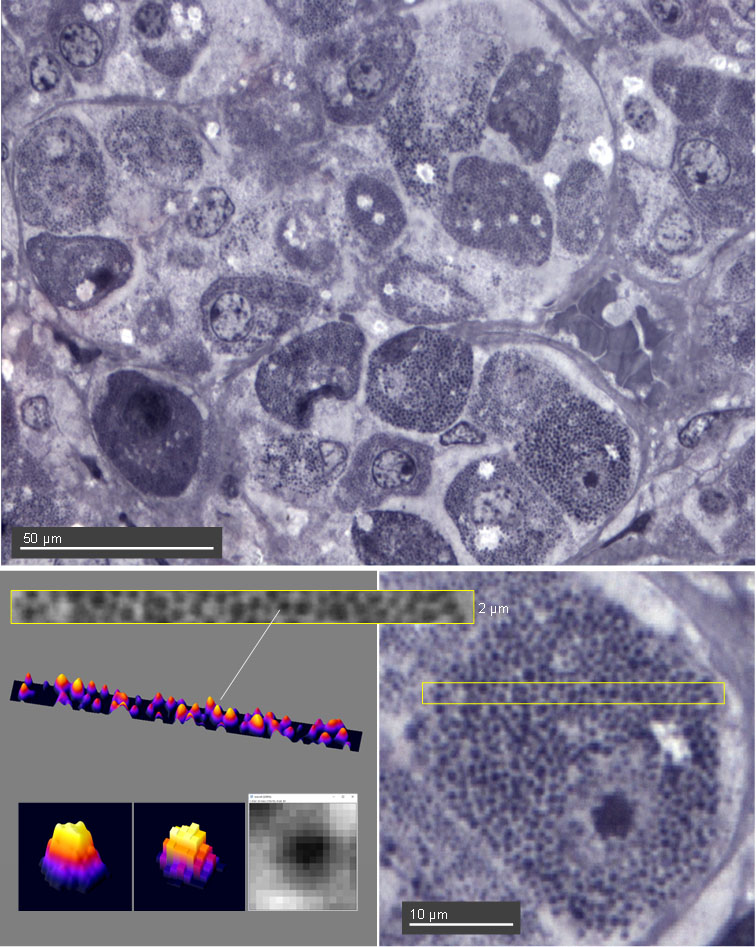
La coloración proporciona una gama de tonos grises que cubren un rango muy amplio de densidad óptica. Se observan todos los elementos de la estructura tisular de la adenohipófisis (12,13,14). Aparecen coloreados los núcleos, con buena definición de la membrana nuclear (por aposición de la cromatina periférica a la lámina nuclear). En el espacio extracelular se han teñido de modo difuso las fibras de reticulina y colágena que rodean el lecho capilar sinusoide y que forman los pequeños tabiques separando los cordones celulares. Se tiñen bien numerosos gránulos de secreción de varios tipos celulares (Figura1) Los tipos de gránulos se distinguen por su número, su agrupación espacial, su densidad óptica y su variación dentro de la misma célula. Se pueden utilizar para evaluar el contraste y la resolución del método (Figura2). Los más densos, homogéneos y abundantes corresponden con toda probabilidad a células de prolactina (PRL) en reposo que han proliferado y permanecido en la glándula tras un embarazo. Estas células forman grupos y presentan mucha regularidad citológica. Las células somatotropas (GH), más pequeñas, y que suelen ser la mitad de la población del lóbulo anterior no tienen tanta regularidad. Sus núcleos son semejantes pero la variabilidad del estado funcional en esta población, y la variación en tamaño y número de sus gránulos, nos impide reconocerlas a todas según criterios estrictamente morfológicos. Las siguientes células en abundancia, en hipófisis normales, suelen ser las gonadotropas (FSH, LH) pero también carecen de un aspecto homogéneo salvo en la presencia de gránulos diminutos, por debajo de la resolución del m. óptico convencional y que no se visualizan como entidades aisladas. Es muy posible que también se tiñan e impartan al citoplasma un aspecto grisáceo difuso. Las células corticotropas (ACTH, MSH, POMC) son poco frecuentes pero muy variables, de gránulos pequeños, y escasos. No es fácil asignarles unos rasgos citológicos regulares ni con esta coloración ni con ninguna otra. De hecho, constituyen gran parte de las células cromófobas y. además sufren con frecuencia procesos regresivos (cambio hialino de Crooke). Tampoco es posible asignar un aspecto citológico específico a las células tirotropas, aunque suelen presentar morfología alargada, pero son muy infrecuentes (5%) y con gránulos de aspecto y número muy variables.
Figura 1. Hematoxilina Férrica de Heidenhain. Hipófisis humana. Inclusión GMA. Corte semifino 2μm. Objetivo 63x /1,25 oil. Se observa perfectamente la variabilidad citológica de los distintos tipos de células hipofisarias. Es posible agruparlas según estos criterios (morfología nuclear y rasgos citoplásmicos) pero algunas de estas células no se pueden identificar correctamente sólo por sus rasgos morfológicos. Destacan las células mamotropas (de prolactina) abundantes y repletas de gránulos por tratarse de una mujer que ha tenido un embarazo previo. Una de ellas se ha seleccionado para visualizar los gránulos de secreción con software de análisis de imagen (ImageJ). La franja seleccionada en amarillo (2μm de ancho) equivale al grosor del corte. Por eso se puede ver en la imagen de esa zona y en la representación 3D (surfaceplot), que caben dos pisos de gránulos en el espesor del corte. Eso significa que en la microfotografía algunos gránulos se superponen inevitablemente a otros. Se ha seleccionado uno de los gránulos en un rectángulo de 1,43 x 1,43 μm (16 x 16 pixeles). El muestreo de la imagen por el CCD de la cámara no tiene suficiente resolución con este objetivo (63x) pero puede identificarse bien el área sobre el que se reparte la imagen de difracción del gránulo. No es posible medirlos con exactitud, pero es posible contar su número (aproximadamente puesto que algunos se superponen en el espesor del corte)
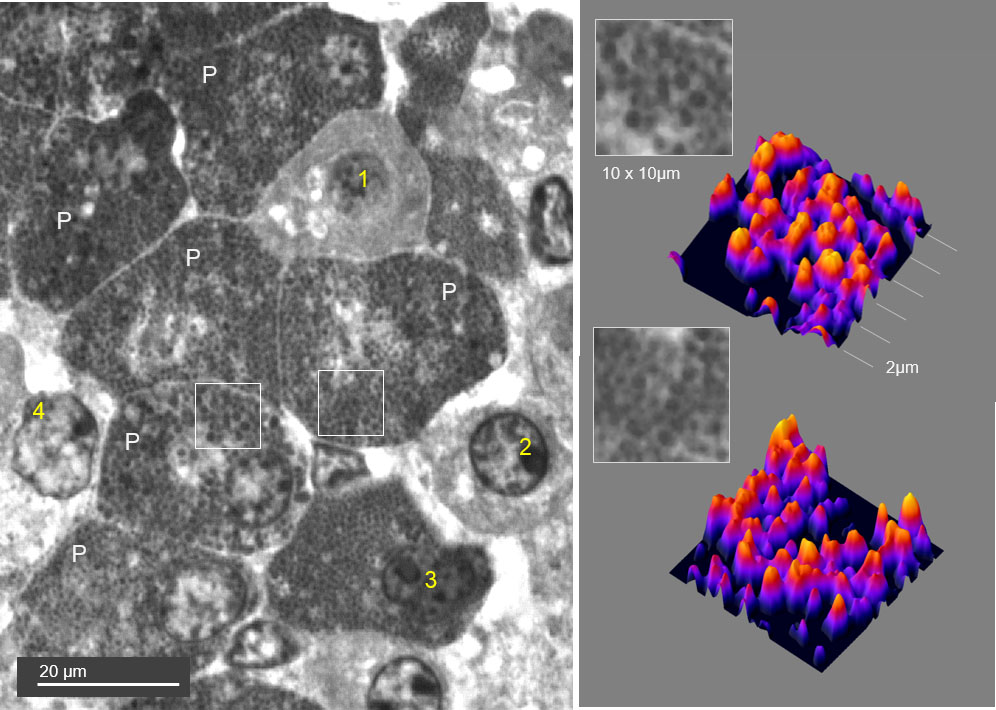
Figura 2. Hematoxilina Férrica de Heidenhain. Hipófisis humana. Inclusión GMA. Corte semifino 2μm. Objetivo 100x /1,30 oil. Agrupación de células mamotropas, de prolactina (P) en reposo y repletas de gránulos gruesos con áreas citoplásmicas más pálidas que corresponden al aparato de Golgi. La densidad de los granos es variable y su delimitación y medida es difícil puesto que no es posible una segmentación precisa de sus bordes mediante análisis de imagen.
Sin embargo, puede asegurarse que todas pertenecen a la misma estirpe y se diferencian claramente de la otras cuatro que son difíciles de identificar de modo fiable. La primera (1) destaca por su pequeño tamaño, ausencia de gránulos visibles, citoplasma gris homogéneo y tres espacios vacíos que pudieran corresponder a inclusiones lipídicas. La segunda (2) presenta el aspecto de una célula indiferenciada. La tercera (3) es otro tipo celular (¿somatotropa?) que está repleta de gránulos muy pequeños y tan cercanos difícil de reconocer visualmente como elementos separados. Tampoco es posible la separación (segmentación) informática de éstos. La cuarta (4) parece corresponder por su núcleo y su citoplasma grande y pálido a las células cromófobas de estirpe corticotropa. En este tejido, la información morfológica no es siempre suficiente para asignar las células a estirpes endocrinas concretas. Sin embargo, la coloración impregna detalles estructurales mínimos (diferentes granos de secreción) aunque algunos no puedan resolverse con un microscopio convencional. Las áreas seleccionadas (derecha) pueden visualizarse mejor mediante una representación tridimensional (surface-plot) e incluso establecer un recuento aproximado de los gránulos presentes en un área de 10 x 10 μm y de 2μm de grosor. Como no es una imagen fluorescente no puede realizarse una reconstrucción del espesor del corte con microscopía de barrido confocal (CLSM). En cambio, se podría visualizar los distintos planos del espesor del corte con microscopía de iluminación estructurada (SIM, Apotome©), mejorar la resolución y realizar la reconstrucción 3D.
Las únicas células que son inequívocamente identificables son las células foliculares (13) por su aspecto nuclear y citoplásmico, su morfología estrellada y su posición central en los cordones endocrinos. También podemos detectar escasas células que parecen ser indiferenciadas, de escaso tamaño y sin rasgos citoplásmicos significativos.
DISCUSIÓN
Sobre el mecanismo de tinción.
Una molécula de hematoxilina (sin oxidar y sin mordiente) es esencialmente un polifenol y se une débilmente a los tejidos por puentes de hidrógeno (de sus cuatro grupos fenol). Cuando la hematoxilina se oxida a hemateína, se pierde un átomo de hidrógeno del carbono que une ambos anillos fenólicos. Los dos orbitales π interaccionan a través de este carbono insaturado y se produce el cambio de color de la molécula. Además, uno de los grupos fenol se ioniza y el residuo [–O–] convierte la molécula de hemateína en un colorante aniónico (con carga negativa)(6).
El Fe3+ en solución forma un complejo con seis moléculas de agua, [Fe (H2O)6]3+.que se hidroliza y reduce su carga positiva [Fe (OH)2 (H20)4 ]+.Cuando el catión se une a una molécula de hemateína, también se ioniza el otro grupo fenólico adyacente al enlace iónico y el Fe3+ quedaría unido a dos átomos de oxígeno que actúan como bases de Lewis (donantes de electrones) al hierro. En la práctica, cuando los cortes mordentados con Fe3+ se introducen en una solución de hematoxilina, hay un exceso de colorante, éste se oxida a hemateína, y cada catión férricose une mediante enlace iónico a dos moléculas de colorante. En ese complejo [2hemateína:1Fe3+] si se ionizan los dos grupos fenoles adyacentes y se ionizan además dos moléculas de agua [OH–] unidas al catión férrico (7), el conjunto, en teoría, tiene carga negativa y debería actuar como un colorante ácido pero el patrón de tinción no se corresponde con los típicos colorantes ácidos.
El hierro unido al corte (como mordiente) por tanto, no es el mecanismo de anclaje al tejido y es extraído y secuestrado por la hemateína para formar el complejo [2hemateína:1Fe3+]. Esta laca férrica con la hemateína, aparenta ser un colorante básico, que tiñe la cromatina (basófila por su contenido de DNA), pero resulta que también tiñe igualmente los núcleos después de la extracción del DNA (uniéndose las histonas). En realidad, la laca se une al sustrato por su carga global, y por enlaces no covalentes: puentes de hidrógeno (de los grupos fenoles libres) y fuerzas de van der Waals. Hay que tener en cuenta, que tras la oxidación a hemateína y la formación de la laca férrica cada molécula sigue manteniendo dos grupos fenoles libres.
Sobre la resolución y contraste de las imágenes.
Los gránulos de secreción varían en número, densidad y distribución según el tipo de célula. Algunos tipos celulares no tienen gránulos visibles, no porque no se hayan teñido, sino porque suelen estar por debajo del límite de resolución. Se ha utilizado el software ImageJ para calibrar las medidas (en micras) y facilitar la visualización de la imagen de los gránulos (Figura 2) mediante la representación de los valores de gris de los pixeles en forma de surface-plot: Así se pueden contar, pero no medir porque, en esta escala de tamaño (fracciones de micra) el halo de difracción difumina los bordes y no pueden delimitarse ni medirse con exactitud. La segmentación algorítmica no es aplicable para aislar objetos que están delimitados por un gradiente (no un borde neto) y cercanos al límite de resolución.
Sobre su utilidad morfológica.
Resulta evidente que no podemos identificar los tipos celulares endocrinos de la adenohipófisis sobre bases exclusivamente morfológicas. Ni los colorantes, ni sus combinaciones (tetracromo de Herlant) (15, 16) ni las técnicas histoquímicas (17) han proporcionado nunca seguridad para la clasificación de los tipos celulares endocrinos (18,19,20). Los numerosos estudios de microscopía eléctrónica(21) solo han conseguido constatar la considerable variabilidad dentro de cada tipo celular. Solo la inmunohistoquímica (21,22) permite asignar hormonas específicas, y colocalizar distintos productos dentro de la misma célula, aunque siempre hay células en reposo, poco diferenciadas, o en degeneración, que no contienen suficiente hormona. Los marcadores de linaje (23,24)(detectables por inmunohistoquímica) son mucho más fiables, pero no señalan el estado funcional (ciclo secretor) como sí lo hace la detección del contenido hormonal. El método de la HFe no permite identificar las células endocrinas según criterios estrictamente morfológicos en microscopía óptica, Sabemos que no es así. Este tejido demuestra, en cambio, que podemos visualizar simultáneamente muchos detalles citológicos con hematoxilina férrica y describir la enorme variabilidad debida a la existencia de muchos tipos celulares (y estados funcionales) con un solo método, que proporciona una imagen monocromática, pero con un amplio rango de densidad óptica. Suministra muy buen contraste incluso en cortes de espesor mínimo con una escasa cantidad de material. Esta efectividad colorante solo es comparable (en contraste) al azul de toluidina, pero no en su patrón de tinción. Aunque no conozcamos la razón de su afinidad por unas u otras estructuras, el patrón de tinción de la HFe es reproducible con facilidad, aunque también puede ajustarse para modular el resultado. Es fácilmente fotografiable y puede ser estudiado mediante análisis de imagen para medir la cantidad relativa de colorante retenido por distintos orgánulos o sustratos. En resumen: un método que no es específico (como la histoquímica o la inmunohistoquímica), que solo proporciona una intensidad de tinción relativa de unos elementos con respecto a otros, y que produce distintos patrones de tinción según su ejecución, es sin embargo útil para visualizar diferentes tipos celulares en un territorio, o la variabilidad citológica dentro de una población homogénea. Corresponde al observador interpretar esta variabilidad en términos biológicos teniendo en cuenta el conocimiento previo del tejido y la información arquitectural o cuantitativa (o estereológica) que pueda deducirse mediante análisis de imagen.
REFERENCIAS BIBLIOGRÁFICAS
- ↑ Heidenhain M. Beiträge zur Kenntnis der Topographie und Histologie der Kloake und ihrer drüsigen Adnexe bei den einheimischen Tritonen. Arch. Mikr. Anat. 1890;35:173–274.
- ↑ Heidenhain M. Neue Untersuchungen über die Centralkörper und ihre Beziehungen zum Kern- und Zellenprotoplasma. Arch. Mikr. Anat.1894;43:423–758 .
- ↑ Heidenhain M. Hämatoxylin-Chromsalze. Enzyklopadie der Mikroskopischen Technik, Bd. I. 1910.
- ↑ Langeron M. Précis de microscopie : technique, expérimentation, diagnostic. Masson et Cie, Éditeurs. 1949.
- ↑ Woods AE. Haematoxylin and counterstains. In: Laboratory Histopathology A complete reference (eds. Woods AE, Ellis RC). Churchill Livingstone. 1995: 1–20
- ↑ Griffiths J. Recent developments in the colour and constitution of organic dyes. Rev Progr Color.11, 37–57 (1981). DOI: 10.1111/j.1478-4408.1981.tb03714.x
- ↑ Puchtler H, Meloan SN. Waldrop FS. Application of current chemical concepts to metal-hematein and-brazilein stains. Histochemistry. 1986; 85:353–364. DOI: 10.1007/BF00982665
- ↑ Baker JR. Cytological Technique: The principles and practice of methods used to determine the structure of the metazoan cell. Methuen & Co. Ltd. 1945.
- ↑ Hand N. Plastic Embedding Media and Techniques.In: Theory and Practice of Histological Techniques (eds. Bancroft JD, Gamble M) Churchill Livingstone. 2002:663–678.
- ↑ Puchtler H, Sweat F. On the mechanism of sequence iron-hematein stains. Histochemie. 1964;4:197–208. DOI: 10.1007/BF00290864
- ↑ Rasband W. S. ImageJ.
- ↑ Halmi NS. The Hypophysis. in Cell and Tissue Biology (ed. Weiss L). Urban & Schwarzenberg. 1988:973–994.
- ↑ Lopes M, Pernicone PJ, Scheithauer B, Horvath E, Kovacs K. Pituitary and Sellar Region. in Histology for Pathologists (ed. Mills SE) 2007:321–344.
- ↑ Krstic RV. Human Microscopy Anatomy. Springer-Verlag. 1997.
- ↑ Martoja R, Martoja-Pierson M. Técnicas de Histología Animal. Toray-Masson, S.A. 1970.
- ↑ Herlant M. The Cells of the Adenohypophysis and Their Functional Significance. Int. Rev. Cytol. 1964;17:299-382. DOI: 10.1016/s0074-7696(08)60409-x
- ↑ Pearse AGE. Histochemistry Theorical and Applied. J.& A. Churchill LTD. 1968.
- ↑ Ooi GT, Tawadros N, Escalona R. M. Pituitary cell lines and their endocrine applications. Mol Cel Endocrinol. 2004;228:1-21. DOI:10.1016/j.mce.2004.07.018.
- ↑ El Etreby MF, Tüshaus U. [Differential staining for the demonstration of growth hormone- and prolactin-producing cells of the anterior pituitary lobe]. Histochemie. 1973;33(2):121-7. DOI: 10.1007/BF00305740.
- ↑ Dubois PM, Amraoui AE, Héritier AG. Development and differentiation of pituitary cells. Microscopy Research and Technique. 1997;39(2):98-113 DOI: 10.1002/(SICI)1097-0029(19971015)39:2<98::AID-JEMT2>3.0.CO;2-S.
- ↑ Bazina M, Stefanović V, Božanić D, Saraga-Babić M. Ultrastructural and immunohistochemical characteristics of developing human pituitary gland. Acta Histochem. 2007;109(5):366-76. DOI: 10.1016/j.acthis.2007.03.005.
- ↑ Horvath E. Fine structural cytology and immunohistochemistry of the non-adenomatous pars distalis of the human pituitary. Pathol. Res. Pract. 1988;183(5):631-33. DOI: 10.1016/S0344-0338(88)80028-1.
- ↑ Larkin S, Ansorge O. Development and Microscopic Anatomy Of The Pituitary Gland. Endotext. 2000.
- ↑ Ilahi S, Ilahi TB. Anatomy, Adenohypophysis (Pars Anterior, Anterior Pituitary). StatPearls. 2018.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Jose María López-Cepero. Facultad de Medicina. Plaza Falla, 9 · 11003. Cádiz, España. E-mail: jose.lopezcepero@uca.es