Original
Dexametasona en pacientes no hospitalizados con infección por SARS-Cov-2
Dexamethasone in outpatients with SARS-CoV-2 infection
Actual Med.2022;107(815):34-38 DOI: 10.15568/am.2022.815.or04
Recibido: 06/05/2021
Revisado: 03/07/2021
Aceptado: 09/07/2022
Resumen
Objetivo: Evaluar la evolución clínica de los pacientes ambulatorios con infección por SARS Cov-2, que recibieron dexametasona en nuestro Centro de Salud.
Métodos: Se revisaron las historias clínicas de los pacientes a los que se les prescribió tratamiento con dexametasona desde Atención Primaria, en la fase aguda de la infección por SARS-CoV-2, sin criterios iniciales de gravedad. Describimos las características clínico-demográficas y los datos radiológicos y analíticos de tormenta de citoquinas, así como su evolución final.
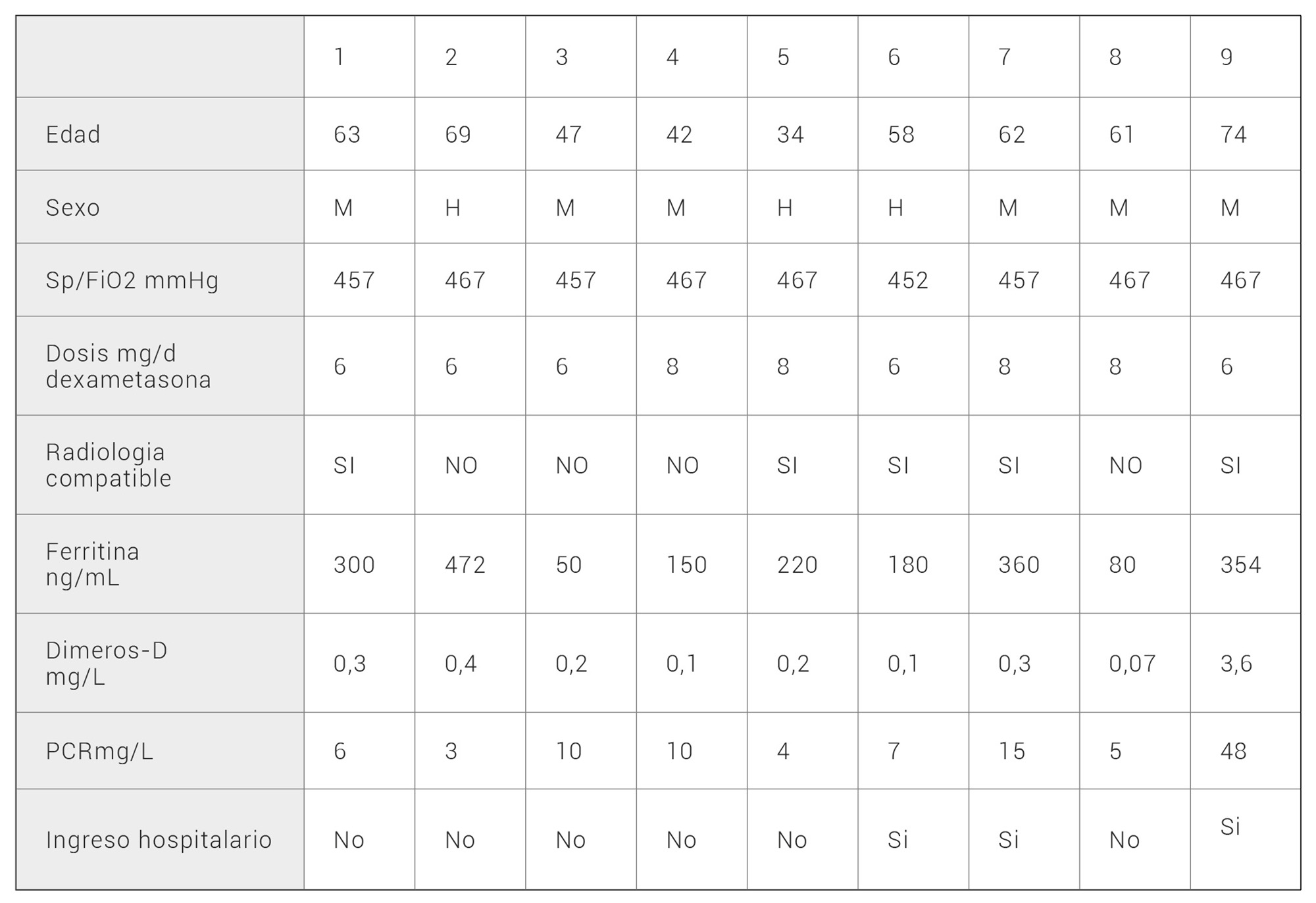
Resultados: se incluyeron un total de 9 pacientes, 6 mujeres y 3 hombres con una edad media de 56,6 (34-74) años. El motivo de consulta fue en todos los casos fiebre, con un tiempo medio desde inicio de los síntomas hasta su consulta de 4 (2-7) días. Todos los pacientes presentaron una relación entre saturación de oxígeno y fracción inspirada de oxígeno mayor de 450. De ellos, 5 pacientes presentaron hallazgos radiológicos compatibles con COVID y en 4 no se observaron infiltrados. Ningún paciente presentaba datos analíticos de síndrome de tormenta de citoquinas. La dosis de dexametasona recomendad fue de 6mg/d durante 7 días. En tres casos se requirió ingreso hospitalario, dos al tercer día y uno al cuarto del inicio de la dexametasona, resolviéndose el proceso intrahospitalario con pulsos de corticoides y antibióticos, sin necesidad de oxigenoterapia de alto flujo, ni de ventilación mecánica.
Conclusiones: el uso de dexametasona en pacientes con infección SARS-CoV-2 sin criterios de ingreso hospitalario no parece prevenir el riesgo de evolución a formas más graves. En ausencia de más datos, no parece recomendable el uso de dexametasona en esos casos, salvo que se requiera por otros motivos.
Palabras clave: Covid-19; Dexametasona; Atención Primaria.
Abstract
Objective: To evaluate the clinical evolution of outpatients with SARS Cov-2 infection, who received dexamethasone in our Health Center.
Methods: The medical records of the patients who were prescribed dexamethasone treatment from Primary Care, in the acute phase of the SARS-CoV-2 infection, were reviewed, without initial criteria of severity. We describe the clinical-demographic characteristics and the radiological and analytical data of the cytokine storm, as well as its final evolution.
Results: a total of 9 patients were included, 6 women and 3 men with a mean age of 56.6 (34-74) years. The reason for consultation was fever in all cases, with a mean time of 4 (2-7) days from onset of symptoms to consultation. All patients presented a relationship between oxygen saturation and inspired oxygen fraction greater than 450. Out of these, 5 patients presented radiological findings compatible with COVID and no infiltrates were observed in 4. No patient had laboratory data for cytokine storm syndrome. The recommended dexamethasone dose was 6 mg/d for 7 days. In 3 cases, hospital admission was required, 2 on the third day and one on the fourth day after the start of dexamethasone. These patients resolved the in-hospital process with pulses of corticosteroids and antibiotics, without the need for high-flow oxygen therapy or mechanical ventilation.
Conclusions: the use of dexamethasone in patients with SARS-CoV-2 infection without hospital admission criteria does not seem to prevent the risk of progression to more serious forms. In the absence of more data, the use of dexamethasone in these cases does not seem advisable, unless it is required for other reasons.
Keywords: Covid-19; Dexamethasone; Primary Care.
Leer Artículo Completo
INTRODUCCIÓN
La infección por SARS-CoV-2 tiene dos fases: una inicial de viremia en la que la mayoría de los pacientes presentan manifestaciones leves (81%) que se sigue, afortunadamente sólo en una minoría de los pacientes, de una fase inmune, en la que los pacientes desarrollan una enfermedad grave, caracterizada por una respuesta hiperinflamatoria definida como síndrome de tormenta de citoquinas con insuficiencia respiratoria grave, fracaso multiorgánico y la muerte (1).
En el ensayo clínico RECOVERY se concluyó que la administración de dexametasona disminuía la mortalidad en un grupo de pacientes que presentan neumonía grave (2). Desde entonces son varios los estudios que han demostrado la eficacia de diferentes tipos y dosis de corticoides en este grupo de pacientes (3–4).
Independientemente de este efecto beneficioso, el uso de dexametasona en estos pacientes se ha asociado con otras complicaciones como diabetes, hipertensión arterial y necrosis ósea avascular de la cabeza del fémur (5).
El papel de la dexametasona en la fase inicial y su influencia sobre la segunda fase no está bien establecido, pudiendo ser incluso perjudicial al poder producir un aumento en la carga viral del SARS-CoV-2 (6–7). Recientemente se ha publicado una serie de casos de pacientes hospitalizados por COVID-19 que habían recibido tratamiento ambulatorio con dexametasona, haciéndose una llamada a su uso con precaución en estos grupos de pacientes (8).
El objetivo de nuestro estudio es describir las características clínicas, analíticas y radiológicas y la evolución clínica final de los pacientes con infección por SARS-CoV-2 que no tenían criterios de neumonía grave y, por tanto, no requirieron ingreso hospitalario inicial, y que recibieron tratamiento con dexametasona.
PACIENTES Y MÉTODOS
Revisamos las historias clínicas de todos los pacientes que recibieron dexametasona en el tratamiento iniciales de la infección aguda por SARS-CoV-2, sin criterios de gravedad, en el período comprendido entre el 1 y 31 de enero de 2021. Se recogieron los datos clínicos, radiológicos, analíticos incluidos ferritina, proteína C reactiva y dímeros-D. Definimos síndrome de tormenta de citoquinas cuando la ferritina >500ng/mL y la PCR >100mg/dl. En los pacientes que requirieron finalmente ingreso hospitalario recogimos nuevamente los datos analíticos y radiológícos usando un sistema semicuantitativo desarrollado por la British Thoracic Imaging Society (9) para clasificar radiológicamente la afectación pulmonar como leve (< 25%), moderada (25–50%), o grave (>51%). Valoramos ingreso en la Unidad de Cuidados Intensivos y la necesidad de oxigenoterapia nasal de alto flujo (ONAF) y/o ventilación mecánica invasiva (VMI).
RESULTADOS
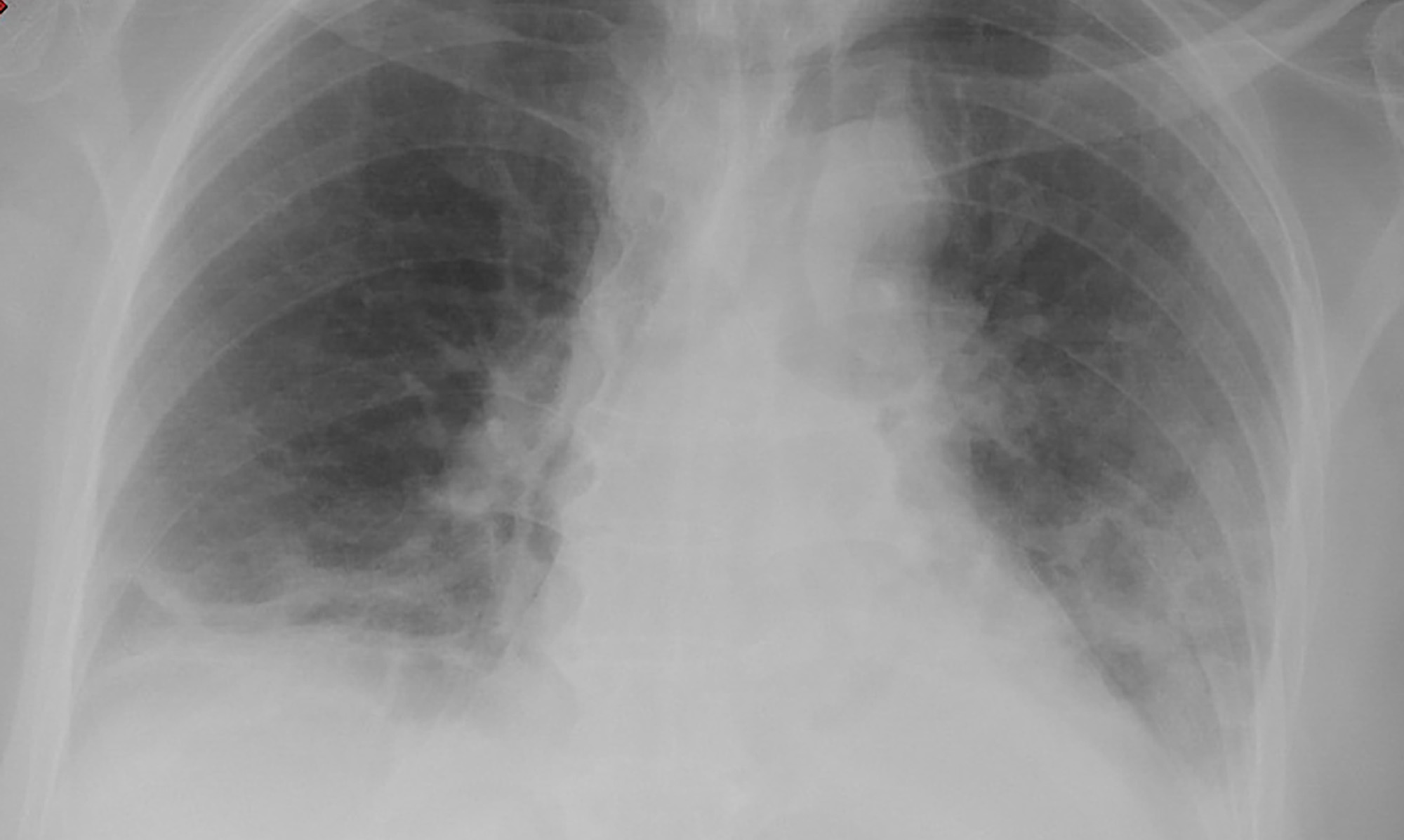
Se incluyeron un total de 9 pacientes, 6 mujeres y 3 hombres con una edad media de 56,6 (34-74) años. En la tabla 1 se describen las características de los pacientes del estudio. El motivo de consulta fue en todos los casos fiebre, con un tiempo medio desde inicio de los síntomas hasta su consulta de 4 (2-7) días. Todos los pacientes presentaron una relación entre saturación transcutánea de oxígeno y fracción inspirada de oxígeno (SaFi) encima de 450. En la radiografía simple de tórax, 5 pacientes presentaron hallazgos radiológicos compatibles con neumonía leve y en 4 no se observaron infiltrados. En la imagen radiológica de la figura 1 se observan infiltrados bilaterales que corresponde a una de las pacientes que requirió ingreso hospitalario por neumonía. Ninguno de los pacientes reunía criterios analíticos de síndrome de tormenta de citoquinas, con todos los pacientes con ferritina inferior a 500ng/mL La dosis recomendada al alta de dexametasona fue de 6mg/d durante 7 días en 5 pacientes y en el resto de 8mg/día durante 5 días. En tres casos se requirió ingreso hospitalario, dos a los tres días y uno al cuarto día del inicio de la dexametasona. Todos los pacientes que ingresaron presentaron criterios de síndrome de tormenta de citoquinas y desde el punto de vista radiológico, dos pasaron a tener una clasificación moderada y uno grave. Ninguno de los pacientes requirió ingreso en la Unidad de Cuidados Intensivos para ONAF ni VMI. El proceso se resolvió en todos los casos con pulsos de corticoides, siendo necesario el uso de tocilizumab en el paciente con neumonía grave.
Tabla 1. Variables clínicas de interés de los pacientes infectados por SARS-CoV 2 que recibieron tratamiento con dexametasona.
Figura 1. Radiografía de tórax en la que se observan infiltrados bilaterales en una de las pacientes que requirió ingreso hospitalario.
DISCUSION
En nuestra serie, el uso de dexametasona en pacientes con infección aguda por SARS-CoV-2 sin criterios de ingreso hospitalario no parece prevenir la evolución a formas más graves, requiriendo ingreso 3 de los 9 pacientes estudiados (33%).
Muchas han sido las controversias sobre el uso de los corticoides en los pacientes con infección por SARS-CoV-2. Al principio de la pandemia, su uso incluso estaba contraindicado por un supuesto aumento del riesgo de mortalidad como ocurría con su uso en la lesión pulmonar provocada por otros virus como el SARS y el MERS (10).
Sin embargo, pronto fueron los primeros artículos en los que se observó que en los pacientes con neumonías graves y en los pacientes con síndrome de tormenta de citoquinas, el uso de corticoides podría frenar de alguna manera la evolución hacia formas más graves, con un posible efecto beneficioso sobre la necesidad de ingreso en UCI para uso de VMI y mortalidad. Así Callejas et al reportaron una disminución de la mortalidad en una serie de 92 pacientes con neumonía grave con síndrome de tormenta de citoquinas (11).
Tras la publicación de los resultados favorables del ensayo clínico RECOVERY (2) en el que la dexametasona disminuía la mortalidad en los pacientes con neumonía grave por COVID, ha sido numerosos los estudios en los que se ha demostrado el beneficio de diferentes pautas de corticoides en estos pacientes, siendo actualmente el tratamiento básico en los casos con neumonías graves.
No es de extrañar que muchos médicos nos hayamos sentido tentados a su administración en algunos pacientes fuera de los criterios de inclusión del ensayo clínico; sin embargo, su papel en estas situaciones es desconocido. Se sabe, a partir de los resultados de estudios realizados en pacientes con enfermedades autoinmunes sistémicas, que la toma de corticoides con dosis medias de 10 mg/día o superiores de prednisolona o equivalentes, se relacionan con un aumento significativo de la mortalidad (12–13); esto se ha correlacionado fundamentalmente con un aumento de la viremia o una disminución de su aclaramiento (14). Callejas et al han observado incluso una mayor gravedad en los pacientes ingresados que previamente habían usado dexametasona (8).
En nuestra serie hemos observado que el uso de dexametasona no parece prevenir la evolución a formas más graves y que en el 33% de los casos en los que se usó, los pacientes requirieron ingreso hospitalario con desarrollo de síndrome de tormenta de citoquinas y empeoramiento radiológico. Se ha descrito además un aumento de complicaciones asociadas a su uso como son la diabetes, la hipertensión arterial o la necrosis ósea avascular (5).
Las limitaciones de nuestro estudio son fundamentalmente su carácter retrospectivo, no disponer de un grupo control sin dexametasona de las mismas características y el pequeño tamaño muestral. Aun así, los resultados nos parecen lo suficientemente interesantes como para prevenir de su uso fuera de ensayos clínicos.
Concluimos que hasta que los resultados de los estudios no demuestren un efecto beneficioso del uso precoz de los corticoides en la infección por SARS-CoV-2, pensamos que no deben usarse de forma habitual salvo que el paciente los requiera por otras patologías.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Krishnan A, Hamilton JP, Alqahtani SA, Woreta TA. COVID-19: An overview and a clinical update. World J Clin Cases. 2021 Jan 6;9(1):8-23. DOI: 12998/wjcc.v9.i1.8.
- ↑RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, et al. Dexamethasone in Hospitalized Patients with Covid-19 – Preliminary Report. N Engl J Med. 2020 Jul 17:NEJMoa2021436. DOI: 1056/NEJMoa2021436.
- ↑Pinzón MA, Ortiz S, Holguín H, Betancur JF, Cardona Arango D, et al. Dexamethasone vs methylprednisolone high dose for Covid-19 pneumonia. PLoS One. 2021 May 25;16(5):e0252057. DOI: 1371/journal.pone.0252057.
- ↑Raju R, V P, Biatris PS, J SJUC. Therapeutic role of corticosteroids in COVID-19: a systematic review of registered clinical trials. Futur J Pharm Sci. 2021;7(1):67. DOI: 1186/s43094-021-00217-3.
- ↑Chen F, Hao L, Zhu S, Yang X, Shi W, Zheng K, et al. Potential Adverse Effects of Dexamethasone Therapy on COVID-19 Patients: Review and Recommendations. Infect Dis Ther. 2021 Jul 22:1–25. DOI: 1007/s40121-021-00500-z.
- ↑Arora K, Panda PK. Steroid harms if given early in COVID-19 viraemia. BMJ Case Rep. 2021 Feb 4;14(2):e241105. DOI: 1136/bcr-2020-241105.
- ↑van Paassen J, Vos JS, Hoekstra EM, Neumann KMI, Boot PC, Arbous SM. Corticosteroid use in COVID-19 patients: a systematic review and meta-analysis on clinical outcomes. Crit Care. 2020 Dec 14;24(1):696. DOI: 1186/s13054-020-03400-9.
- ↑Callejas Rubio JL, Aomar Millan I, Moreno-Higueras M, Martín Ripoll L, Yuste Osorio E, Ríos-Fernández R. Caution with the use of dexamethasone in patients with COVID-19 in its initial phases. Rev Clin Esp. 2021 Mar 6. DOI: 1016/j.rce.2021.01.001.
- ↑COVID-19: BSTI STATEMENT AND GUIDANCE: https://www.bsti.org.uk/standards-clinicalguidelines/clinical-guidelines/covid-19-bsti-statement-and-guidance/INTERNET. Accessed 15 March 2020.
- ↑Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 2020; 395: 473-5. DOI: 1016/S0140-6736(20)30317-2.
- ↑Callejas Rubio JL, Luna Del Castillo JD, de la Hera Fernández J, Guirao Arrabal E, Colmenero Ruiz M, Ortego Centeno N. Effectiveness of corticoid pulses in patients with cytokine storm syndrome induced by SARS-CoV-2 infection. Med Clin (Engl Ed). 2020 Aug 28;155(4):159-161. DOI: 1016/j.medcle.2020.07.002.
- ↑Hyrich KL, Machado PM. Rheumatic disease and COVID-19: epidemiology and outcomes. Nat Rev Rheumatol. 2021 Feb;17(2):71-72. DOI: 1038/s41584-020- 00562-2.
- ↑Gianfrancesco M, Hyrich KL, Al-Adely S, Carmona L, Danila MI, Gossec L, Izadi Z, et al; COVID-19 Global Rheumatology Alliance. Characteristics associated with hospitalisation for COVID-19 in people with rheumatic disease: data from the COVID-19 Global Rheumatology Alliance physician-reported registry. Ann Rheum Dis. 2020 Jul;79(7):859-866. DOI: 1136/annrheumdis-2020-217871.
- ↑Ram-Mohan N, Kim D, Zudock EJ, Hashemi MM, Tjandra KC, Rogers AJ, et al. . SARS-CoV-2 RNAaemia predicts clinical deterioration and extrapulmonary complications from COVID-19. medRxiv [Preprint]. 2020 Dec 22:2020.12.19.20248561. DOI: 1101/2020.12.19.20248561.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Margarita Martínez-Zaldívar Moreno. Centro Salud Salvador Caballero. Distrito Sanitario Granada Metropolitano E-mail: margamzm@gmail.com