Revisión
Pasado y presente del tratamiento frente a la COVID-19
Past and present of COVID-19 treatment
Actual Med.2023;108(817):166-184 DOI: 10.15568/am.2023.817.rev02
Recibido: 25/08/2022
Revisado: 11/12/2022
Aceptado: 03/04/2023
Resumen
Desde el inicio de la pandemia por COVID-19 en diciembre de 2019 se han ido proponiendo y utilizando numerosos fármacos en un intento de hacer frente a esta nueva enfermedad, con frecuentes cambios y actualizaciones en las guías de tratamiento y sus recomendaciones. Así pues, este trabajo se plantea con el objetivo de mostrar cómo ha sido la evolución del tratamiento de la COVID-19 a lo largo de este periodo. Para ello, se llevó a cabo una revisión de la literatura disponible en Pubmed, MedRxiv y las guías de tratamiento WHO, NIH y NICE. En base a la información obtenida de estas fuentes se concluye que de todos los medicamentos propuestos, tan solo los corticoides, Remdesivir y Tocilizumab han mostrado algún beneficio en los estudios realizados en pacientes con COVID-19; mientras que Cloroquina, Hidroxicloroquina y Lopinavir/ritonavir, fármacos muy utilizados al inicio, han quedado totalmente descartados. Por su parte, Anakinra, Baricitinib y Colchicina han mostrado un potencial beneficio en los primeros estudios, aunque todavía no se tiene una clara evidencia de su eficacia que permita su recomendación como tratamiento en este tipo de pacientes. En cuanto a la anticoagulación, no hay evidencia que justifique el uso de dosis terapéuticas o intermedias en pacientes hospitalizados con COVID-19, por lo que a día de hoy se recomienda la administración de dosis profilácticas.
Palabras clave: SARS-COV-2; COVID-19; tratamiento; Hidroxicloroquina; Corticoides; Tozilizumab; Anakinra; Ritonavir; Redemsivir; Anticoagulación; Vitamina D; Baricitinib.
ABSTRACT
Since the onset of the COVID-19 pandemic in December 2019, many drugs have been proposed and used in an attempt to address this new disease, which has led to constant changes and updates to treatment guidelines and their recommendations. This review sets out what the evolution of COVID-19 treatment has been like throughout the pandemic. To this end, a review of the literature available on Pubmed, MedRxiv and the WHO, NIH and NICE treatment guides was carried out. Based on this information it has been seen that of all the proposed drugs, only corticosteroids, Remdesivir and Tocilizumab have shown some benefit in studies in patients with COVID-19; while Chloroquine, Hydroxychloroquine and Lopinavir/ritonavir, drugs widely used at the outset, have been completely discarded. On the other hand, although Anakinra, Baricitinib and Colchicine have shown a potential benefit in the first studies, there is still no clear evidence of its effectiveness that allows its recommendation as a treatment in this type of patients. As for anticoagulation, there is no evidence to justify the use of therapeutic or intermediate doses in patients hospitalized with COVID-19, so today prophylactic dose administration is recommended.
Keywords: SARS-COV-2; COVID-19; Treatment; Hydroxychloroquine; Corticosteroids; Tozilizumab; Anakinra; Ritonavir; Redemsivir; Anticoagulation; Vitamin D; Baricitinib.
Leer Artículo Completo
INTRODUCCIÓN
La enfermedad COVID-19 ha provocado más de 3 millones de muertes desde el inicio de la pandemia. Es necesario observar con perspectiva los fármacos que se han ido investigando y utilizando durante la pandemia. Para ello es indispensable conocer las tres fases o estadios en los que se divide la enfermedad: una fase viral o infección temprana, una fase de afectación pulmonar y, por último, una fase de respuesta inflamatoria sistémica (1), responsable del síndrome de distress respiratorio agudo (SDRA) que observamos en los pacientes más graves.
Por tanto, aunque establecer una terapia antiviral eficaz es importante en la lucha contra la COVID-19, encontrar inmunomoduladores capaces de bloquear la “tormenta de citoquinas” responsable de la fase más grave de la enfermedad, y saber el momento justo en el que utilizarlos, es crucial para reducir la mortalidad.
MATERIAL Y MÉTODOS
Se llevó a cabo una revisión de la literatura disponible en Pubmed, medRxiv y las guías NIH, WHO y NICE; indentificando los artículos con información relevante sobre el tratamiento de la COVID-19, publicados en Inglés y en Español, desde el inicio de la pandemia en diciembre de 2019 hasta marzo de 2021. Entre los términos utilizados en la búsqueda incluimos: SARS-COV-2, COVID-19 en combinación con treatment, chloroquine, hydroxychloroquine, lopinavir, remdesivir, interferon, tocilizumab, anakinra, baricitinib, colchicine, corticosteroids, dexamethasone. Se incluyeron artículos de revisión, series de casos, estudios observacionales, estudios quasi-experimentales, ensayos clínicos y metaanalisis. Debido a la gran cantidad de estudios publicados nos hemos centrado en aquellos que presentaban una evidencia científica más sólida.
RESULTADOS
FASE VIRAL
CLOROQUINA E HIDROXICLOROQUINA
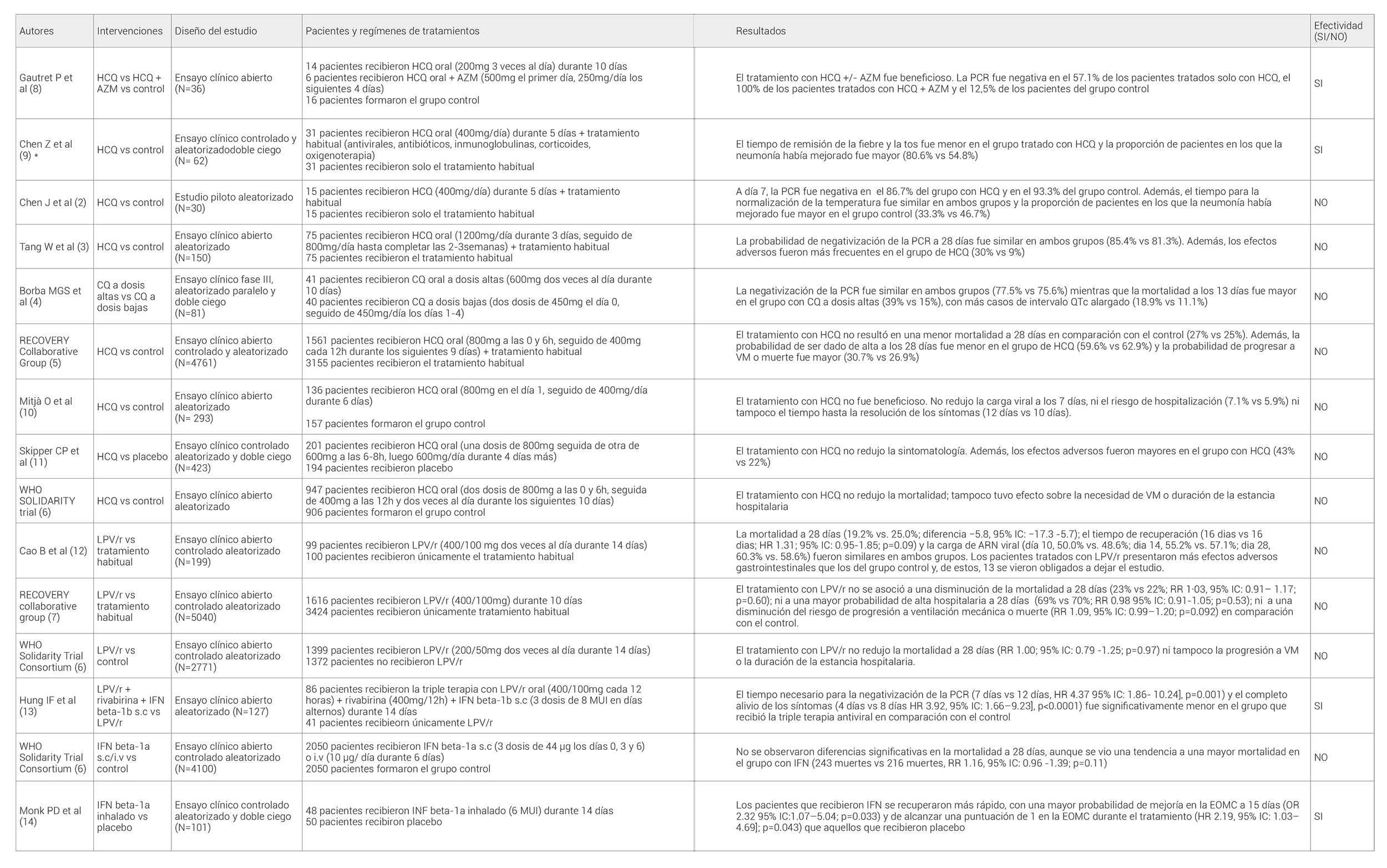
Multitud de artículos publicados al inicio de la pandemia (tabla 1) obtuvieron resultados positivos en el uso de cloroquina (CQ) e hidroxicloroquina (HCQ). Sin embargo, durante los meses de abril y mayo de 2020 se publicaron varios estudios experimentales (2,3,4), en los que el tratamiento con CQ o HCQ no resultó beneficioso y se asoció a efectos adversos como el alargamiento del intervalo QT.
Tabla 1. Estudios de cloroquina, hidroxicloroquina, lopinavir/ritonavir e interferon como tratamiento en pacientes con COVID-19. HCQ, hidroxicloroquina; AZM, azitromicina; UCI, unidad cuidados intensivos; PCR, reacción en cadena de la polimerasa; VM, ventilación mecánica.
* De estos artículos sólo está disponible la versión provisional puesto que no han sido publicados a fecha de la elaboración de este documento. LPV/r, lopinavir/ritonavir; HR, hazard ratio; IC, intervalo de confianza; RR, rate ratio; WHO, world health organization; VM, ventilación mecánica
Finalmente, en junio de2020 los resultados del ensayo clínico RECOVERY (5) no mostraron beneficio en el uso de HCQ en pacientes con COVID-19 hospitalizados. En este estudio se incluyeron 4761 pacientes, de los cuales 1542 recibieron HCQ y 3132 el tratamiento habitual, no observándose diferencias significativas en la mortalidad a 28 días (25.7% vs 23.5%), ni en la duración de la estancia hospitalaria. En octubre de 2020, se publicó el ensayo clínico SOLIDARITY (6) con unos resultados similares.
LOPINAVIR/RITONAVIR
Basado en el uso de Lopinavir/Ritonavir (LPVr) en el SARS y MERS se propuso el uso de estos fármacos al inicio de la pandemia; sin embargo, al igual que con HCQ, se comprobó la ausencia de beneficio clínico (tabla 1).
En junio de 2020, ensayo clínico RECOVERY (7) concluyó que el tratamiento con LPV/r en pacientes con COVID-19 no era beneficioso, puesto que no reducía la mortalidad a 28 días ni tampoco mostraba una mayor y más rápida mejoría clínica en comparación con el control. Posteriormente, se publicó el ensayo clínico SOLIDARITY6 con unos resultados similares.
INTERFERON (ALFA, BETA)
Los interferones (IFN) se utilizan como tratamiento de múltiples infecciones virales y han mostrado una potente actividad in vitro e in vivo en el MERS. Por ello se propusieron como tratamiento de la COVID-19; sin embargo, han mostrado heterogeneidad en los resultados obtenidos (tabla 1), sin obtener una proyección en los protocolos actuales.
El ensayo clínico SOLIDARITY6 (diciembre de 2020) incluyó 4100 pacientes con COVID-19, de los cuales 2050 recibieron IFN beta-1a subcutáneo (3 dosis de 44 μg los días 0, 3 y 6) o intravenoso (10 μg/ día durante 6 días) y fueron comparados con un grupo control (n=2050), sin observarse diferencias significativas en la mortalidad a 28 días. De hecho, se vio una tendencia a una mayor mortalidad en el grupo con IFN (243 vs 216 muertes; RR 1.16, 95% IC: 0.96 -1.39; p=0.11).
REMDESIVIR
Remdesivir (RDV) es un análogo de nucleótidos que actúa como inhibidor de la ARN polimerasa viral. Ha demostrado efectividad in vitro y en animales en el SARS y en el MERS, tanto como agente profiláctico como terapéutico.
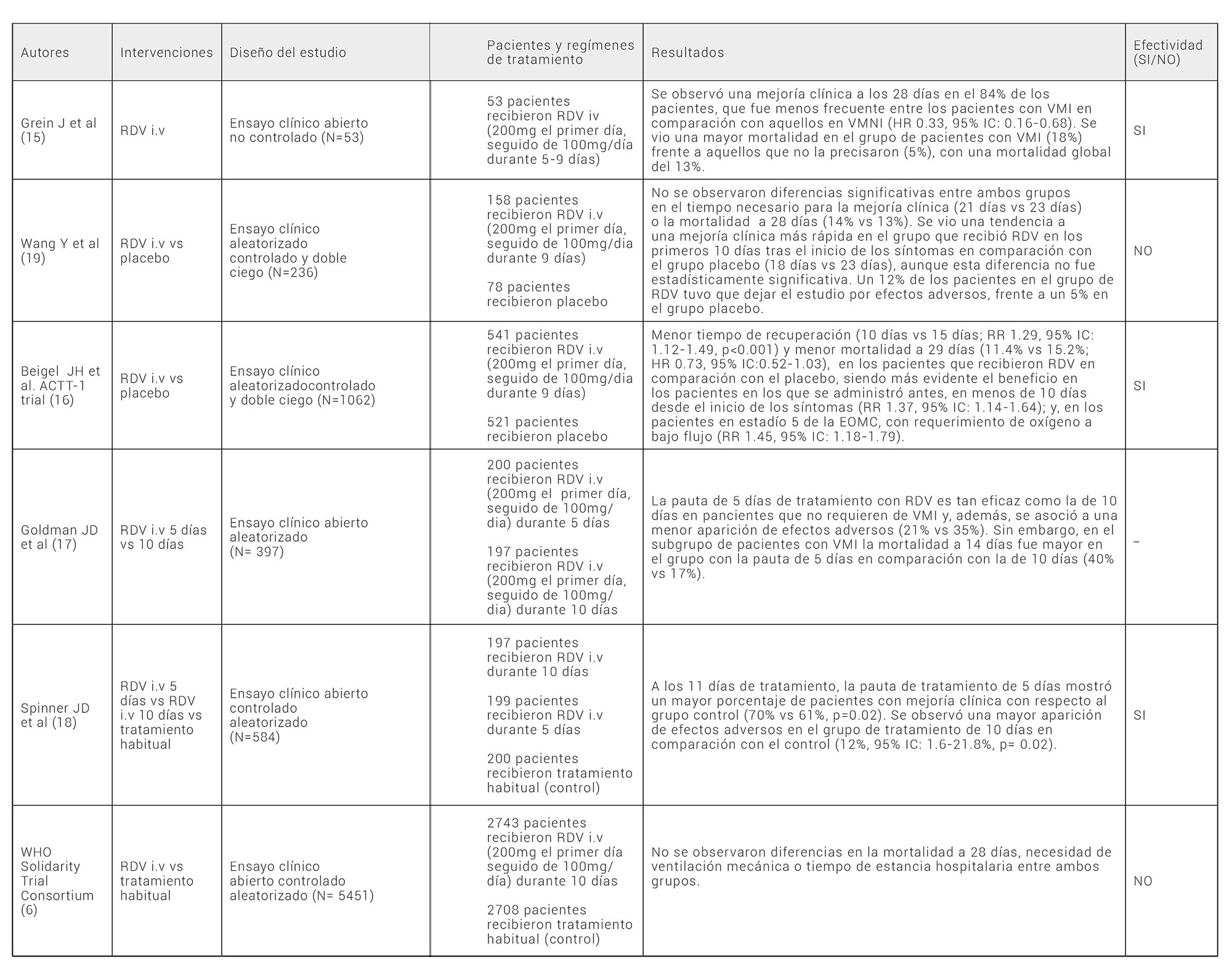
En abril’20, se publicó el primer ensayo clínico en el que se utilizó RDV (200 mg el primer día, seguido de 100 mg/día durante 5-9 días) como tratamiento en pacientes con COVID-19 (N=53). A los 28 días, se observó una mayor mejoría clínica (HR 0.33, 95% IC: 0.16-0.68) y una menor mortalidad (18% vs 5%) en los pacientes con ventilación mecánica invasiva (VMI) en comparación con aquellos en ventilación mecánica no invasiva (VMNI) (15) .
Tabla 2. Ensayos clínicos que estudiaron la eficacia de Remdesivir en pacientes con COVID-19. RDV, remdesivir; i.v, intravenoso; HR, hazard ratio; RR, rate ratio; VMI, ventilación mecánica invasiva; VMNI, ventilación mecánica no ivasiva; IC, intervalo de confianza; WHO, world health organization; EOMC, escala ordinal de mejoría clínica.
En el mismo mes, el NIH publicó los resultados preliminares del ensayo clínico ACTT-1 (16) , en el que se incluyeron 1062 pacientes hospitalizados con COVID-19, de los cuales: 541 recibieron RDV i.v (200 mg el primer día, seguido de 100 mg/dia durante 9 días) y 521 recibieron placebo. Se observó un menor tiempo de recuperación (10 vs 15 días; RR 1.29, 95% IC: 1.12-1.49, p<0.001) y una menor mortalidad a 29 días (11.4% vs 15.2%; HR 0.73, 95% IC:0.52-1.03) en el grupo de RDV. Además, se vio que la tasa de recuperación con RDV fue mayor en los pacientes en los que se administró antes (RR 1.37, 95% IC: 1.14-1.64); y, en aquellos en estadio 5 de la EOMC (RR 1.45, 95% IC: 1.18-1.79).
Hasta este momento los ensayos clínicos habían utilizado la pauta de 10 días de tratamiento. En mayo’20, se publicó un ensayo clínico en el que se incluyeron 397 pacientes con COVID-19 grave que recibieron RDV i.v (200 mg el primer día, seguido de 100 mg/día) durante 10 (n=197) o 5 días (n=200). La pauta de tratamiento de 5 días resultó tan eficaz como la de 10, con un porcentaje de pacientes con mejoría clínica a las dos semanas similar (64% vs 54%), y con una menor aparición de efectos adversos (21% vs 35%). Sin embargo, en el subgrupo de pacientes con VMI, la mortalidad a 14 días fue mayor con la pauta corta en comparación con la de 10 días (40% vs 17%) (17).
En agosto’20, se publicó otro ensayo clínico en el que también se compararon las dos pautas de tratamiento con RDV i.v (200 mg primer día seguido de 100mg/día) pero, a diferencia del anterior, se incluyó un grupo control y se realizó en pacientes con COVID-19 moderado. Se incluyeron 584 pacientes, de los cuales: 197 recibieron RDV durante 10 días y 199 durante 5 días. A los 11 días, la pauta corta mostró un mayor porcentaje de pacientes con mejoría clínica con respecto al control (70% vs 61%, p=0.02), aunque la trascendencia clínica de este hallazgo es incierta. No se encontraron diferencias en la mejoría clínica entre la pauta de 10 días y el control, pero sí una mayor aparición de efectos adversos (12%, 95% IC: 1.6-21.8, p= 0.02) (18).
El ensayo clínico SOLIDARITY (6), publicado en diciembre’20, incluyó a 5451 pacientes con COVID-19, de los cuales: 2743 recibieron RDV i.v (200 mg el primer día seguido de 1000 mg/día) durante 10 días y 2708 formaron el grupo control. Los resultados no mostraron diferencias en la supervivencia a 28 días, ni tampoco en la necesidad de VM o tiempo de ingreso hospitalario.
FASE HIPERINFLAMATORIA
CORTICOIDES
Durante las epidemias de SARS y MERS, se utilizaron como tratamiento del SDRA causado por estos virus asociándose a efectos beneficiosos, a pesar de aumentar la viremia y retrasar el aclaramiento viral.
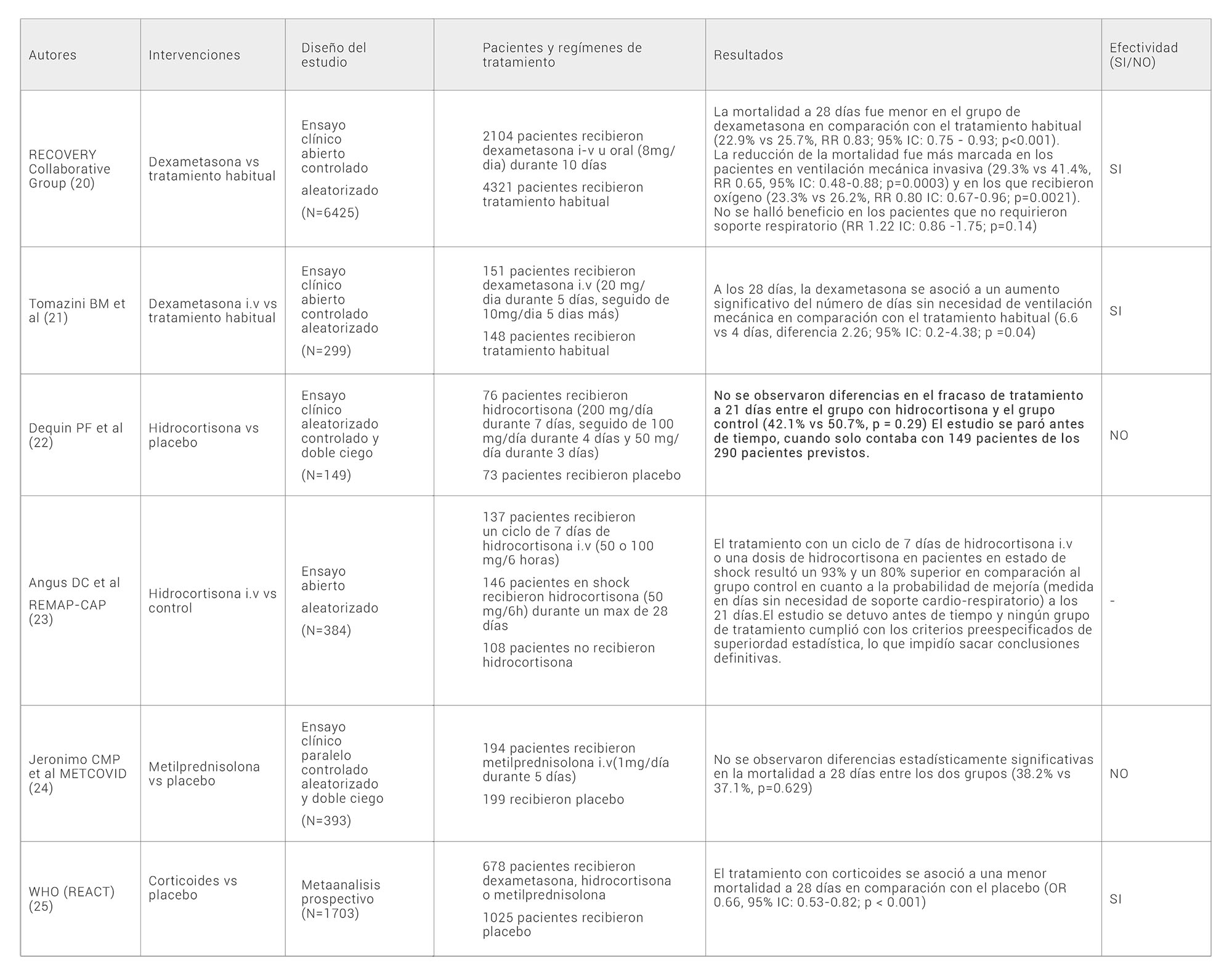
Tabla 3. Estudios con corticoides como tratamiento en pacientes con COVID-19. RR, rate ratio; IC, intervalo de confianza; OD, odds ratio; i.v, intravenoso.
En junio de 2020, se publicó el ensayo clínico RECOVERY (20) , que incluyó a 6425 pacientes con COVID-19, de los cuales: 2104 recibieron tratamiento con dexametasona (8 mg/dia) durante 10 días y 4321 recibieron únicamente el tratamiento habitual. La mortalidad a 28 días fue menor en el grupo de dexametasona en comparación con el control (22.9% vs 25.7%, RR 0.83; 95% IC: 0.75-0.93; p<0.001). Además, esta reducción de la mortalidad fue más marcada en los pacientes en VMI (29.3% vs 41.4%, RR 0.65, 95% IC: 0.48-0.88; p=0.0003) y necesidad de oxigenoterapia (23.3% vs 26.2%, RR 0.80 IC: 0.67-0.96; p=0.0021). Por el contrario, no se halló beneficio en los pacientes que no requirieron soporte respiratorio (RR 1.22 IC: 0.86 -1.75; p=0.14).
En septiembre de 2020, se publicó un ensayo clínico en el que 299 pacientes con COVID-19 ingresados en UCI fueron aleatorizados a recibir tratamiento con dexametasona i.v (20 mg/día durante 5 días, seguido de 10mg/día 5 días más) (n=151) o el tratamiento habitual (n=148). A los 28 días, el uso de dexametasona se asoció a un aumento significativo del número de días sin necesidad de VM en comparación con el control (6.6 vs 4 días, diferencia 2.26; 95% IC: 0.2-4.38; p=0.04) (21) .
TOCILIZUMAB
Tocilizumab (TCZ) es un anticuerpo monoclonal que bloquea el receptor de la IL-6 y se utiliza como tratamiento en enfermedades reumatológicas y en el síndrome de liberación de citoquinas causado por la terapia con CAR-T en pacientes oncológicos. La IL-6 juega un papel muy importante dentro del síndrome hiperinflamatorio que se produce en la COVID-19, lo que sugiere que el tratamiento con fármacos anti-IL-6 podría ser beneficioso en la fase hiperinflamatoria de la enfermedad.
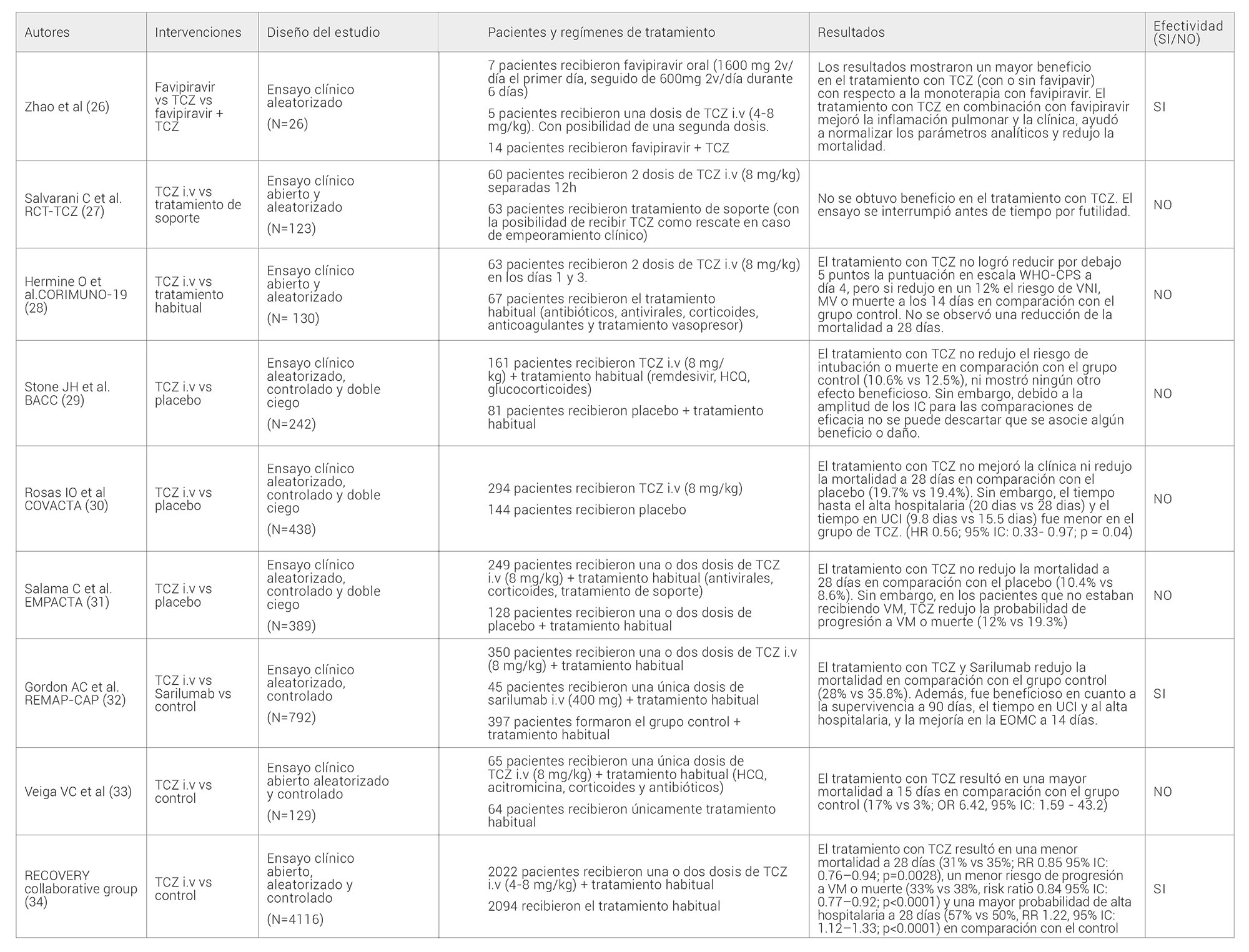
En septiembre’20, se publicó el primer ensayo clínico con TCZ, en el que participaron 26 pacientes con COVID-19. Se dividieron en tres grupos en función del tratamiento administrado: favipiravir oral (1600 mg 2v/día el primer día, seguido de 600mg 2v/día durante 6 días), TCZ i.v (dosis única de 4-8 mg/kg) o ambos fármacos. Los resultados mostraron un mayor beneficio en el tratamiento con TCZ (con o sin favipavir) con respecto a la monoterapia con favipiravir. Se observó una mayor remisión de las lesiones pulmonares en las pruebas de imagen (HR 2.66 95 % IC: 1.08–6.53, p= 0.019) y una menor incidencia de mortalidad o necesidad de VM (0% vs 28.5%) (26).
En octubre’20, se dieron a conocer los resultados de cinco grandes ensayos clínicos (27,28,29,30,31), en los que la administración de TCZ i.v (8 mg/kg) en pacientes con COVID-19 grave/crítico no resultó beneficiosa. No obstante, en el ensayo EMPACTA31, TCZ redujo en un 7% el porcentaje acumulativo de pacientes con necesidad de VM o que habían fallecido a los 28 días (aunque no redujo la mortalidad global por cualquier causa a 28 días); y, en el ensayo CORIMUNO 28, el grupo con TCZ mostró una menor incidencia de necesidad de VMNI, VM o muerte a 14 días.
Tabla 4. Estudios con Tocilizumab como tratamiento en pacientes con COVID-19. TCZ, tocilizumab; MP, metilprednisolona; i.v, intravenoso; PCR, proteína C reactiva; IL-6, interleuquina 6; LPV/r, lopinavir/ritonavir; VM, ventilación mecánica; HCQ, hidroxicloroquina; IFN, interferon; NNT, número necesario a tratar; UCI, unidad de cuidados intensivos; VNI, ventilación no invasiva; HR, hazard ratio; IC, intervalo de confianza; OR, odds ratio.
En enero de 2021, se publicaron dos ensayos clínicos cuyos resultados fueron contradictorios. Por un lado, el REMAP-CAP (32), en el que participaron 792 pacientes con COVID-19 ingresados en UCI, de los cuales: 350 recibieron una o dos dosis de TCZ i.v (8mg/kg), 45 recibieron Sarilumab i.v (400mg) y 397 formaron el grupo control. Los resultados mostraron una menor mortalidad en los grupos tratados con TCZ y Sarilumab en comparación con el control. Por otro lado, un ensayo clínico (33), en el que participaron 129 pacientes con COVID-19 grave/crítico, no mostró beneficio en el uso de TCZ (8mg/kg) con respecto al tratamiento habitual. De hecho, la mortalidad a 15 días fue mayor en el grupo de intervención, lo que llevó a la interrupción del estudio antes de tiempo.
En mayo de 2021, se publicaron los resultados definitivos del ensayo clínico RECOVERY (34) , en el que participaron 4116 pacientes con COVID hospitalizados y datos de inflamación sistémica (PCR>75mg/L), de los cuales: 2022 recibieron una o dos dosis de TCZ i.v (4-8mg/kg) y 2094 el tratamiento habitual. El tratamiento con TCZ se asoció a una menor mortalidad a 28 días (31% vs 35%; RR 0.85 95% IC: 0.76–0.94; p=0.0028), una mayor probabilidad de alta hospitalaria a 28 días (57% vs 50%, RR 1.22, 95% IC: 1.12–1.33; p<0.0001) y un menor riesgo de progresión a VM o muerte en aquellos que no tenían VM al inicio (33% vs 38%, risk ratio 0.84 95% IC: 0.77–0.92; p<0.0001).
ANAKINRA
Anakinra es un antagonista del receptor de la IL-1 que ha demostrado su eficacia frente al síndrome de activación macrofágica y otros desórdenes inflamatorios. La IL-1, al igual que la IL-6, está implicada en la “tormenta de citoquinas” responsable del SDRA observado en pacientes con COVID-19.
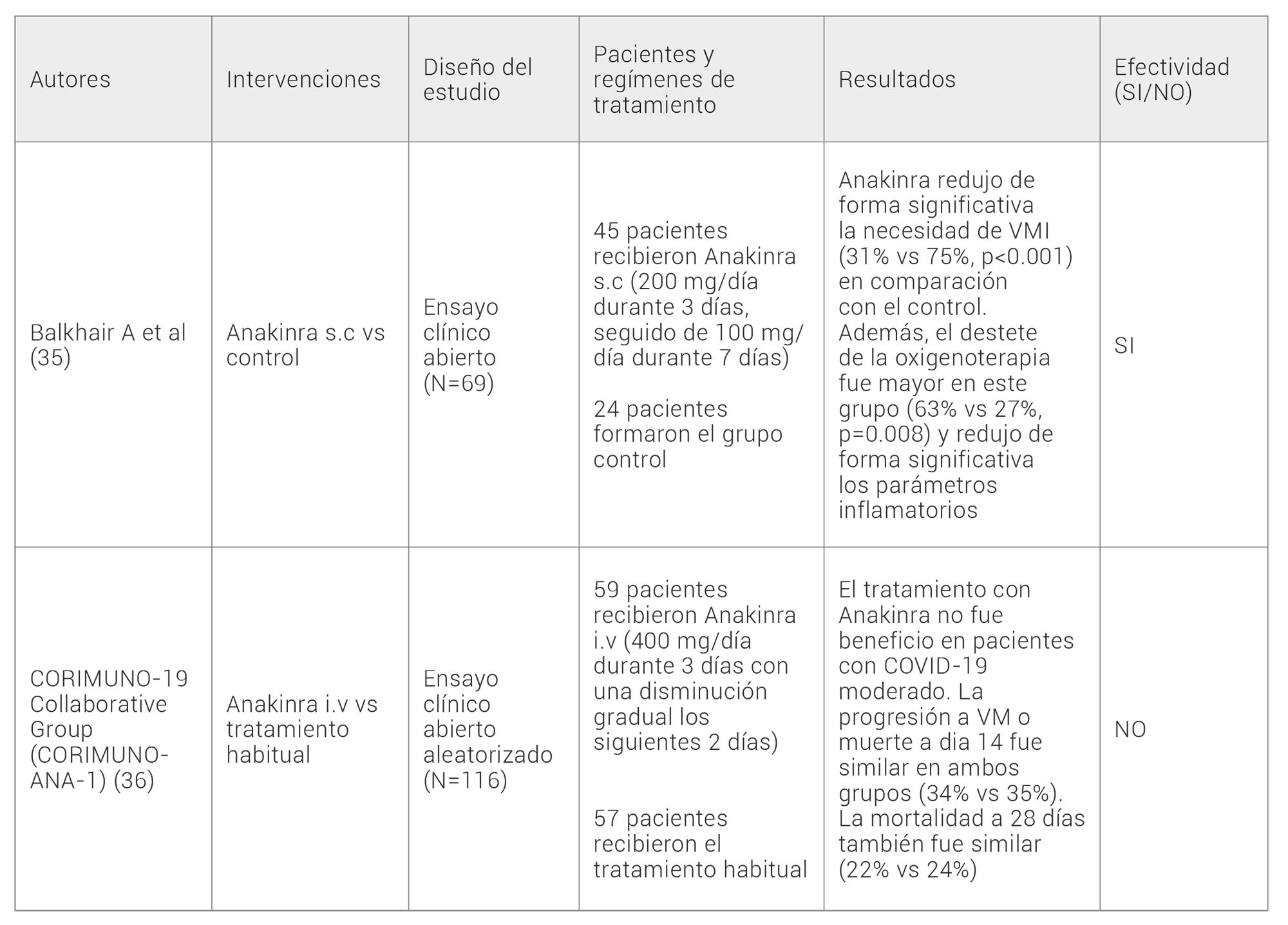
En noviembre de 2020, Balkhair A. et al publicaron un ensayo clínico en el que se incluyeron 69 pacientes con COVID-19, de los cuales 45 recibieron Anakinra s.c. Se observó una reduccción significativa de la necesidad de VMI (31% vs 75%, p<0.001) y de los parámetros inflamatorios, así como un mayor destete de la oxigenoterapia (63% vs 27%, p=0.008) en comparación con el control (35).
Dos meses más tarde se publicó el ensayo clínico francés CORIMUNO-ANA-1 (36), en el que participaron 116 pacientes con COVID-19 moderado, de los cuales: 59 recibieron Anakinra i.v (400mg/día durante 3 días con una disminución gradual) y 57 tratamiento de soporte. Los resultados no mostraron diferencias en la mortalidad o necesidad de VM a 14 días (34% vs 35%).
Tabla 5. Estudios con Anakinra como tratamiento en pacientes con COVID-19. S.c, subcutáneo; i.v, intravenoso; VM, ventilación mecánica; VMI, ventilación mecánica invasiva.
VITAMINA D
La vitamina D3 o colecalciferol tiene numerosas funciones fisiológicas, que ejerce a través de su metabolito activo la 1,25(OH)2D. La hipótesis sobre una posible relación entre el déficit de vitamina D y la COVID-19 ha sido apoyada por diversos artículos publicados a lo largo de la pandemia.
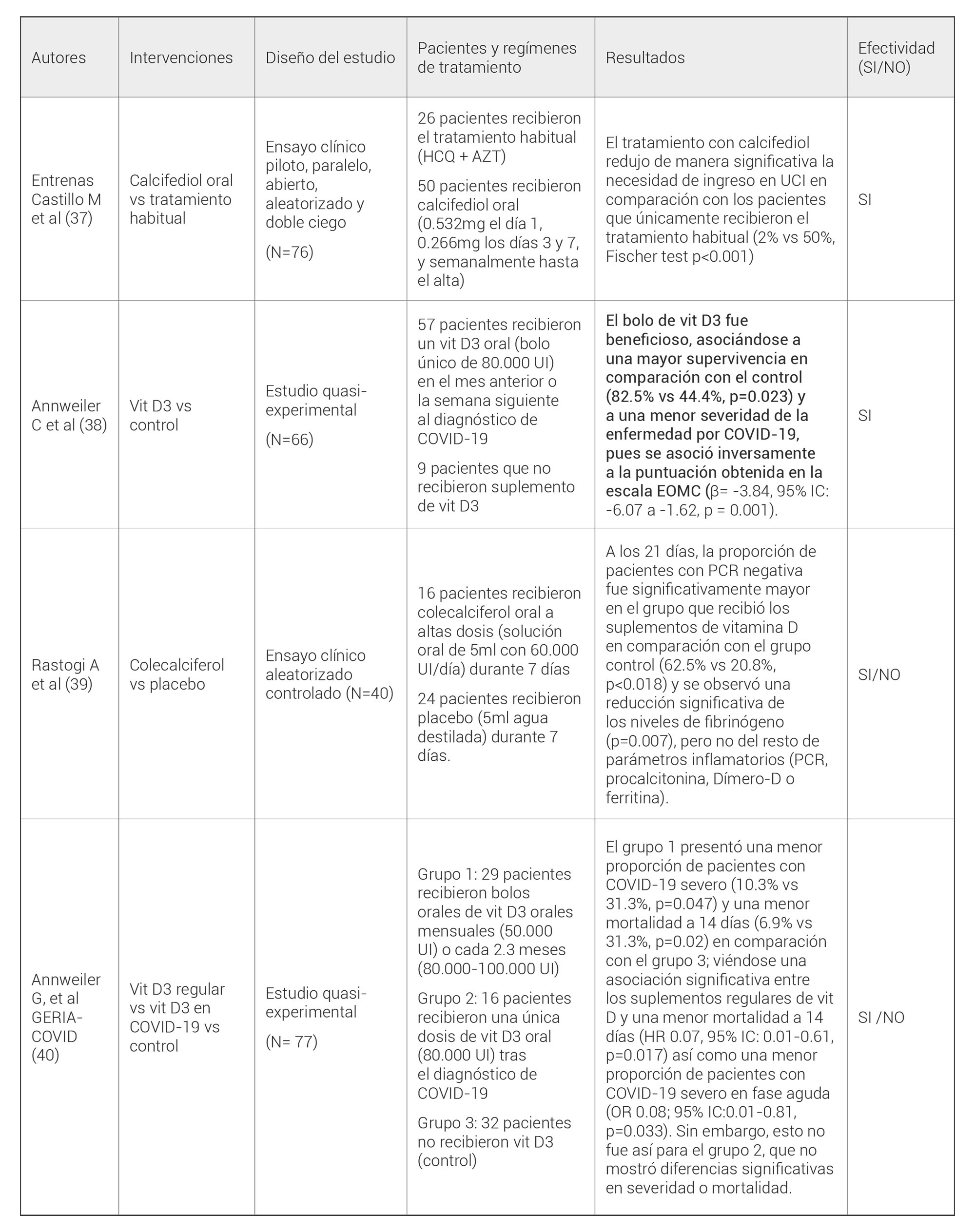
En agosto de 2020, se publicó un ensayo clínico que incluyeron 76 pacientes con COVID-19 hospitalizados, de los cuales 50 recibieron un suplemento de 25-hidroxivitamina D o calcifediol oral (0.532mg el día 1, 0.26 mg los días 3, 7, y semanalmente hasta el alta). Se observó una reducción significativa de la necesidad de ingreso en UCI en comparación con el control (2% vs 50%, p<0.001) (37).
En octubre’20, Annweiler C et al publicaron un estudio quasi-experimental en el que se incluyeron 66 ancianos con COVID-19, de los cuales 57 habían recibido una dosis oral de vitamina D (80.000UI) próxima al diagnóstico. La supervivencia fue significativamente mayor en el grupo que recibió la vitamina (82.5% vs 44.4%, p=0.023), mostrando un efecto protector de esta frente a la mortalidad (HR 0.11; 95% IC:0.03-0.48, p=0.003). Además, su uso se relacionó con una menor gravedad de la enfermedad según la puntuación obtenida en la EOMC β=-3.84, 95% IC: -6.07 -1.62; p= 0.001) (38).
En el mismo mes se publicó el estudio SHADE (39), un pequeño ensayo clínico aleatorizado en el que se incluyeron 40 pacientes con COVID-19 y niveles bajos de vitamina D, de los cuales: 16 recibieron suplementos orales de colecalciferol a altas dosis (60000 UI/día) y 24 recibieron placebo durante 7 días.
A los 21 días, la proporción de pacientes con PCR negativa fue significativamente mayor en el grupo que recibió la suplementación con vitamina D (62.5% vs 20.8%, p<0.018).
Tabla 6. Estudios sobre la eficacia del tratamiento con vitamina D (o derivados) en pacientes con COVID-19.AZT, azitromicina; HCQ, hidroxicloroquina; UCI, unidad de cuidados intensivos; vit D3, vitamina D3; PCR, proteína C reactiva; IL-6, interleuquina 6; vit B12, vitamina B12; PCR, reacción en cadena de la polimerasa; Mg, magnesio; EOMC, escala ordinal de mejoría clínica ; OR, odds ratio; HR, hazard ratio; IC, intervalo de confianza; ORadj, odds ratio ajustado; UI, unidades internacionales.
En noviembre’20 se publicó el estudio GERIA-COVID (40), en el que se incluyeron 77 ancianos hospitalizados con COVID-19, de los cuales: 29 estaban en tratamiento regular con bolos orales de vitamina D3 (50.000-100.000 UI) y 16 habían recibido una dosis oral de vitamina D3 (80.000 UI) próxima al diagnóstico. Se vio una asociación significativa entre los suplementos regulares y una menor mortalidad a 14 días (HR 0.07, 95% IC: 0.01-0.61, p=0.017), así como una menor gravedad de la enfermedad (OR 0.08, 95% IC:0.01-0.81, p=0.033) en comparación con el control (n=32). Sin embargo, esto no fue así para aquellos que habían recibido una dosis única de vitamina D3 tras el diagnóstico.
BARICITINIB
Baricitinib (BCT) es un inhibidor de las quinasas Janus 1 y 2 (JAK1 y JAK2), que tiene una alta afinidad por la protein quinasa 1 asociada a AP2 (AAK1) y la quinasa asociada a ciclina G (GAK), enzimas reguladoras de la endocitosis mediada por el receptor ACE-2, utilizado por el SARS-CoV-2 para entrar a las células pulmonares AT2. En diciembre’20, un estudio genético observó una hiperexpresión del gen de la tirosín quinasa 2 (TYK2), gen diana del grupo de los inhibidores de JAK, en pacientes con COVID-19 grave (41).
En noviembre de 2020 se anunciaron los resultados del ensayo clínico ACTT-2 (42) , en el que 1033 pacientes hospitalizados con COVID-19 fueron aleatorizados a recibir tratamiento con RDV en combinación con BCT (n=515) o placebo (n=518). Se observó un menor tiempo de recuperación (7 vs 8 días; RR 1.16, 95% IC: 1.01-1.32, p=0.03) y una mayor probabilidad de mejoría clínica a 15 días (OR 1.3, 95% IC: 1-1.6) en el grupo con BCT (4mg/día durante 14 días) y RDV i.v (200mg el primer día, 100mg/día durante 9 días) en comparación a la monoterapia con RDV. Además, en los pacientes en estadio 6 de la EOMC, con VMNI o requerimiento de oxígeno a alto flujo, esta diferencia fue más evidente (10 vs 18 días; RR 1.51, 95% IC: 1.10-2.08) (OR 2.2, 95% IC: 1.4-3.6).
COLCHICINA
La colchicina es un fármaco antimitótico que interfiere en el proceso inflamatorio sin asociarse a efectos inmunosupresores.
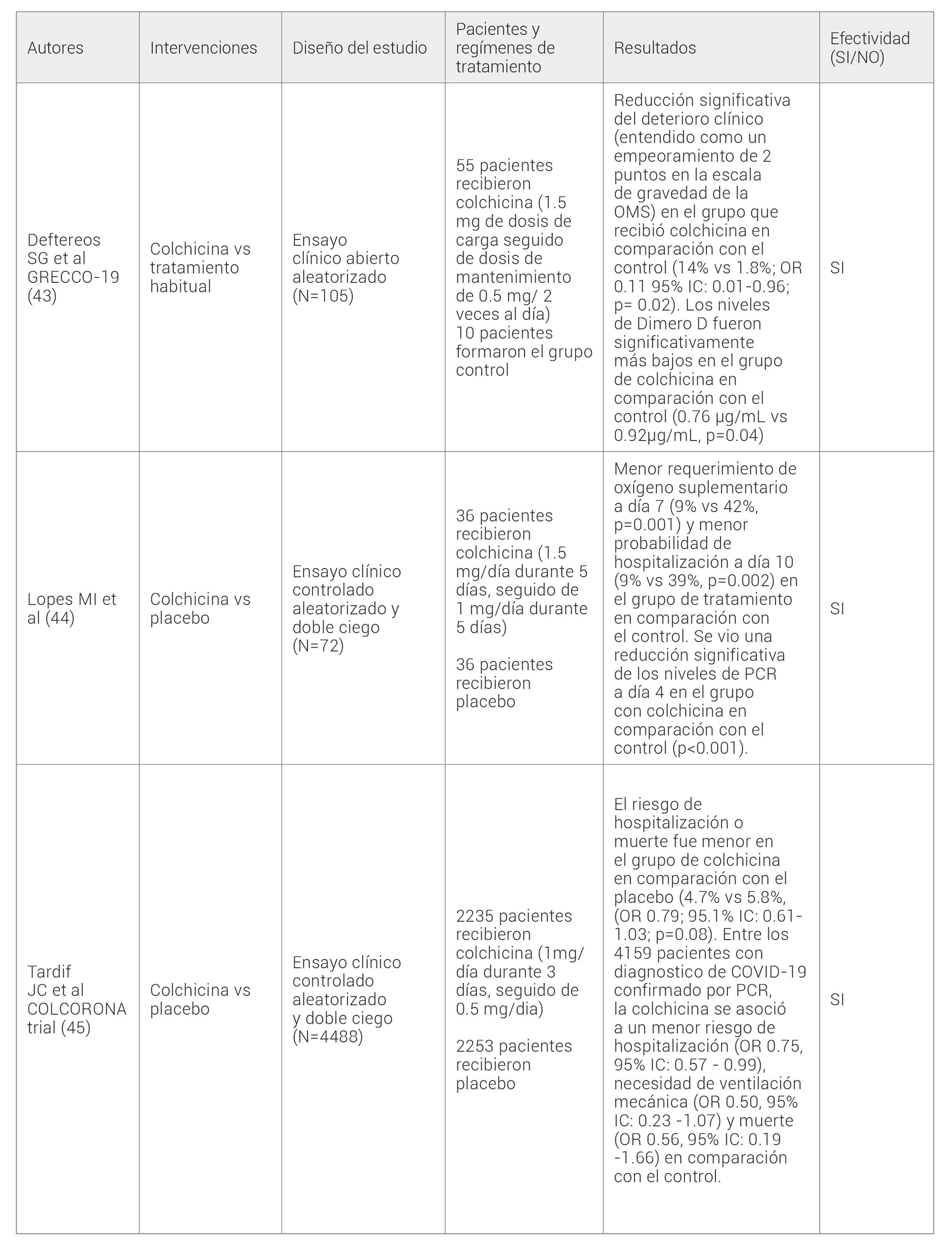
En junio de 2020 se publicó el ensayo clínico GRECCO-19 (43) en el que se incluyeron a 105 pacientes con COVID-19 hospitalizados, de los cuales: 55 recibieron colchicina (1.5-mg de dosis de carga, seguido de 1mg/día) y 50 formaron el grupo control. Se observó una reducción significativa del deterioro clínico, entendido como un empeoramiento de 2 puntos en la EOMC (14% vs 1.8%; OR 0.11 95% IC: 0.01-0.96; p= .02), así como unos niveles de Dimero D significativamente más bajos (0.76 μg/mL vs 0.92μg/mL, p=0.04) en el grupo con colchicina en comparación con el control.
En enero de 2021, Lopes MI et al publicaron un ensayo incluyendo 72 pacientes con COVID-19, de los cuales 36 recibieron colchicina (1.5mg/día durante 5 días, seguido de 1mg/día durante 5 días) y 36 placebo. Se observó un menor requerimiento de oxígeno suplementario a día 7 (9% vs 42%, p=0.001), una menor probabilidad de hospitalización a día 10 (9% vs 39%, p=0.002) y una reducción significativa de los niveles de PCR a día 4 (p<0.001) en el grupo que recibió colchicina en comparación con el control (44) .
En diciembre de 2020 se publicaron los resultados provisionales del ensayo clínico COLCORONA (45) en el que participaron 4488 pacientes con COVID-19 no hospitalizados, de los cuales: 2235 recibieron colchicina (1mg/día durante 3 días, seguido de 0.5mg/dia) y 2253 placebo. Se observó una reducción del 21% del riesgo de hospitalización o muerte en el grupo de colchicina con respecto al control. Además, en los 4159 pacientes con PCR para SARS-COV-2 positiva, la colchicina redujo un 25% el riesgo de hospitalización, un 50% la necesidad de VM y un 44% la mortalidad en comparación con el control.
Recientemente se han publicado varios metaanálisis en los que el uso de colchicina en pacientes con COVID-19 se ha asociado a una menor mortalidad de manera estadísiticamente significativa (46,47,48).
ANTICOAGULACIÓN
En varias revisiones sistemáticas y metaanálisis han observado un mayor riesgo de complicaciones tromboémbolicas en los pacientes con COVID-19, con una mayor incidencia en aquellos que están ingresados en UCI, tienen niveles de Dímero D más elevados o no reciben tratamiento anticoagulante.
En diciembre de 2020 se publicó un ensayo clínico en fase II en el que se incluyeron 20 pacientes con COVID-19 hospitalizados en VM, de los cuales: 10 recibieron dosis terapéuticas de enoxaparina (dosis máxima 280mg/dia) y 10 recibieron heparina no fraccionada subcutánea a dosis profilácticas (5000 UI/ 3 veces al día si <120kg o 7500 UI/ 3 veces al día si >120kg). Se observó una reducción de la necesidad de VM en el grupo de pacientes con AC a dosis terapéuticas (49).
En marzo de 2021 se publicó el ensayo INSPIRATION (50), en el que 562 pacientes con COVID-19 ingresados en UCI fueron aleatorizados a recibir dosis estándar (40mg/24h) o intermedias (1mg/kg/24h) de enoxaparina con un end-point común (trombosis, uso de oxigenación extracorpórea y mortalidad a 30 días), no encontrándose mejores resultados en el uso de AC a dosis intermedias.
Tabla 7. Estudios con colchicina como tratamiento en pacientes con COVID-19. OMS, organización mundial de la salud; OR, odds ratio; IC, intervalo de confianza; PCR, proteína C reactiva.
Actualmente hay tres ensayos clínicos internacionales en marcha (REMAP-CAP, ACTIV-4 y ATTACC) en los que se ha parado el reclutamiento de pacientes ingresados en UCI por futilidad (51).
DISCUSIÓN
La búsqueda de un tratamiento para la COVID-19 se ha basado en la identificación de fármacos, en investigación o ya aprobadas para otras enfermedades, que pudieran ser eficaces contra este nuevo virus. En comparación con la búsqueda de nuevos fármacos esta técnica de investigación supone una reducción drástica del tiempo; sin embargo, se necesitan ensayos clínicos que demuestren que el medicamento en cuestión es efectivo y seguro para una nueva indicación.
Desde el inicio de la pandemia, la mayor parte de estudios realizados cuentan con grandes limitaciones en cuanto a validez (tamaño de muestra insuficiente, presencia de factores de confusión, ausencia de grupo de comparación, etc). Posiblemente por esta razón, se han obtenido resultados contradictorios que han impedido, durante muchos meses, sacar conclusiones claras y fiables que respaldaran el uso de estos medicamentos en la práctica clínica. Sin embargo, debido a la situación de crisis y la necesidad de combatir urgentemente la pandemia, unos resultados favorables en los primeros estudios han bastado para recomendar la administración de estos agentes en pacientes con COVID-19.
Un claro ejemplo fue la utilización de CQ e HCQ. Los buenos resultados de los primeros ensayos clínicos realizados en China llevaron a la aprobación de estos fármacos como tratamiento de la COVID-19 en este país (52) y a su recomendación por parte de medios de comunicación de todo el mundo. En marzo’20, la FDA lanzó una autorización de emergencia para el uso CQ e HCQ (53). Sin embargo, durante los meses de abril y mayo de 2020 se puso en duda la eficacia y seguridad de estos medicamentos y, finalmente, tras la publicación de los resultados del ensayo clínico RECOVERY5, la FDA revocó la autorización de emergencia que había emitido (54). Algo parecido ocurrió con LPV/r e IFN.
De modo que, el único fármaco con actividad antiviral que mostró algún beneficio fue RDV, especialmente en pacientes con COVID-19 moderado-grave que se encuentran en los primeros días de síntomas y/o en estadio 4 (sin necesidad de oxígeno) o 5 (necesidad de oxígeno a bajo flujo) de la EOMC. En mayo de 2020, la FDA lanzó una autorización de emergencia para su uso (55) y, posteriormente, se convirtió en el primer medicamento en recibir la recomendación de la Agencia Europea del Medicamento frente a la COVID-19 (56). Más tarde, la OMS lo desaconsejó como tratamiento tras la publicación del ensayo clínico SOLIDARITY 6. Sin embargo, los malos resultados de este estudio podrían explicarse por la agrupación de los estadios 5 y 6 de la EOMC en el análisis que pudo hacer que se perdiera el beneficio observado en los estudios anteriores.
Por el contrario, los corticoides fueron desaconsejados al inicio de la pandemia (57,58) y, a raíz de la publicación del ensayo clínico RECOVERY 20, pasaron a ser ampliamente utilizados en pacientes con COVID-19 con necesidad de oxigenoterapia o VM (59,60), convirtiéndose en los primeros medicamentos capaces de reducir la mortalidad por COVID-19. No obstante, tanto la dosis como el momento apropiado para su administración sigue siendo un tema en discusión.
En el caso de TCZ, a pesar de que los primeros estudios observacionales habían advertido un beneficio en su uso, no fue este el resultado obtenido en los cinco ensayos clínicos publicados a posteriori. Esto podría deberse a que tan solo el BACC29 tuvo en cuenta los datos analíticos de inflamación en los criterios de inclusión, ya que estas terapias tienen sentido en pacientes que se encuentren o estén iniciando el “estado hiperinflamatorio” (61,62). De hecho, los autores del ensayo clínico RECOVERY34 concluyen que, en pacientes con datos de inflamación sistémica, el tratamiento con TCZ y corticoides podría reducir la mortalidad en aproxidamente un tercio para los pacientes con oxigenoterapia y casi la mitad para aquellos con VM. Además, explican que, al considerar conjuntamente todos los ensayos, TCZ se asocia a una reducción significativa del 14% en la mortalidad a 28 días.
En lo que respecta a Anakinra, los estudios publicados difieren en cuanto a dosis y la vía de administración utilizadas y, aunque su uso parece ser beneficioso, la administración por vía i.v se ha relacionado con efectos adversos importantes o una mayor mortalidad (63).
Con respecto a la vitamina D existe mucha controversia y su indicación terapéutica en la COVID-19 no está del todo clara. Sin embargo, estudios como el GERIA-COVID40, han observado una menor gravedad y mortalidad por COVID-19 en los pacientes que habían recibido suplementación regular con vitamina D3 los meses previos a la infección. Parece, pues, razonable su administración como prevención en la población con déficit de estas.
Por su parte, BCT y colchicina han mostrado un potencial beneficio en los primeros estudios realizados. De hecho, tras los buenos resultados del estudio COLCORONA45, la colchicina podría convertirse en el primer fármaco oral que se utilice como tratamiento de pacientes con COVID-19 no hospitalizados.
Por último, en cuanto a la anticoagulación, los estudios publicados en los que se comparan las distintas pautas son muy limitados y hasta ahora no hay evidencia científica que justifique el uso de dosis terapéuticas o intermedias, por lo que la mayoría de las guías de tratamiento actuales recomiendan únicamente la administración de dosis profilácticas (64,65). No obstante, hay quienes apuestan por la utilización de dosis intermedias en pacientes con alto riesgo de trombosis, como es el caso del protocolo publicado por la Sociedad Española de Trombosis y Hemostasia (SETH) (66) o, las guías NICE (67).
De cara al futuro, debemos ser conscientes de que, a corto plazo, van a seguir existiendo pacientes ingresados con COVID-19; y, solo con el desarrollo de antivirales orales de alta eficacia que permitan el tratamiento domiciliario de estos pacientes, podremos volver a la realidad hospitalaria que conocíamos antes de febrero de 2020.
Tras un año de pandemia e investigación todavía son muchos los fármacos sobre los que no se tiene una clara evidencia de su eficacia y, aunque algunos de ellos puedan parecer muy prometedores, debemos ser cautos y esperar a tener unos resultados válidos y fiables antes de recomendar su uso fuera de un ensayo clínico, pues si algo hemos aprendido con esta pandemia es que “las crisis no son excusas para rebajar los estándares científicos” (68).
referencias bibliográficas
- ↑Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical-therapeutic staging proposal. J Heart Lung Transplant. 2020 May;39(5):405-407.
- ↑Chen J, Liu D, Liu L, Liu P, Xu Q, Xia L, et al. [A pilot study of hydroxychloroquine in treatment of patients with moderate COVID-19]. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2020 May 25;49(2):215-219. Chinese.
- ↑Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020 May 14;369:m1849.
- ↑Borba MGS, Val FFA, Sampaio VS, Alexandre MAA, Melo GC, Brito M, et al; CloroCovid-19 Team. Effect of High vs Low Doses of Chloroquine Diphosphate as Adjunctive Therapy for Patients Hospitalized With Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection: A Randomized Clinical Trial. JAMA Netw Open. 2020 Apr 24;3(4):e208857.
- ↑RECOVERY Collaborative Group. Effect of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Nov 19;383(21):2030-2040.
- ↑WHO Solidarity Trial Consortium, Pan H, Peto R, Henao-Restrepo AM, Preziosi MP, Sathiyamoorthy V, Abdool Karim Q, et al. Repurposed Antiviral Drugs for Covid-19 – Interim WHO Solidarity Trial Results. N Engl J Med. 2021 Feb 11;384(6):497-511.
- ↑RECOVERY Collaborative Group. Lopinavir-ritonavir in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2020 Oct 5;396(10259):1345–52.
- Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020 Jul;56(1):105949.
- Chen Z, Hu J, Zhang Z, Jiang S, Han S, Yan D, et al. Efficacy of hydroxycloroquine in patients with COVID-19: results of a randomized clinical trial. medRxiv 2020.03.22.20040758.
- Mitjà O, Corbacho-Monné M, Ubals M, Tebe C, Peñafiel J, Tobias A, et al; BCN PEP-CoV-2 RESEARCH GROUP. Hydroxychloroquine for Early Treatment of Adults with Mild Covid-19: A Randomized-Controlled Trial. Clin Infect Dis. 2020 Jul 16:ciaa1009.
- Skipper CP, Pastick KA, Engen NW, Bangdiwala AS, Abassi M, Lofgren SM, et al. Hydroxychloroquine in Nonhospitalized Adults With Early COVID-19 : A Randomized Trial. Ann Intern Med. 2020 Oct 20;173(8):623-631. Erratum in: Ann Intern Med. 2021 Mar;174(3):435.
- Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19. N Engl J Med. 2020 May 7;382(19):1787-1799.
- Hung IF, Lung KC, Tso EY, Liu R, Chung TW, Chu MY, et al. Triple combination of interferon beta-1b, lopinavir-ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial. Lancet. 2020 May 30;395(10238):1695-1704.
- Monk PD, Marsden RJ, Tear VJ, Brookes J, Batten TN, Mankowski M, et al; Inhaled Interferon Beta COVID-19 Study Group. Safety and efficacy of inhaled nebulised interferon beta-1a (SNG001) for treatment of SARS-CoV-2 infection: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Respir Med. 2021 Feb;9(2):196-206.
- ↑Grein J, Ohmagari N, Shin D, Diaz G, Asperges E, Castagna A, et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020 Jun 11;382(24):2327-2336.
- ↑Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, et al; ACTT-1 Study Group Members. Remdesivir for the Treatment of Covid-19 – Final Report. N Engl J Med. 2020 Nov 5;383(19):1813-1826.
- ↑Goldman JD, Lye DCB, Hui DS, Marks KM, Bruno R, Montejano R, et al; GS-US-540-5773 Investigators. Remdesivir for 5 or 10 Days in Patients with Severe Covid-19. N Engl J Med. 2020 Nov 5;383(19):1827-1837.
- ↑Spinner CD, Gottlieb RL, Criner GJ, Arribas López JR, Cattelan AM, Soriano Viladomiu A, et al; GS-US-540-5774 Investigators. Effect of Remdesivir vs Standard Care on Clinical Status at 11 Days in Patients With Moderate COVID-19: A Randomized Clinical Trial. JAMA. 2020 Sep 15;324(11):1048-1057.
- Wang Y, Zhang D, Du G, Du R, Zhao J, Jin Y, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet. 2020 May 16;395(10236):1569-1578. Erratum in: Lancet. 2020 May 30;395(10238):1694.
- ↑RECOVERY Collaborative Group. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb 25;384(8):693-704.
- ↑Tomazini BM, Maia IS, Cavalcanti AB, Berwanger O, Rosa RG, Veiga VC, et al; COALITION COVID-19 Brazil III Investigators. Effect of Dexamethasone on Days Alive and Ventilator-Free in Patients With Moderate or Severe Acute Respiratory Distress Syndrome and COVID-19: The CoDEX Randomized Clinical Trial. JAMA. 2020 Oct 6;324(13):1307-1316.
- Dequin PF, Heming N, Meziani F, Plantefève G, Voiriot G, Badié J, et al; CAPE COVID Trial Group and the CRICS-TriGGERSep Network. Effect of Hydrocortisone on 21-Day Mortality or Respiratory Support Among Critically Ill Patients With COVID-19: A Randomized Clinical Trial. JAMA. 2020 Oct 6;324(13):1298-1306.
- Angus DC, Derde L, Al-Beidh F, Annane D, Arabi Y, Beane A, et al. Effect of Hydrocortisone on Mortality and Organ Support in Patients With Severe COVID-19: The REMAP-CAP COVID-19 Corticosteroid Domain Randomized Clinical Trial. JAMA. 2020 Oct 6;324(13):1317-1329.
- Jeronimo CMP, Farias MEL, Val FFA, Sampaio VS, Alexandre MAA, Melo GC, et al; for the Metcovid Team. Methylprednisolone as Adjunctive Therapy for Patients Hospitalized With COVID-19 (Metcovid): A Randomised, Double-Blind, Phase IIb, Placebo-Controlled Trial. Clin Infect Dis. 2020 Aug 12:ciaa1177.
- WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J, Angus DC, et al. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020 Oct 6;324(13):1330-1341.
- ↑Zhao H, Zhu Q, Zhang C, Li J, Wei M, Qin Y, et al. Tocilizumab combined with favipiravir in the treatment of COVID-19: A multicenter trial in a small sample size. Biomed Pharmacother. 2021 Jan;133:110825.
- ↑Salvarani C, Dolci G, Massari M, Merlo DF, Cavuto S, Savoldi L, et al; RCT-TCZ-COVID-19 Study Group. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021 Jan 1;181(1):24-31.
- ↑Hermine O, Mariette X, Tharaux PL, Resche-Rigon M, Porcher R, Ravaud P; CORIMUNO-19 Collaborative Group. Effect of Tocilizumab vs Usual Care in Adults Hospitalized With COVID-19 and Moderate or Severe Pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021 Jan 1;181(1):32-40. Erratum in: JAMA Intern Med. 2021 Jan 1;181(1):144.
- ↑Stone JH, Frigault MJ, Serling-Boyd NJ, Fernandes AD, Harvey L, Foulkes AS, et al; BACC Bay Tocilizumab Trial Investigators. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med. 2020 Dec 10;383(24):2333-2344.
- ↑Rosas IO, Bräu N, Waters M, Go RC, Hunter BD, Bhagani S, et al. Tocilizumab in Hospitalized Patients with Severe Covid-19 Pneumonia. N Engl J Med. 2021 Feb 25:NEJMoa2028700.
- ↑Salama C, Han J, Yau L, Reiss WG, Kramer B, Neidhart JD, et al. Tocilizumab in Patients Hospitalized with Covid-19 Pneumonia. N Engl J Med. 2021 Jan 7;384(1):20-30.
- ↑Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 Receptor Antagonists in Critically Ill Patients with Covid-19 Preliminary report. medRxiv 2021. 01.07.21249390.
- ↑Veiga VC, Prats JAGG, Farias DLC, Rosa RG, Dourado LK, Zampieri FG, et al; Coalition covid-19 Brazil VI Investigators. Effect of tocilizumab on clinical outcomes at 15 days in patients with severe or critical coronavirus disease 2019: randomised controlled trial. BMJ. 2021 Jan 20;372:n84.
- ↑RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2021 May 1;397(10285):1637-1645.
- ↑Balkhair A, Al-Zakwani I, Al Busaidi M, Al-Khirbash A, Al Mubaihsi S, BaTaher H, et al. Anakinra in hospitalized patients with severe COVID-19 pneumonia requiring oxygen therapy: Results of a prospective, open-label, interventional study. Int J Infect Dis. 2021 Feb;103:288-296.
- ↑CORIMUNO-19 Collaborative group. Effect of anakinra versus usual care in adults in hospital with COVID-19 and mild-to-moderate pneumonia (CORIMUNO-ANA-1): a randomised controlled trial. Lancet Respir Med. 2021 Jan 22:S2213-2600(20)30556-7.
- ↑Entrenas Castillo M, Entrenas Costa LM, Vaquero Barrios JM, Alcalá Díaz JF, López Miranda J, Bouillon R, et al. “Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study”. J Steroid Biochem Mol Biol. 2020 Oct;203:105751.
- ↑Annweiler C, Hanotte B, Grandin de l’Eprevier C, Sabatier JM, Lafaie L, et al. Vitamin D and survival in COVID-19 patients: A quasi-experimental study. J Steroid Biochem Mol Biol. 2020 Nov;204:105771.
- ↑Rastogi A, Bhansali A, Khare N, Suri V, Yaddanapudi N, Sachdeva N, et al. Short term, high-dose vitamin D supplementation for COVID-19 disease: a randomised, placebo-controlled, study (SHADE study). Postgrad Med J. 2020 Nov 12:postgradmedj-2020-139065.
- ↑Annweiler G, Corvaisier M, Gautier J, Dubée V, Legrand E, Sacco G, et al. Vitamin D Supplementation Associated to Better Survival in Hospitalized Frail Elderly COVID-19 Patients: The GERIA-COVID Quasi-Experimental Study. Nutrients. 2020 Nov 2;12(11):3377.
- ↑Pairo-Castineira E, Clohisey S, Klaric L, Bretherick AD, Rawlik K, Pasko D, et al. Genetic mechanisms of critical illness in COVID-19. Nature. 2021 Mar;591(7848):92-98.
- ↑Kalil AC, Patterson TF, Mehta AK, Tomashek KM, Wolfe CR, Ghazaryan V,et al; ACTT-2 Study Group Members. Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19. N Engl J Med. 2021 Mar 4;384(9):795-807.
- ↑Deftereos SG, Giannopoulos G, Vrachatis DA, Siasos GD, Giotaki SG, Gargalianos P, et al; GRECCO-19 investigators. Effect of Colchicine vs Standard Care on Cardiac and Inflammatory Biomarkers and Clinical Outcomes in Patients Hospitalized With Coronavirus Disease 2019: The GRECCO-19 Randomized Clinical Trial. JAMA Netw Open. 2020 Jun 1;3(6):e2013136.
- ↑Lopes MI, Bonjorno LP, Giannini MC, Amaral NB, Menezes PI, Dib SM, et al. Beneficial effects of colchicine for moderate to severe COVID-19: a randomised, double-blinded, placebo-controlled clinical trial. RMD Open. 2021 Feb;7(1):e001455.
- ↑Tardif JC, Bouabdallaoui N, L’Allier PL, Gaudet D, Shah B, Pillinger MH, et al. Efficacy of colchicine in non-hospitalized patients with COVID-19. medRxiv 2021.01.26.21250494.
- ↑Vrachatis DA, Giannopoulos GV, Giotaki SG, Raisakis K, Kossyvakis C, Iliodromitis KE, et al. Impact of colchicine on mortality in patients with COVID-19: A meta-analysis. Hellenic J Cardiol. 2021 Jan 6:S1109-9666(20)30285-2.
- ↑Salah HM, Mehta JL. Meta-analysis of the Effect of Colchicine on Mortality and Mechanical Ventilation in COVID-19. Am J Cardiol. 2021 Feb 19;145:170–2.
- ↑Hariyanto TI, Halim DA, Jodhinata C, Yanto TA, Kurniawan A. Colchicine treatment can improve outcomes of coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. Clin Exp Pharmacol Physiol. 2021 Mar 14.
- ↑Lemos ACB, do Espírito Santo DA, Salvetti MC, Gilio RN, Agra LB, Pazin-Filho A, et al. Therapeutic versus prophylactic anticoagulation for severe COVID-19: A randomized phase II clinical trial (HESACOVID). Thromb Res. 2020 Dec;196:359-366.
- ↑Sadeghipour P, Talasaz AH, Rashidi F, Sharif-Kashani B, Beigmohammadi MT, Farrokhpour M, et al. Effect of Intermediate-Dose vs Standard-Dose Prophylactic Anticoagulation on Thrombotic Events, Extracorporeal Membrane Oxygenation Treatment, or Mortality Among Patients With COVID-19 Admitted to the Intensive Care Unit: The INSPIRATION Randomized Clinical Trial. JAMA. 2021 Mar 18.
- ↑NIH ACTIV Trial blood thinners pauses enrollment of critically ill COVID-19 patients. NIH. December 22, 2020. Available from: https://www.nih.gov/news-events/news-releases/nih-activ-trial-blood-thinners-pauses-enrollment-critically-ill-covid-19-patients. Accessed [29.03.2021]
- ↑Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020 Mar 16;14(1):72-73.
- ↑March 28, 2020 [Internet] Available from: https://www.fda.gov/media/136534/download Accessed [05.04.2021]
- ↑Coronavirus (COVID-19) update: FDA revokes emergency use authorization for chloroquine and hydroxychloroquine. FDA. June 15, 2020. [Internet] Available from: https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and. Accessed [05.04.2021]
- ↑Coronavirus (COVID-19) Update: FDA Issues Emergency Use Authorization for Potential COVID-19 Treatment. FDA. May 01, 2020. [Internet] Available from: https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-issues-emergency-use-authorization-potential-covid-19-treatment Accessed [10.04.2021]
- ↑Remdesivir es el primer tratamiento que recibe la recomendación de la EMA frente a Covid-19. Diariofarma. June 25, 2020 [Internet] Available from: https://www.diariofarma.com/2020/06/25/remdesivir-es-el-primer-tratamiento-que-recibe-la-recomendacion-de-la-ema-frente-a-covid-19. Accessed [10.04.2021]
- ↑Clinical management of COVID-19-World Health Organization. Interim guidance. May 27, 2020. Available from: https://apps.who.int/iris/rest/bitstreams/1278777/retrieve. Accessed [05.04.2021]
- ↑Guia NIH: tratamiento de COVID-19. Uso de fármacos específicos en pacientes con COVID-19. Available from: https://empendium.com/manualmibe/covid19/237133,guias-nih-tratamiento-de-covid-19-uso-de-farmacos-especificos-en-pacientes-con-covid-19. Accessed [08.04.2021]
- ↑Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. NIH. Available from: https://www.covid19treatmentguidelines.nih.gov/. Accessed [08.04.2021]
- ↑Clinical management of COVID-19-World Health Organization. Interim guidance. January 25, 2021. Available from: https://www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-1. Accessed [08.04.2021]
- ↑Rodríguez-Baño J, Pachón J, Carratalà J, Ryan P, Jarrín I, Yllescas M, et al. Treatment with tocilizumab or corticosteroids for COVID-19 patients with hyperinflammatory state: a multicentre cohort study (SAM-COVID-19). Clin Microbiol Infect. 2020 Aug 27:S1198-743X(20)30492-4.
- ↑Martínez-Sanz J, Muriel A, Ron R, Herrera S, Pérez-Molina JA, Moreno S, et al. Effects of tocilizumab on mortality in hospitalized patients with COVID-19: a multicentre cohort study. Clin Microbiol Infect. 2021 Feb;27(2):238-243.
- ↑Suspension des inclusions en France dans les essais clinique evaluant l’anakinra dans la prise en charge de la COVID-19. ASNM. October 29,2020. Available from: https://ansm.sante.fr/actualites/suspension-des-inclusions-en-france-dans-les-essais-clinique-evaluant-lanakinra-dans-la-prise-en-charge-de-la-covid-19 Accessed [02.04.2021]
- ↑Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. NIH. Available from: https://www.covid19treatmentguidelines.nih.gov/. Accessed [08.04.2021]
- ↑Clinical management of COVID-19-World Health Organization. Interim guidance. January 25, 2021. Available from: https://www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-1. Accessed [08.04.2021]
- ↑Recomendaciones de tromboprofilaxis y tratamiento antitrombóticoenpacientes. Sociedad Española de Trombosis y Hemostasia (SETH). 2020. Available from: https://www.covid-19.seth.es/recomendaciones-de-tromboprofilaxis-y-tratamiento-antitrombotico-en-pacientes-con-covid-19/. Accessed [29.03.2021]
- ↑COVID-19 rapid guideline: Managing COVID-12. NICE guideline. March 23, 2021. Available from: https://www.nice.org.uk/guidance/ng191/resources/fully-accessible-version-of-the-guideline-pdf-pdf-9078468301 Accessed [14.04.2021]
- ↑London AJ, Kimmelman J. Against pandemic research exceptionalism. Science. 2020 May 1;368(6490):476-477. doi: 10.1126/science.abc1731. Epub 2020 Apr 23. PMID: 32327600.
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Correspondencia: Miguel Angel López Zúñiga. Av. de las Fuerzas Armadas, 2 · 18014 Granada. 2ª planta izquierda. Enfermedades infecciosas