Original
Análisis histológico de la pared de la vena sana y varicosa y su correlación con sus propiedades biomecánicas
Histological analysis of the wall of a healthy and varicose vein and their correlation with their biomechanical properties
Actual. Med. 2014; 99: (791): 22-26 DOI: 10.15568/am.2014.791.or05
Enviado 25-11-2013
Revisado 01-02-2014
Aceptado 12-03-2014
RESUMEN
Objetivos: Las varices son una enfermedad muy frecuente en la población, cuya patogenia aun no está clara. Los cambios en la pared de la vena varicosa respecto a la sana determinan su comportamiento biomecánico y la aparición de varices. El presente estudio tiene por objetivo establecer dichas características estructurales en la pared de la vena sana y varicosa, su correlación con los cambios biomecánicos y su contribución a la patogenia de las varices.
Métodos: Se llevó a cabo un estudio descriptivo tomando 10 muestras de vena varicosa de pacientes intervenidos de varices mediante crosectomía de la unión safenofemoral, y 4 muestras de vena sana en pacientes sometidos a amputación en los que se descartó enfermedad venosa previa. Las muestras fueron procesadas para su análisis histológico con microscopía óptica con las tinciones de hematoxilina-eosina, orceína y picrosirius. Se determinaron las propiedades biomecánicas en ambos grupos, calculándose el esfuerzo y deformación de ruptura, así como el módulo elástico medio.
Resultados: Se han observado cambios histológicos en la pared de la vena varicosa respecto de la sana, con engrosamiento a nivel intimal y en la capa media, aumento de fibras colágenas, disminución de elásticas y alteración de la morfología de las células musculares lisas que pierden su orientación característica. Asimismo se ha encontrado un menor esfuerzo y deformación de ruptura y una mayor rigidez en el grupo de venas varicosas. Dichas alteraciones contribuyen a la deformidad de la pared venosa y la incompetencia valvular, implicados en la aparición de varices.
Conclusiones: Las alteraciones histológicas observadas en la pared de la vena varicosa pueden correlacionarse con los cambios en las características biomecánicas y con el proceso patogénico que favorece la aparición de varices.
Palabras clave: Venas varicosas, biomecánica, técnica histológica.
ABSTRACT
Purpose: Varicose veins are a very common disease, whose pathogeny still remains unclear. Changes in the varicose vein wall in relation to the normal vein, determine its biomechanical behaviour and the appearance of varicose veins. The purpose of this study is to correlate structural and biomechanical properties of healthy and varicose veins, and its contribution to the appearance of varicose veins.
Methods: A descriptive study was performed. 10 samples were taken from patients who underwent varicose vein surgery, which consisted in crosectomy of the safeno-femoral junction, and 4 samples of healthy vein from patients who underwent major amputation after dismissing those with signs or symptoms of venous disease.
Results: Histological changes have been observed in the varicose vein wall in relation to the healthy vein, consisting in intimal and media thickening, increased amount of collagen fibres, decrease of elastic fibres, and lack of characteristic morphology and orientation in muscular cells. In addition, a lower strain and deformation rupture, and high stiffness has been observed in varicose veins. These changes contribute to varicose vein deformation, valvular incompetence and the appearance of varicose veins.
Conclusion: Histological changes in varicose veins correlate with biomechanical properties and pathogenic process leading to varicose veins appearance.
Keywords: Varicose veins, biomechanical, histological techniques.
Leer Artículo Completo
INTRODUCCIÓN
Las varices son dilataciones tortuosas de las venas superficiales, típicamente de miembros inferiores, que aparecen como consecuencia de la insuficiencia valvular venosa y la incapacidad de mantener un flujo sanguíneo eficaz hacia el corazón. Ocupan el segundo grado (de un total de seis) de la clasificación CEAP (Clínica Etiológica Anatómica Patofisiológica), usada comúnmente para definir la insuficiencia venosa crónica en miembros inferiores de los pacientes (1). La insuficiencia venosa crónica en sus múltiples estadios es un problema frecuente en la población adulta, presentando varices aproximadamente un tercio de la población en nuestro país, según el estudio Detect-IVC (2). Esta alta prevalencia condiciona un alto costo sanitario y una gran cantidad de bajas laborales por alguna de las complicaciones de la insuficiencia venosa crónica.
Se han identificado factores predisponentes para la aparición de varices, tales como el sexo, la gestación, el peso (3), la altura, la raza, la dieta y hábitos intestinales, el trabajo, la postura, haber sufrido una trombosis venosa profunda previamente y determinados marcadores genéticos (4). Aun así, el proceso patogénico por el cual venas sanas degeneran en varicosas aún no está claro. Últimamente se piensa que se trata de un proceso inflamatorio crónico, en el cual hay leucocitos atrapados en la microcirculación venosa que pueden extravasarse y liberar una serie de sustancias que producen fibrosis tisular de la pared venosa. Dicha fibrosis conlleva una pérdida de la competencia valvular con el consecuente reflujo sanguíneo e hipertensión venosa, lo cual no hace más que perpetuar y agravar el problema (5,6). Dentro de los mediadores moleculares implicados, parece que los más relevantes son el factor de crecimiento transformante beta (TGF-β), otros factores de crecimiento (como PDGF, VEGF), metaloproteinasas (MMP-2), disminución de la óxido nítrico sintasa (7) y aumento de radicales libres en las venas varicosas, entre otros. Todo ello conlleva un aumento en la actividad apoptótica a través de distintas vías de señalización intracelular, sobre todo a nivel de la capa media (8,9,10) y aumento de la fibrosis en la pared de la vena.
La distensibilidad de la pared de la vena está determinada por la proporción de colágeno, elastina y células musculares lisas que la forman (11). Sin embargo, existen evidencias contradictorias acerca de la concentracion de tejido conectivo y tejido muscular liso patológico en las venas varicosas (12). Algunos autores han demostrado una menor concentración de fibras colágenas y elásticas en venas varicosas (13), mientras que otros han encontrado una concentración mayor de colágeno y similar de fibras elásticas (14). También se ha hablado de una menor concentración de fibras elásticas y mayor de colágenas (15).
La naturaleza recurrente de la enfermedad, el alto coste para el sistema sanitario y la ineficacia de los tratamientos actuales subrayan la importancia de la investigación en esta enfermedad. El presente trabajo de investigación tiene por objetivo identificar los patrones histológicos de las paredes venosas para establecer la correlación de los elementos estructurales que la integran con las propiedades biomecánicas de dichos vasos. Esta identificación es importante no solo en relación con la biopatología del proceso y su incidencia clínico-quirúrgica, sino también con las propiedades límite que puede alcanzar una pared venosa a la hora de programar su fabricación artificial por ingeniería tisular.
MATERIALES Y MÉTODOS
Obtención de muestras de vena varicosa y vena sana
La obtención de muestras se llevó a cabo durante el periodo comprendido entre los meses de diciembre de 2012 a junio de 2013 en el Servicio de Angiología y Cirugía Vascular del Hospital San Cecilio de Granada, España.
Las muestras de vena varicosa fueron obtenidas de pacientes en estadio C2, EP, AS, PR(todos los pacientes presentaban varices, sin presentar ninguno de ellos edema, ni lipodermatoesclerosis ni úlcera venosa actual o pasada), durante la intervención de varices, tomándose un fragmento de 5cm de vena safena interna, 3 cm por debajo de la unión safeno-femoral tras realizar crosectomía a dicho nivel. Se tomaron un total de 10 muestras, siendo la media de edad de 53 años y 8 mujeres y 2 hombres. A todos los pacientes se les realizó estudio ECO-Doppler venoso preoperatorio, asegurando la existencia de reflujo y la cuantía del mismo. En todos los pacientes la válvula de la unión safenofemoral era incompetente.
Las muestras de vena sana (de 5 cm de longitud al menos) fueron obtenidas de pacientes a los que se realizó amputación mayor supra o infracondílea por isquemia irreversible de miembros inferiores. Se tomaron cinco muestras siendo la media de edad de 68 años, cuatro hombres y una mujer. En todos ellos se había descartado clínicamente de forma previa patología venosa por ausencia de signos y síntomas de insuficiencia venosa crónica y antecedentes de trombosis venosa profunda, obteniéndose durante la intervención un fragmento de vena safena interna en el nivel de la amputación.
Cada muestra fue dividida en varios fragmentos para su análisis en microscopio óptico y algunas de ellas, para el análisis de sus propiedades biomecánicas. Todas las muestras fueron inicialmente conservadas en PBS.
El estudio se realizó tras el correspondiente consentimiento informado del paciente.
Microscopía óptica
Las muestras para microscopía óptica fueron seccionadas con bisturí transversalmente consiguiendo cilindros de 2mm de alto y longitudinalmente en rectángulos de aproximadamente 2x5mm, con objetivo de tener cortes en ambos planos para su visualización a microscopio óptico. Seguidamente fueron fijadas con formaldehído 4%, deshidratadas e incluidas posteriormente en parafina. Se realizaron secciones de 4 micrometros y se llevó a cabo tinción de los cortes con hematoxilina-eosina, picrosirius y orceína. Las diferentes muestras fueron observadas y fotografiadas utilizando un microscopio IX81-Olympus con una cámara digital Olympus DP-71digital y un software DP-BSW (todos de Olympus)(16).
Métodos biomecánicos
Los análisis de tracción uniaxial fueron realizados empleando una máquina de análisis material electromecánico (Instron, Model 3345-K3327). Se emplearon para ello muestras seccionadas longitudinalmente con una longitud de al menos 5 cm. Para evitar el deslizamiento de las muestras y para minimizar el desgarro o rotura de las mismas en el lugar de sujeción de las mordazas, se fijaron usando tornillos de acción manual y papel de lija ultrafino. Además, fue necesario sujetar un área considerable de la muestra en las mordazas para aumentar la fricción y así evitar el deslizamiento.
En los test de tracción, los datos de carga y extensión de ruptura dependen del modo de sujeción de la muestra, ya que no existe en la literatura un procedimiento estandarizado hasta la fecha . La distancia entre las mordazas se fijó en 15 mm, siendo el resto del área de la muestra ocupada por las mordazas. Los test se efectuaron a una velocidad de tracción constante de 5mm/min a temperatura ambiente. La distancia entre las mordazas fue automáticamente determinada por el software Instron-BlueHill2. Un sensor Instron 500N,muestreando a 10Hz, se usó para obtener los datos para la curva de esfuerzo-deformación. El cálculo del valor medio y la desviación estándar de los resultados fueron calculados automáticamente por el software Instron – BlueHill2.
En este experimento se ha calculado la curva esfuerzo-deformación, que normaliza por la geometría de la muestra la curva de carga-extensión. En ella, las ecuaciones pueden ser expresadas de la siguiente forma:
Esfuerzo: ƈ=fuerza/área=carga/área transversal
Deformación: Ɛ=(Δl/l0)=(l1-l0/l0)
Módulo de Young: E= σ / Ɛ siendo σ =F/A
donde F es la fuerza medida por el sensor durante el experimento y A es el área transversal inicial donde se aplica la fuerza, y que corresponde a 1mmx6mm (espesor de pared x diámetro externo) en venas sanas y 1mmx8mm en venas varicosas. Δl es la la elongación de la muestra, siendo l0 la longitud original (5mm).
El módulo elástico de Young (E), que mide la rigidez de una muestra dada, fue calculado como la tangente de la primera porción lineal de la curva de esfuerzo-deformación de cada experimento. A mayor valor del módulo de elasticidad, mayor es la rigidez de la muestra (menos elástica) y antes se produce el punto de inflexión en la curva esfuerzo-deformación. La carga y extensión de rotura fueron calculadas seleccionando el punto de la curva de esfuerzo-deformación en el cual ocurría la ruptura de la muestra.
RESULTADOS
1. Microscopía óptica:
– Estudio control
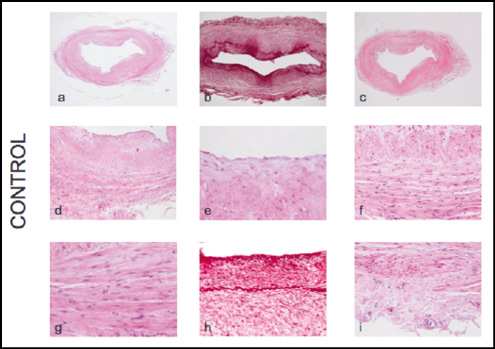
En el análisis con hematoxilina-eosina de las venas sanas, pueden distinguirse con facilidad tres capas en los cortes transversales (Fig1. A-d). La íntima corresponde a la capa más interna, donde a su vez puede diferenciarse el endotelio y un subendotelio, subyacente al anterior y formado por tejido conectivo (Fig1.e). La capa media está formada principalmente por células musculares lisas en disposición longitudinal en la zona más interna, y circular en la más externa (Fig1.f). Las células musculares lisas que integran dicha capa tienen una morfología característica fusiforme (fenotipo contráctil) y entre ellas se disponen finas fibras de colágeno bien alineadas (Fig 1.g). Entre ambas capas (íntima y media), puede distinguirse fácilmente la lámina elástica interna. Por último la adventicia, capa más externa, formada por fibroblastos, colágeno, capilares principalmente (Fig 1.h).
Figura 1. Cortes histológicos de las muestras de vena sana. a: corte transversal 2x teñido con hematoxilina-eosina. B: corte transversal a 4x teñido con orceína (se tiñen en rojo las fibras elásticas) C: corte transversal a 2x teñido con picrosirius. D: visión general de todas las capas a 10x. E: Endotelio y subendotelio. F: capa media con células musculares en disposición longitudinal en su parte más interna y circular en la externa. G: morfología típica de las células musculares lisas, en forma de huso. H: lámina elástica interna perfectamente apreciable con tinción de orceína. I; adventicia, que contiene capilares.
Empleando la tinción de orceína, se ha observado un acúmulo importante a nivel subendotelial y algo menor en la capa media, dibujándose perfectamente entre ambas la lámina elástica interna (Fig 1.h), debido al alto contenido en fibras elásticas que se tiñen de color rojizo con la orceína.
En la tinción de picrosirius pudo verse la densidad de colágeno en las distintas capas.
– Estudio de venas varicosas
Una vez descrita la estructura histológica observada en venas sanas, se detallan a continuación una serie de hallazgos en las venas varicosas que difieren del patrón de normalidad antes descrito.
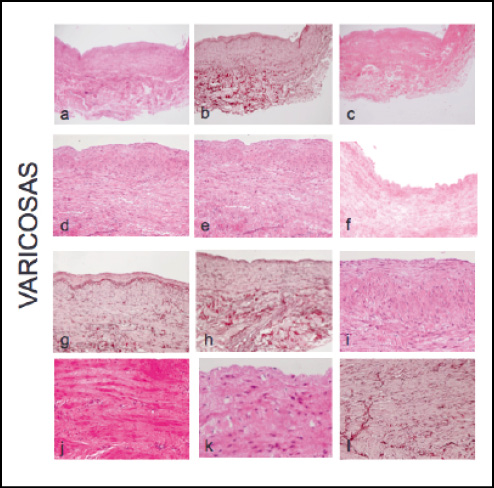
En las venas varicosas puede apreciarse una hipertrofia intimal, debido principalmente a la infiltración de tejido colágeno en dicha capa y la posible emigración de células musculares lisas, que se observan a dicho nivel en algunos cortes. Además, la superficie intimal es más irregular que en la vena sana, con discontinuidad del endotelio en algunos tramos (Fig 2.f).
Figura 2. A, b, c: tinción con hematoxilina-eosina, orceína y picrosirius de un mismo segmento de vena varicosa a 4x. d y e: todas las capas a 10x, teñidas con hematoxilina-eosina. f: irregularidad de la superficie del endotelio. g y h: aunque en algunos cortes puede apreciarse bien la lámina elástica interna (g), no es lo usual, siendo más frecuente que sea difícil apreciarla (h). i: las células musculares lisas no guardan una orientación tan clara y definida como en la vena sana, siendo su disposición más irregular. j: separación entre unas células musculares lisas y otras, por la infiltración por colágeno. k: irregularidad de la morfología de las células musculares lisas, que dejan de ser fusiformes. l: se aprecia una densidad menor de fibras elásticas que en vena sana en la tinción con orceína.
El grosor de la capa media es también significativamente mayor (Fig 2.d,e). Al observar los cortes a gran aumento puede observarse que las células musculares lisas pierden su morfología habitual en huso y finas, mostrándose hipertróficas con una forma más irregular (Fig2,k). A ello se une la infiltración por tejido colágeno en dicha capa, lo cual puede justificar el aumento de grosor de la capa media (Fig 2,j). La densidad de células musculares lisas encontrada es similar. Puede apreciarse también que las células musculares no se orientan de forma tan definida en longitudinal (parte más interna) y circular (parte más externa), sino que lo hacen de forma más irregular (Fig 2,i).
Las tinciones con orceína de las muestras de vena varicosa reflejan una concentración menor de fibras elásticas en la pared de la vena, con respecto a las muestras de vena sana. Este hecho es más evidente en la lámina elástica interna y menos en la capa media (Fig 2.g,h). Dichas fibras muestras además un patrón más desorganizado (Fig 2,l).
Por último destacar el aumento de la matriz de colágeno en la pared de las venas varicosas sobre todo a nivel de la capa media, donde produce una separación entre las células musculares lisas como se ha dicho con anterioridad (Fig 2,j).
2. Análisis de propiedades biomecánicas
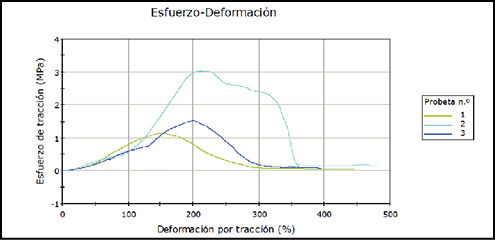
La curva de esfuerzo-deformación para venas sanas fue la siguiente (figura 3):
Figura 3. Curva esfuerzo-deformación para venas sanas
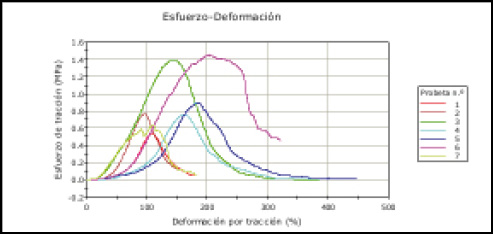
Mientras que para las venas varicosas fue (figura 4):
Figura 4. Curva esfuerzo-deformación para venas varicosas
En ambas curvas se observa el comportamiento de las muestras de vena sana y varicosa tras la aplicación de una tracción constante de 5mm/min. A diferencia de la curva de carga-extensión, que no se representa aquí y que sólo tiene en cuenta la fuerza aplicada y el cambio de longitud detectado, en la curva de esfuerzo-deformación se tiene en cuenta la geometría de la muestra y se normaliza por la misma. La parte ascendente de la curva representa el cambio de longitud respecto al inicial de la muestra, conforme se va aplicando una fuerza creciente por área. El punto de inflexión será el momento en el que la muestra comience a romperse, requiriendo un esfuerzo de tracción cada vez menor para deformarla. El Módulo de elasticidad de Young (E), que informa de la rigidez de la muestra, indica cuánto esfuerzo es preciso aplicar para conseguir un aumento de deformación de la muestra, y corresponde en la gráfica a la tangente de la primera porción lineal de la curva de esfuerzo-deformación.
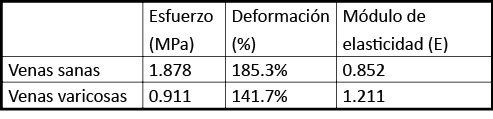
Se detallan los valores medio de esfuerzo, deformación y módulo de elasticidad para venas sanas y varicosas (tabla 1).Se ha obtenido un valor medio de esfuerzo menor para las venas varicosas que para las sanas, lo que indicaría que se precisa una menor fuerza de tracción para conseguir la ruptura de la muestra. La media de deformación al punto de ruptura es también menor en venas varicosas, lo que significa que las muestras han alcanzado en promedio, una deformación menor que las sanas antes de romperse.
Tabla 1. Valores medio de esfuerzo, deformación y módulo de elasticidad para venas sanas y varicosas. Por último, el valor medio del módulo elástico tiene un valor mayor (1.211 > 0.852) en el grupo de venas varicosas, por lo que la rigidez en promedio de éstas es mayor que las de las sanas.
DISCUSIÓN
Las características biomecánicas de la pared venosa están determinadas por la concentración de células musculares lisas, colágeno y elastina. El tono está controlado por las células musculares lisas en la túnica media, a su vez influenciadas por la inervación autonómica y por sustancias circulantes en el torrente sanguíneo. La distensibilidad está principalmente controlada por la concentración de elastina y colágeno presente en la pared de la vena. Alteraciones en el porcentaje de cada uno de estos componentes pueden llevar a alteraciones estructurales de la pared de la vena que provoquen incompetencia valvular, reflujo, aumento del diámetro de la vena y cambios en sus propiedades biomecánicas. El presente estudio ha mostrado cambios significativos en el contenido de músculo liso, colágeno y elastina en la pared de las venas varicosas comparado con las sanas, lo que se ha traducido en diferencias apreciables en los experimentos de biomecánica realizados.
En este estudio, se ha observado un aumento en el grosor intimal en las venas varicosas comparado con las sanas, de acuerdo con lo observado en estudios previos (15,17). Este aumento de grosor podría deberse al acúmulo de colágeno a nivel del subendotelio, así como a una migración de células musculares lisas a este nivel (18). Se ha encontrado una fragmentación a nivel del endotelio en distintos tramos, también descrito por estos autores.
Se ha encontrado un aumento en el grosor de la capa media, de acuerdo a los hallazgos de otros estudios previos. Hay controversia en la literatura acerca de la densidad de células musculares lisas en dicha capa, existiendo autores que demuestran un incremento (14,19), una disminución, y otros que no encuentran cambios. Sin embargo, parece que la pérdida de tono y capacidad contráctil en las venas varicosas no tiene tanto que ver con el número de células musculares lisas, sino con la disfunción de las mismas, siendo incapaces de ejercer una contracción eficaz (20). Quizá en esto tenga que ver la infiltración de tejido conectivo en la capa media cuando no puede establecerse una unión directa eficaz entre las células. Se observa también que las células musculares lisas dejan de tener su morfología característica en forma de huso para aparecer hipertróficas y con una forma más irregular.
Muchos estudios, incluyendo éste, hacen referencia al aumento de colágeno en la pared de la vena varicosa (14,21,22), que es más evidente a nivel de la capa media, causando separación entre las células musculares lisas (23). También se han encontrado diferencias en las fibras elásticas, más evidentes en la tinción con orceína. Mientras que en las venas sanas se dibuja con nitidez la lámina elástica interna, en las venas varicosas es difícil verla. La cantidad total de fibras elásticas es menor en las venas varicosas, siendo además el patrón de dichas fibras más irregular que en las venas sanas.
En el estudio biomecánico realizado, los cambios en la cantidad de colágeno y elastina en la pared de venas sanas y varicosas, se traducen en un mayor módulo elástico, en promedio, para las venas varicosas. Pese al bajo número de muestras estudiado, puede afirmarse que debido a la fibrosis de la pared, las venas varicosas son más rígidas (mayor módulo de elasticidad) que las sanas, de acuerdo con estudios previos (24,25). Se ha encontrado que la deformación y esfuerzo al punto de ruptura es menor en las venas varicosas, lo cual significa que las venas varicosas han llegado a deformarse menos que las sanas en promedio y han precisado de menos tracción, antes de romperse. Sería interesante, mediante estudios ulteriores, discriminar la deformación al final de la parte elástica de la curva, cuando la muestra puede volver a su configuración normal una vez cese la fuerza.
Un hecho a tener en cuenta en este estudio ha sido el distinto nivel anatómico en el cual han sido tomadas las muestras (las de vena sana al nivel de la amputación mayor, mientras que las de vena varicosa unos centímetros distal al cayado de la vena safena interna), por motivos éticos. En el análisis histológico, ésto influye en el diámetro de la vena que se analiza y grosor de la pared de la misma, aunque no en los cambios patológicos de la pared venosa que en este estudio se refieren (migración de células musculares lisas al subendotelio, fragmentación del endotelio, pérdida de fibras elásticas y acúmulo de colágeno en la capa media, etc). Por otro lado, en el análisis biomecánico, se ha estudiado la curva esfuerzo-deformación de cada muestra, que normaliza por la geometría (variable según el nivel anatómico) la curva de carga-extensión de las mismas.
La fibrosis y el aumento de rigidez observadas en las venas varicosas, conllevan una deformación de la pared venosa que propicia la incompetencia valvular y reflujo que origina la aparición de varices (26).
CONCLUSIÓN
En conclusión este estudio indica la existencia de una serie de cambios en la pared de la vena varicosa con respecto a la sana, que incluyen alteraciones a nivel intimal, en el tejido conectivo y en las células musculares lisas. Dichos cambios se correlacionan con diferencias observadas en el comportamiento biomecánico de ambos tipos de venas, y en definitiva con la aparición de venas varicosas en los pacientes.
REFERENCIAS
- Allegra C, Antignani PL, Bergan JJ, et al. The “C” of CEAP: Suggested definitions and refinements: An International Union of Phlebology conference of experts. J Vasc Surg. 2003; 37:129-131.
- Gesto-Castromil R, García JJ, Grupo DETECT-IVC. Encuesta epidemiológica realizada en España sobre la prevalencia asistencial de la IVC en atención Primaria. Angiología. 2001; 53: 249-60.
- In Browse NL, Burnand KG, Irvine AT, Wilson NM. Varicose veins: Pathology. Oxford University Press. 1999; 145-162.
- Cornu-Thenard A, Boivin P, Baud MM, et al. Importance of the familiar factor in varicose disease: Clinical study of 134 families. J Derm Surg Oncol. 1994; 20:318-326.
- Raffetto JD, Khalil RA. Mechanism of varicose vein formation: valve dysfunction and wall dilation. Phlebol. 2008; 23(2): 85-98.
- Atta Hm. Varicose veins: role of mechanotransduction of venous hypertension. Int J Vasc Med. 2012; 212:538-627
- Haviarova Z, Janegova A, Janega P, et al. Nitric oxide synthases in varicose vein wall. Brat Med J. 2011; 112:123-135.
- Filis, K. Increased Vein Wall Apoptosis in Varicose Vein Disease is Related to Venous Hypertension. Eur J Vasc Endovasc Surg. 2011;41(4):533–539
- Bujan J, Jimmenez-Cossio JA, Jurado F, et al. Evaluation of the smooth muscle cell component and apoptosis in the varicose vein wall. Histol Histopathol. 2000;15:745–752
- Ducasse E, Giannakakis K, Chevalier J, et al.Disregulated apoptosis in primary varicose veins.Eur J Vasc Endovasc Surg. 2005; 29:316-23
- Harley BA, Leung JH, Silva CM, and L. J. Gibson. Acta biomaterialia. 2007, 3: 463–74.
- Wali MA, Dewan M, Eid RA. Histopathological changes in the wall of varicose veins. Int Angiol. 2003; 22(2):188-93.
- Psaila TV and Melhuish T. Viscoelastic properties and collagen content of the long saphenous vein in normal and varicose veins. Br J Surg. 1989; 76:37-40
- Travers JP, Brookes CE, Evans J, et al. Assessment of wallstructure and composition of varicose veins with reference tocollagen, elastin and smooth muscle content. Eur J VaseEndovasc Surg. 1996; 11:230-7
- Naim MM, Elsharawy M. Histological assessment of the long saphenous vein in normal and varicosa veins. Egypt J Histol. 2005; 28 (2): 281-290.
- San Martin S, Alaminos M, Zorn TM, et al. The effects of fibrin and fibrin-agarose on the extracellular matrix profile of bioengineered oral mucosa. J Tissue Eng Regen Med. 2013; 7(1):10-9.
- Wali MA, Eid RA. Intimal changes in varicoseveins: an ultrastructural study. J Smooth Muscle Res.2002; 38:63-74
- KhanAA, Eid RA, Hamdi A. Structural changes in the tunica intima of varicose veins: a histopathological andultrastructural study. Pathology. 2000; 32:253-257
- Wali MA, Eid RA. Smooth muscle changes invaricose veins: an ultrastructural study. J Smooth Muscle Res. 2001; 37:123-35
- Brunner F, Hoffman C, Schuller-Petrovic S. Responsiveness of human varicose saphenous vein tovasoactive agents. Br J Clin Pharmacol. 2001; 51:219-224
- Sansilvestri-Morel P, Rupin A, Badier-Commander C.Imbalance in the synthesis of collagen type I andcollagen type III in smooth muscle cells derived from humanvaricose veins. J Vase Res. 2001; 18:560-568
- Wali MA, Dewan M, Eid RA. Histopathologicalchanges in the wall of varicose veins. Int. Angiol. 2003. 22; 188-93
- Gandhi RH, Irizarry E, Nachman GB, et al: Analysis of the connective tissue matrix and proteolytic activity of primary varicose veins. J Vasc Surg. 1993; 18:814-820.
- Biskupski P, Dzieciuchowicz L, Kaczmarek E, et al. The influence of elastic components of the venous wall on the biomechanical properties of different veins used for arterial reconstruction. Eur J Vasc Endovasc. 2010; 40(2);224-229
- Sokolis, Dimitrios P. Experimental investigation and constitutive modeling of the 3D histomechanical properties of vein tissue. Biomech Model Mechan. 2013: 12(3); 431-51.
- Kirsch D, Wahl W, Böttger T, Junginger T. Primary varicose veins- Changes in the venous wall and elastic behavior. Chirurg. 2000: 71(3);300-306.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: José Damián Herrera Mingorance. Servicio de Angiología y Cirugía Vascular. Hospital Universitario San Cecilio de Granada. E-mail: damianherrer@gmail.com