Original
Modificaciones de la fibrosis hepática valorada mediante elastometría transitoria en pacientes con respuesta viral sostenida tras el tratamiento de la hepatitis C en pacientes monoinfectados (VHC) y coinfectados (VHC – VIH)
Modifications of hepatic fibrosis assessed by transient elastometry in patients with sustained virological response after treatment of hepatitis C in monoinfected (VHC) and coinfected patients(VHC – VIH)
Actual. Med. 2017; 102: (800): 18-22 DOI: 10.15568/am.2017.800.or03
Enviado: 23-02-2017
Revisado: 14-03-2017
Aceptado: 15-03-2017
RESUMEN
Introducción: Se ha observado que los pacientes infectados por el virus de la hepatitis C (VHC), que ya han desarrollado un grado de fibrosis significativo, son capaces de disminuir ese grado de fibrosis, al alcanzar una respuesta viral sostenida (RVS) tras el tratamiento con interferón pegilado (PEG-IFN) y ribavirina (RBV).
Objetivo: Evaluar la modificación de la fibrosis, medida por elastometría transitoria, al erradicar el VHC tanto en pacientes tratados con PEG-IFN y RBV, con Boceprevir/Telaprevir, como con agentes de acción directa (AAD) y determinar la asociación entre la variación de la fibrosis y el grado de fibrosis previo al tratamiento tanto en pacientes monoinfectados (VHC), como en coinfectados (VIH/VHC).
Métodos: Estudio observacional prospectivo, en el que se estudiaron 50 pacientes y se evaluó su grado de fibrosis previo y posterior al tratamiento.
Resultados: De los 62 pacientes, un 45,2% disminuyeron su fibrosis, con una media de descenso de 9,45kPa y un 45,2% disminuyeron al menos un estadio en la escala Metavir. Se observó una asociación entre un menor grado de fibrosis previo al tratamiento y un mayor descenso de la misma (p<0,001). Sin embargo no se observaron diferencias (p=0,713) entre la monoinfección y la coinfección con VIH; tampoco se detectó asociación significativa, entre los tres tipos de tratamientos y la modificación de la fibrosis (p=0,445).
Conclusiones: En nuestro estudio, la consecución de la RVS en los pacientes con hepatitis crónica por VHC facilita la reducción de la fibrosis producida por la enfermedad, tanto en pacientes monoinfectados, como en coinfectados (VIH/VHC), independientemente del tratamiento usado.
Palabras clave: Virus Hepatitis C (VHC), Agentes de acción directa (AAD), Fibrosis, Elastometría transitoria.
ABSTRACT
Introduction: It has been shown that patients infected with hepatitis C virus (HCV), who have already developed a significant degree of fibrosis, are able to reduce that degree of fibrosis by achieving a sustained virological response (SVR) after treatment with Pegylated interferon (PEG-IFN) and ribavirin (RBV).
Objective: To evaluate the modification of fibrosis, measured by transient elastometry, after HCV eradication in patients treated with PEG-IFN and RBV, with Boceprevir / Telaprevir, and with direct acting agents (AAD) and to determine the association between the variation in fibrosis and the degree of pre-treatment fibrosis in both monoinfected (HCV) and coinfected (HIV / HCV) patients.
Methods: This work is a prospective observational study. 50 patients were studied and their degree of fibrosis before and after treatment was evaluated.
Results: 45.2% of patients decreased their fibrosis, with a mean decrease of 9.45kPa and 45.2% decreased at least one stage on the Metavir scale. There was an association between a lower degree of fibrosis before treatment and a greater decrease in fibrosis (p <0.001). However, no differences were observed between monoinfection and HIV coinfection (p = 0.713). No significant association was detected between the three types of treatments and the modification of fibrosis (p = 0.445).
Conclusions: In our study, SVR in patients with chronic HCV hepatitis facilitates the reduction of fibrosis produced by the disease, both in monoinfected patients and in coinfected patients (HIV / HCV), regardless of the treatment used.
Keywords: Hepatitis C Virus (HCV), direct acting antiviral (DAA) agents, fibrosis, transient elastometry.
Leer Artículo Completo
INTRODUCCIÓN
En las últimas décadas, se ha observado un incremento sustancial de las tasas de mortalidad relacionadas con la hepatitis crónica por virus de la hepatitis C (HCVHC) (1). La prevalencia de hepatitis C crónica entre los pacientes VIH positivos está entre el 25 – 30% en Europa y EEUU (2). Además, mientras que la mortalidad relacionada con el VIH está descendiendo, la mortalidad relacionada con la HCVHC ha seguido incrementándose entre los pacientes coinfectados (VIH/VHC) y esta coinfección aparece ahora como la mayor causa de morbilidad y mortalidad no relacionada con el SIDA en pacientes VIH (3).
Cuando se comparó el progreso de la enfermedad entre pacientes monoinfectados (VHC) y coinfectados (VIH/VHC), se observó que la coinfección estaba asociada a una progresión más rápida de la fibrosis hepática (4) y que además, estos pacientes presentaban más riesgo de desarrollar cirrosis (5).
Tras el tratamiento, la respuesta viral sostenida (RVS) reduce la incidencia de complicaciones derivadas de la cirrosis y, por tanto, de las muertes relacionadas con ellas (6). Este beneficio está posiblemente relacionado con la reversibilidad del daño hepático histológico asociado a hepatitis una vez obtenida la RVS, ya que se ha visto que procesos tales como la inflamación y la fibrosis disminuyen en el 62 – 74% de los pacientes que alcanzan la RVS (7). Algunos estudios ya han documentado la mejora en la histología hepática (biopsia) tras conseguir la RVS (8), incluso cuando el paciente ya tiene una cirrosis establecida previa (9).
Para evaluar el grado de fibrosis hepática la prueba “gold-estándar” la biopsia hepática es una prueba invasiva. Entre las no invasivas, encontramos marcadores bioquímicos indirectos de fibrosis, como pueden ser los índices APRI, FORNS y el FIB4 (10), además de la elastometría transitoria, que mediante un instrumento de ultrasonidos, calcula la velocidad de propagación de las ondas a través del tejido hepático y de esa forma evalúa el grado de fibrosis. La elastometría cada vez se usa más debido a su rapidez, reproducibilidad, no invasividad y bajo coste (11). Además, en los pacientes con VHC tiene especial interés, debido a que los que consiguen RVS tras el tratamiento con interferón pegilado y ribavirina (Peg IFN + RBV) reducen en un 20% o más su grado de rigidez hepática. Así, se sugiere que medidas consecutivas con elastometría pueden ser útiles para monitorizar la evolución de la fibrosis en respuesta a la terapia antiVHC (12).
En la actualidad existen tratamientos con los llamados Agentes de Acción Directa (AAD) que actúan frente a diferentes enzimas del VHC y que además de su fácil administración con un tiempo de semanas de administración, tienen las ventajas de pocos efectos secundarios, su administración oral y fácil uso en los pacientes infectados por el Virus de la Inmunodeficiencia Humana (VIH) (13). Ante la aparición de estos nuevos tratamientos nos hemos planteado un estudio con los siguientes objetivos:
- Evaluar las modificaciones de la fibrosis hepática en pacientes que han alcanzado una RVS tras el tratamiento del VHC, tanto en pacientes monoinfectados (VHC) como coinfectados (VIH/VHC) e independientemente del tratamiento con el que consiguieron la RVS.
- Estimar en qué medida afecta el grado de fibrosis previo al tratamiento del VHC a la capacidad del paciente para disminuir a estadios inferiores de fibrosis.
MATERIAL Y MÉTODOS
En este estudio observacional prospectivo, se seleccionaron 96 pacientes VHC positivos, que acudían a la consulta de Enfermedades Infecciosas del Hospital Virgen de las Nieves de Granada y que recibieron un tratamiento contra el VHC, el cual decidió su médico responsable de acuerdo con las guías nacionales e internacionales de ese momento. Finalmente, el análisis estadístico se realizó sobre una muestra de 62 pacientes.
Los criterios de inclusión que se requirieron en el estudio fueron los siguientes:
- Mayores de 18 años.
- Portadores del VHC, demostrado mediante carga viral positiva.
- Que hayan alcanzado una RVS, es decir, aquellos en los que la carga viral del VHC permanezca indetectable (calculada mediante reacción en cadena de la polimerasa, PCR, con un límite de detección inferior a 15 unidades virales) más allá de la semana 12 después de la finalización del tratamiento.
- Disponer de dos medidas de elastometría transitoria documentadas, una previa al tratamiento y otra posterior.
Las mediciones por elastometría transitoria fueron llevadas a cabo por el mismo médico, entrenado en la realización de la técnica.
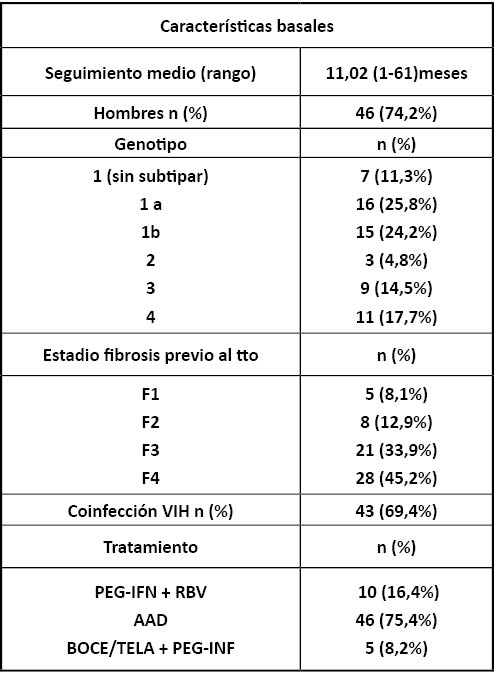
Las características basales que se estudiaron en los 62 pacientes fueron: genotipo, fibrosis previa al tratamiento (clasificada por estadios Metavir), coinfección con VIH y tratamiento recibido contra el VHC. La variable principal a estudiar fue la modificación de la fibrosis, teniendo especial interés la disminución de estadio. Se hicieron tablas de contingencia y tests de Chi-Cuadrado para determinar si había asociación entre cada una de las características descritas y la disminución de la fibrosis. El análisis estadístico se realizó mediante el paquete estadístico SPSS-20.
Este estudio ha sido diseñado respetando la confidencialidad y la protección de datos, junto con las normativas aplicables a la investigación biomédica.
RESULTADOS
96 pacientes fueron seleccionados para el estudio según los criterios de inclusión, pero 3 (3.1%) de ellos fueron excluidos debido a que aumentaron de peso durante el seguimiento y no se pudo determinar con la suficiente fiabilidad la segunda medición por elastometría por carecer de la sonda adecuada para obesos y 33 pacientes (32.29%) no acudieron a la segunda medición. Así, 62 pacientes fueron incluidos, finalmente, en el análisis. De ellos, 43 (69.4%) eran coinfectados y la mayoría de ellos, 33 (76.8%), tenían un estadio de fibrosis previo al tratamiento, igual o mayor de un F3, es decir, tenían ya un grado de fibrosis significativo. El predominio de estos pacientes en el estudio se debe a que son estos estadios avanzados los que han sido priorizados para el tratamiento, en el tiempo del estudio, siguiendo las instrucciones del Ministerio de Sanidad.
En la Tabla 1 (página siguiente) )se resumen las características basales de los pacientes analizados.
En un análisis general, con un seguimiento medio de 11 meses observamos que disminuyen su grado de fibrosis 42 pacientes (69.35%) con una media de descenso de 9.45 kPa, mientras que lo aumentan 19 (30.6%) con una media de 5,1 kPa y un paciente se queda exactamente con el mismo valor (1.6%).
En cambio, si analizamos la modificación en estadios Metavir, vemos que disminuyen de estadio 28 pacientes (45.2%) con una media de bajada de -1,78 estadios, se quedan en el mismo estadio 31 pacientes (50%), entre los cuales la media de modificación es una disminución de 2.23 kPa y sólo aumentan 3 pacientes (4.8%).
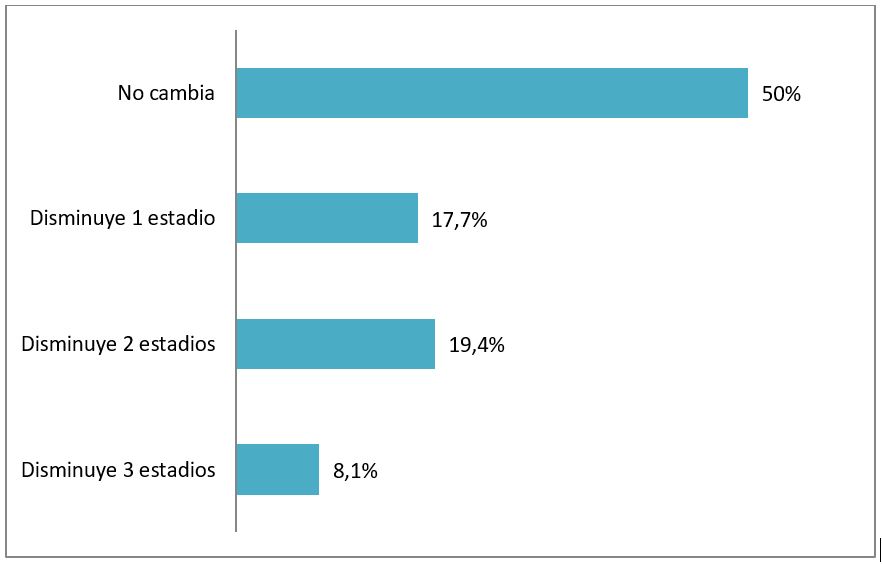
Si analizamos por separado, qué número de estadios disminuyen, observamos que 5 pacientes (8.1%) disminuyen en 3 estadios, 12 (19.4%) disminuyen en 2 estadios, 11 (17.7%) disminuyen en 1 estadio, 31 (50%) no cambian de estadio (Figura 1).
Tabla 1.– resumen de las características basales de los pacientes del estudio.VHC: Virus Hepatitis C. VIH: Virus Inmunodeficiencia Humana. PegIFN: Interferón pegilado. RBV: Ribavirina.
Figura 1. Cuantificación de estadios que se modifican.
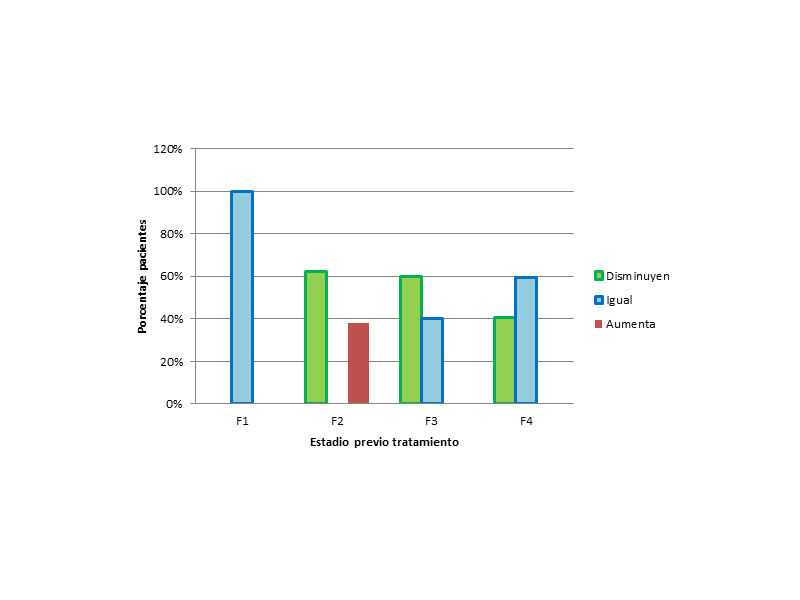
Posteriormente se analizaron los datos, dividiendo a los pacientes en grupos en función del estadio de fibrosis previo al tratamiento (Figura 2):
- De los 7 pacientes, que previamente tenían un grado F1, el 100 % se mantuvo sin aumentar de estadio.
- De los 8 pacientes que tenían F2, 5 (62,5%) disminuyeron y 3 (37.5%) se quedaron en el mismo estadio
- De losque tenían un grado F3 (20 pacientes), disminuyeron el 60% y no varió de estadio el 40%.
- Y finalmente, de los que previamente tenían una cirrosis establecida, F4,disminuyeron el 40.7% y se quedaron en el mismo 59.3%.
Figura 2: Modificación de la fibrosis en función del estadio previo al tratamiento.
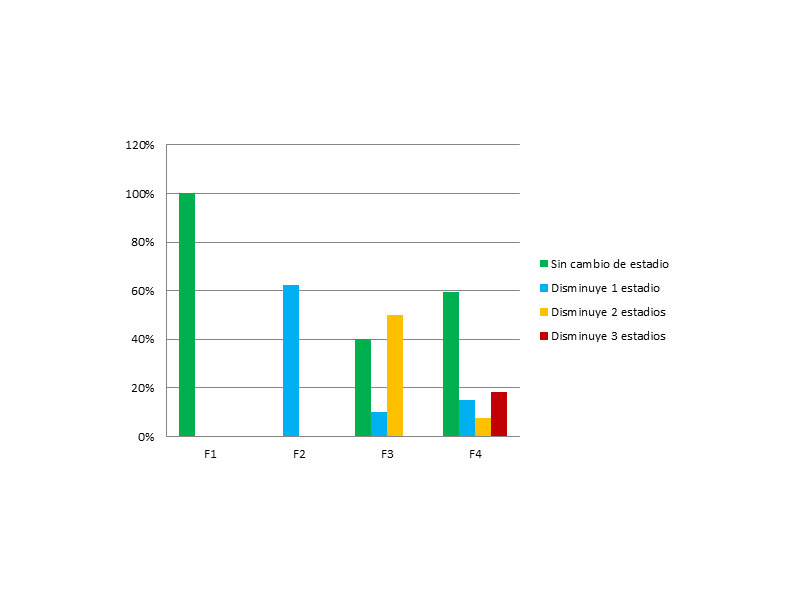
Si analizamos cuántos estadios se modifican en cada grupo, observamos que:
- En el estadio F1, 100% se mantienen.
- En el F2, el 62,5% (5 pacientes) disminuyen 1 estadio y un 37,5% aumentan.
- En el F3, el 10% (2 pacientes) disminuyen en 1 estadio y 10 pacientes, un 50%, disminuyen hasta la normalidad (2 estadios), mientras que un 40% se quedan en un F3 sin tampoco progresar.
- Mientras que en el estadio F4, 16 pacientes (59,3%) se queda en un F4, un 14,8% (4 pacientes) bajan 1 estadio, un 7,4% bajan 2 estadios y un 18,5% bajan hasta la normalidad.
Se obtuvieron diferencias estadísticamente significativas en la regresión de la fibrosis entre los diferentes grados previos de fibrosis (p<0.001), observándose que disminuyeron su fibrosis el 62,5% de los F2, el 60% de los F3 y el 40,7% de los pacientes con un grado previo F4. Por lo tanto, se confirma que un menor estadio de fibrosis previo a tratamiento, según estadiaje Metavir, favorece una mayor disminución de estadio. (Figura 3)
Figura 3: Número de estadios que disminuyen en cada una de las categorías de fibrosis previa al tratamiento.
Se analizó el comportamiento de los pacientes que, estando previamente en un estadio F4, tras el tratamiento, no cambiaron de estadio y su modificación de fibrosis fue una disminución media de 4,19 kPa.
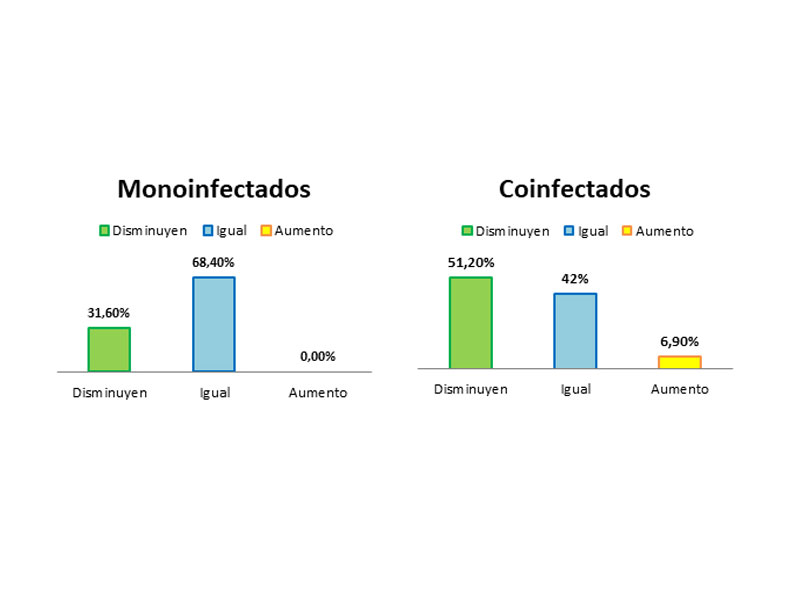
Respecto al análisis según la coinfección o no con VIH, observamos que en el grupo de los monoinfectados (VHC) el 31,6% de los pacientes disminuyeron de estadio Metavir y se quedaron en el mismo estadio el 68,4%; mientras que entre los coinfectados con VIH disminuyeron un 51,2%. Se quedaron en el mismo estadio un 41,9% (Figura 4). La asociación estadística entre la coinfección y la modificación de la fibrosis no fue significativa (p=0,713) lo cual indica que en este caso, las diferencias no se pueden atribuir al estado de coinfección de los pacientes.
Figura 4: Diferencias en la modificación de la fibrosis entre monoinfectados (VHC) y coinfectados (VIH/VHC).
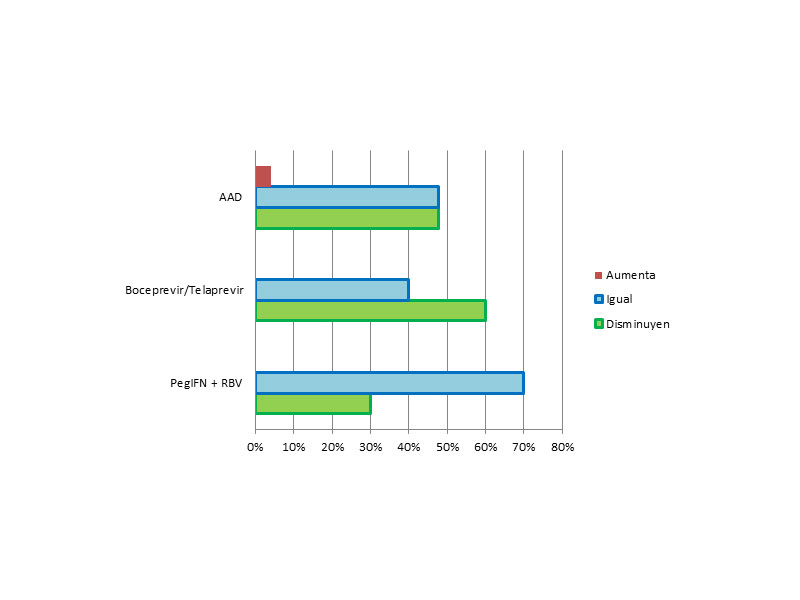
Según el tratamiento recibido, observamos que entre los tratados con la pauta de PegIFN + RBV disminuyen su fibrosis el 30% de los pacientes y otro 70% permaneció en el mismo estadio. Entre los tratados con Boceprevir/Telaprevir + Peg INF el 40% permaneció en su estadio y 60% lo disminuyo. Mientras que los tratados con los nuevos AAD disminuyeron el 47,8%, y permanecieron en el mismo estadio el 47,8% (Figura 5).
En nuestro estudio, no vimos asociación significativa, entre los tres tipos de tratamiento y la modificación de la fibrosis (p=0,445)
Figura 5: Modificaciones en la fibrosis según los diferentes grupos de tratamiento.
DISCUSIÓN
En un análisis general, se observa que un 69,35% de los pacientes que alcanzan la RVS son capaces de disminuir su grado de fibrosis con una media de 9,45 kPa, sin embargo esta cifra es más baja si analizamos la disminución por estadios Metavir, donde disminuyen el 45,2% de los pacientes, con una media de 1,78 estadios de bajada. Tres fueron, sin embargo, los pacientes que aumentaron de estadio.
Por otro lado, el análisis que cuantifica el número de estadios en los que se modifica la regresión de la fibrosis revela que el 50% no modifica el estadio Metavir. Entre estos pacientes que no cambian de estadio, la disminución de la fibrosis media es de 2,23 kPa, lo cual indica que estos pacientes tienen una tendencia a reducir la fibrosis aunque no cambien su estadio.
Es importante señalar que los estadios en los que se divide la escala Metavir son irregulares en rango, en especial el estadio F4, que ocupa desde 14,6 kPa hasta 75. Por ello en nuestro análisis incluimos el cálculo de la modificación media de los pacientes que se mantuvieron en el estadio F4 y observamos que la tendencia es una disminución media de 4,1 kPa. Lo que es relevante aunque no cambien de estadio. Estudios como el de Macías et al. sugieren que la relación entre los pequeños cambios de estos valores de rigidez hepática y el desenlace clínico debería ser estudiada (13) ya que valores bajos de rigidez hepática medidos por elastometría transitoria se correlacionan con valores de presión portal también más bajos (14) y, por tanto, con menor probabilidad de tener varices esofágicas (15) junto con una menor tasa de presentar eventos adversos hepáticos como hemorragias o ascitis (16). Este dato tiene implicación pronóstica, de manera que, por ejemplo, en pacientes con medidas de elastometría por encima de 21 kPa, está indicado realizar una endoscopia digestiva alta para descartar la presencia de varices esofágicas, mientras que en los pacientes con menos de 21 kPa no está indicado, con lo que, aunque no se modifique el estadio (en ambas situaciones hay un estadio F4), estos cambios pueden modificar el manejo del paciente. Además, en un estudio reciente Petta S. et al., han observado que alcanzar RVS en pacientes con HCVHC se asocia a una disminución de la progresión de la enfermedad hepática, de manera que en la evolución de estos pacientes no aumenta el riesgo de aparición de varices esofágicas, descompensaciones hepáticas, ni tampoco hepatocarcinoma, al contrario de lo que sucedería si se dejase evolucionar la HCVHC (17).Todo esto, invita a estudiar si los valores de presión portal de estos pacientes, que antes de conseguir la RVS tenían un grado de fibrosis avanzado, disminuyen de forma proporcional a la disminución de su fibrosis.
La literatura indica que la severidad de la enfermedad hepática es un conocido factor negativo en cuanto a la respuesta a los antivirales, y, que de igual manera, la disminución de la fibrosis puede ser menos probable en pacientes con enfermedad más avanzada o con una cirrosis ya establecida. En nuestro estudio observamos que el grupo que más disminuye su fibrosis en estadios es el grupo de los pacientes que previamente tenían un estadio F2, mientras que los que estaban en estadios F3 y F4 disminuyen también, pero en un porcentaje menor, al igual que está descrito en la literatura (18). Aun así, en un porcentaje importante de casos, (un 10% de los F3 y un 25,9% de los F4) que previamente tenían una fibrosis hepática significativa, consiguen descender su fibrosis hasta F2. Esto es relevante porque, con ello, disminuyen el riesgo de sufrir complicaciones derivadas de la fibrosis hepática excepto el hepatocarcinoma en aquellos pacientes con F3-F4 en los que sigue apareciendo.
Se encontró asociación estadisticamente significativa (p<0,001) entre el grado de fibrosis previo y la variación de ésta. Dado que nuestro período medio de seguimiento fue de 11 meses, probablemente hubiera sido necesario un período de seguimiento mayor para observar mayor reducción tanto en estadios como en kPa, debido a que algunos estudios sugieren que en este proceso de reducción fibrosa, primero ocurre una reducción en la inflamación y después sigue de un largo período de disminución de la fibrosis (19) y que, por ello, esta reducción fibrosa es dependiente del tiempo y el seguimiento, para ver estas diferencias, necesita ser más largo. En el estudio de Crissien et al. se comunicó que era necesario un tiempo medio de seguimiento de la fibrosis de 2,5 años en pacientes con fibrosis avanzada y de 3 años en aquellos que ya tuvieran cirrosis de base para observar esa mejoría (20). Por ello, pensamos que sería interesante diseñar un estudio en el que el período de seguimiento fuese más extenso y así poder evaluar también a aquellos en cuyo proceso se demore la disminución de la fibrosis.
La asociación entre la coinfección con VIH y una menor disminución de la fibrosis no fue significativa, aunque en la literatura algunos estudios sugieren que la coinfección está relacionada con una menor probabilidad de reducción de la fibrosis y apuntan que en ello influyen factores inmunitarios, como la depleción de linfocitos CD4 o una terapia antirretroviral inefectiva, lo que conduce específicamente a un aumento de episodios de descompensación hepática en pacientes coinfectados en comparación con los pacientes monoinfectados (21).
Un área futura de investigación es conocer si la reducción de la fibrosis con los AAD es mayor o más rápida que con las antiguas pautas de PegIFN+ RBV. En principio, consideramos que no debería haber diferencias, ya que el efecto antifibrótico está asociado a la eliminación del virus y no a la terapia farmacológica. En cualquier caso, investigar el tema es complejo debido al problema ético que supone tratar con IFN a pacientes que alcanzarían resultados más eficaces y seguros tratados con AAD.
Como limitaciones en nuestro trabajo, está un seguimiento medio corto, así como un número de pacientes limitado y con subgrupos de tratamientos AAD heterogéneos que no han permitido compararlos entre sí.
Concluimos que de los pacientes tratados contra el VHC y que alcanzaron una RVS, el 69,35% han obtenido una disminución media de 9,45 kPa y el 45,2% ha disminuido, en al menos un estadio en la escala Metavir, con independencia del tratamiento usado, incluso cuando estos ya tenían una cirrosis (estadio F4) de base sin que se observaran diferencias entre monoinfectados y coinfectados.
Así mismo, se ha demostrado una asociación significativa entre el grado de fibrosis previo al tratamiento y la capacidad para disminuir la fibrosis, disminuyendo más estadíos los que tenían un menor estadio antes del tratamiento.
REFERENCIAS
- Wise M, Bialek S, Finelli L, Bell BP, Sorvillo F. Changing trends in hepatitis C-related mortality in the United States, 1995-2004. Hepatology. 2008;47(4):1128-35.10.1002/hep.22165
- Alter MJ. Epidemiology of viral hepatitis and HIV co-infection. J Hepatol. 2006;44(1 Suppl):S6-9.10.1016/j.jhep.2005.11.004
- Puoti M, Moioli MC, Travi G, Rossotti R. The burden of liver disease in human immunodeficiency virus-infected patients. Semin Liver Dis. 2012;32(2):103-13.10.1055/s-0032-1316473
- Benhamou Y, Bochet M, Di Martino V, Charlotte F, Azria F, Coutellier A, et al. Liver fibrosis progression in human immunodeficiency virus and hepatitis C virus coinfected patients. The Multivirc Group. Hepatology. 1999;30(4):1054-8.10.1002/hep.510300409
- Graham CS, Baden LR, Yu E, Mrus JM, Carnie J, Heeren T, et al. Influence of human immunodeficiency virus infection on the course of hepatitis C virus infection: a meta-analysis. Clin Infect Dis. 2001;33(4):562-9.10.1086/321909
- Berenguer J, Alvarez-Pellicer J, Carrero A, Von Wichmann MA, Lopez-Aldeguer J, Mallolas J, et al. Clinical effects of viral relapse after interferon plus ribavirin in patients co-infected with human immunodeficiency virus and hepatitis C virus. J Hepatol. 2013;58(6):1104-12.10.1016/j.jhep.2013.01.042
- Lissen E, Clumeck N, Sola R, Mendes-Correa M, Montaner J, Nelson M, et al. Histological response to pegIFNalpha-2a (40KD) plus ribavirin in HIV-hepatitis C virus co-infection. AIDS. 2006;20(17):2175-81.10.1097/01.aids.0000247584.46567.64
- Bruno S, Battezzati PM, Bellati G, Manzin A, Maggioni M, Crosignani A, et al. Long-term beneficial effects in sustained responders to interferon-alfa therapy for chronic hepatitis C. J Hepatol. 2001;34(5):748-55.http://dx.doi.org/10.1016/S0168-8278(01)00062-9
- Mallet V, Gilgenkrantz H, Serpaggi J, Verkarre V, Vallet-Pichard A, Fontaine H, et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med. 2008;149(6):399-403.10.7326/0003-4819-149-6-200809160-00006
- Forns X, Ampurdanes S, Llovet JM, Aponte J, Quinto L, Martinez-Bauer E, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology. 2002;36(4 Pt 1):986-92.10.1053/jhep.2002.36128
- Castera L, Forns X, Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol. 2008;48(5):835-47.10.1016/j.jhep.2008.02.008
- Macias J, del Valle J, Rivero A, Mira JA, Camacho A, Merchante N, et al. Changes in liver stiffness in patients with chronic hepatitis C with and without HIV co-infection treated with pegylated interferon plus ribavirin. J Antimicrob Chemother. 2010;65(10):2204-11.10.1093/jac/dkq272
- Macias J, Rivero A, Cifuentes C, Camacho A, Neukam K, Rivero-Juarez A, et al. Sustained virological response to pegylated interferon plus ribavirin leads to normalization of liver stiffness in hepatitis C virus-infected patients. Enferm Infecc Microbiol Clin. 2013;31(7):424-9.10.1016/j.eimc.2012.12.004
- Vizzutti F, Arena U, Romanelli RG, Rega L, Foschi M, Colagrande S, et al. Liver stiffness measurement predicts severe portal hypertension in patients with HCV-related cirrhosis. Hepatology. 2007;45(5):1290-7.10.1002/hep.21665
- Pineda JA, Recio E, Camacho A, Macias J, Almodovar C, Gonzalez-Serrano M, et al. Liver stiffness as a predictor of esophageal varices requiring therapy in HIV/hepatitis C virus-coinfected patients with cirrhosis. J Acquir Immune Defic Syndr. 2009;51(4):445-9.10.1097/QAI.0b013e3181acb675
- Robic MA, Procopet B, Metivier S, Peron JM, Selves J, Vinel JP, et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol. 2011;55(5):1017-24.10.1016/j.jhep.2011.01.051
- Petta S, Di Marco V, Bruno S, Enea M, Calvaruso V, Boccaccio V, et al. Impact of virus eradication in patients with compensated hepatitis C virus-related cirrhosis: competing risks and multistate model. Liver Int. 2016;36(12):1765-73.10.1111/liv.13156
- Akhtar E, Manne V, Saab S. Cirrhosis regression in hepatitis C patients with sustained virological response after antiviral therapy: a meta-analysis. Liver Int. 2015;35(1):30-6.10.1111/liv.12576
- Casado JL, Quereda C, Moreno A, Perez-Elias MJ, Marti-Belda P, Moreno S. Regression of liver fibrosis is progressive after sustained virological response to HCV therapy in patients with hepatitis C and HIV coinfection. J Viral Hepat. 2013;20(12):829-37.10.1111/jvh.12108
- Highleyman L. Liver fibrosis improves after successful treatment for hepatitis C 2015 [Available from: http://www.aidsmap.com/Liver-fibrosis-improves-after-successful-treatment-for-hepatitis-C/page/3015981/.
- Mandorfer M, Schwabl P, Steiner S, Reiberger T, Peck-Radosavljevic M. Advances in the management of HIV/HCV coinfection. Hepatol Int. 2016;10(3):424-35.10.1007/s12072-015-9691-4
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Miguel Sola García. Complejo Hospitalario de Jaén. Misola1989@hotmail.es