Original
Anticoagulación en pacientes con sepsis. Fisiopatología y dificultades más comunes
Anticoagulation in patients with sepsis. Pathophysiology and common pitfalls
Actual. Med. 2020; 105 : (810): 108-113 DOI: 10.15568/am.2020.810.or05
Enviado: 17-06-2020
Revisado: 05-07-2020
Aceptado: 09-08-2020
Resumen
Diversos estudios publicados en los últimos años resaltan la importancia de la interacción entre los mecanismos inflamatorios y los de coagulación en pacientes sépticos. Anticoagular a este tipo de pacientes puede suponer un reto por sus comorbilidades de base y el propio estado proinflamatorio de la sepsis.
En esta revisión analizamos la influencia que presentan el estado de sepsis en sí mismo y las comorbilidades de los pacientes (especialmente la insuficiencia renal) a la hora de anticoagular, cuál es la forma más correcta de estratificarlos y las estrategias terapéuticas y de monitorización más adecuadas.
Palabras clave: Tromboprofilaxis; Sepsis; Anti-Xa; Complicaciones Tromboembólicas; Complicaciones hemorrágicas.
Abstract
Several studies published in recent years highlight the importance of the interaction between inflammatory and coagulation mechanisms in septic patients. Anticoagulation can be a challenge in those patients for their basic comorbidities and the pro-inflammatory state of sepsis itself. In this review we analyze the influence of sepsis status and the comorbidities of patients (especially renal impairment), when anticoagulate those patients, the correct way to stratify them and the appropriate therapeutic and monitoring strategies.
Keywords: Thromboprophylaxis; sepsis; Anti-Xa; Thromboembolic events; Hemorrhagic complications.
Leer Artículo Completo
1. INTRODUCCIÓN
En los últimos años se ha acentuado el interés sobre la interrelación entre sepsis y coagulación. La potenciación de la vía procoagulante inducida por patógenos e inhibición de mecanismos anticoagulantes facilitan el depósito de fibrina en los vasos y los fenómenos trombóticos.1
La anticoagulación en estos pacientes puede ser compleja por su el proceso séptico, comorbilidades o situaciones intrínsecas de base (insuficiencia renal, cáncer, delgadez o sobrepeso, embarazo…).2
En la presente revisión nos centramos en cómo repercuten la sepsis y la inflamación asociada en los mecanismos de coagulación, el efecto modulador que pueden ejercer las heparinas de bajo peso molecular (HBPM) sobre la inflamación asociada a la sepsis y la influencia de la insuficiencia renal por ser esta una de las comorbilidades que más frecuentemente nos encontramos en la práctica clínica.
2. ANTICOAGULACIÓN EN PACIENTES CON SEPSIS.
2.1 Influencia de la sepsis sobre los mecanismos de coagulación y fibrinolisis
En 1856, Virchow postuló la triada de elementos que conducían a la génesis de la trombosis: daño de la pared de los vasos sanguíneos, alteración del flujo e hipercoagulabilidad de la sangre.3
Los pacientes ingresados por patologías agudas con afectación directa o indirecta del endotelio, como síndrome coronario agudo, fallo respiratorio o infección aguda presentan un riesgo tromboembólico similar al de los pacientes quirúrgicos. Ese riego se incrementa por factores previos tales como edad avanzada, reposo en cama o enfermedad tromboembólica venosa (ETEV). La tromboprofilaxis es eficaz a la hora de reducirlo tanto en pacientes quirúrgicos como no quirúrgicos. Es posible emplear tanto métodos físicos como anticoagulantes orales o parenterales en función del riesgo estratificado de cada paciente. 3
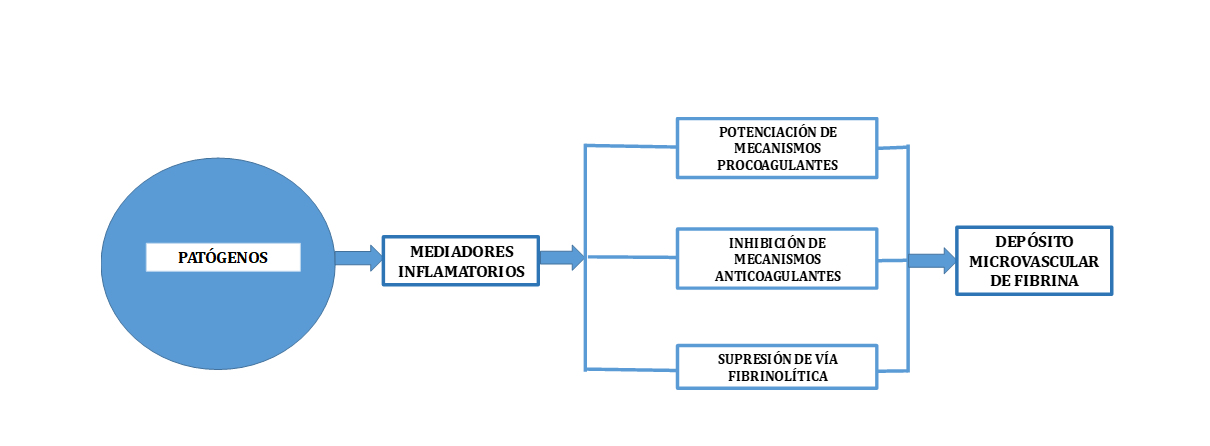
En pacientes sépticos se debe prestar atención a la profilaxis tromboembólica. A pesar de los avances en antibioterapia eficaz y temprana, fluidoterapia y control de iones y glucosa en sangre, estos pacientes siguen presentando una alta tasa de mortalidad en la UCI. Entre los factores esenciales de su desarrollo se incluyen la liberación de mediadores proinflamatorios, daño endotelial difuso y reacciones procoagulantes, facilitándose así el desarrollo del mecanismo de inflamación y la coagulopatía inducida por sepsis (sepsis-induced coagulopathy, SIC).4,5 Los patógenos y su respuesta inflamatoria asociada durante el proceso infecccioso llevan a la formación de fibrina y su depósito mediante varios mecanismos simultáneos6 tal como se expone en la figura 1:
- Potenciación de la vía procoagulante. Las células endoteliales, los macrófagos y los monocitos expresan más factor tisular en respuesta al estímulo proveniente de los patógenos; estas células proporcionan además una superficie sobre la que iniciarse y propagarse el mecanismo de coagulación, llevando a la formación de fibrina. A esto se une la liberación extracelular de factor tisular por parte de los NETs, amplificando la respuesta procoagulante ante el estímulo patogénico.
- Inhibición de los mecanismos anticoagulantes naturales. En condiciones fisiológicas, las células endoteliales expresan varios componentes implicados en los mecanismos anticoagulantes regulatorios, incluyendo trombomodulina, receptor endotelial de proteína C, proteína S, inhibidor del factor tisular y los proteoglicanos de heparán sulfato. El endotelio tiene un papel fundamental en la organización tanto de la respuesta procoagulante y anticoagulante como frente a la sepsis. Es el objetivo tanto de patógenos como de mediadores inflamatorios, conllevando una disminución tanto de la proteína C como de otros mediadores implicados en la anticoagulación natural, inhibiéndose ésta y favoreciéndose el depósito de fibrina.
- Inhibición de la fibrinolisis. In vitro, numerosos estudios realizados con cultivos de células endoteliales expuestas a estímulos inflamatorios y modelos animales de endotoxemia o sepsis han mostrado la presencia de valores elevados de inhibidores del activador del plasminógeno (PAI-1) y una menor producción de activador del plasminógeno tisular (t-PA), con una ganancia neta de PAI-1 que lleva al depósito de fibrina en el tejido vascular.
Figura 1. Mecanismos que contribuyen a la formación de trombina y depósito de fibrina en la microcirculación. Extraída y modificada de Semeraro N; Ammollo CT; Semeraro F; Colucci M. (2011). Sepsis, thrombosis and organ dysfunction. Thrombosis Research. 129: 290-295.
Algunos estudios sugieren que unas estructuras conocidas como “neutrophil extracellular traps” (NETSs) son una de las claves de la activación de la coagulación durante la sepsis. Los NETs producen liberación extracelular de factor tisular y activan el factor XII y las plaquetas.1
Todo lo anterior se traduce en un sistema fibrinolítico menos activos que el de coagulación, depositándose fibrina en la microcirculación y consumiéndose plaquetas y factores de coagulación a un ritmo mayor que el de su síntesis.
2.2 Efecto modulador de las heparinas de bajo peso molecular sobre la inflamación y la anticoagulación.
Algunos autores postulan que la amplia interacción entre mecanismos de inflamación y coagulación contribuyen a la fisiopatología básica de la sepsis, por lo que los agentes que logran atenuar ambos consiguen facilitar la resolución de la propia sepsis.4
En diversos estudios realizados en animales y ensayos clínicos se ha sugerido que la heparina, tanto no fraccionada (HNF) como la HBPM, presenta actividad inmunomoduladora e inhibidora de la actividad del complemento y modulación de varias proteasas mediante el control de la activación de las plaquetas, reclutamiento de leucocitos, liberación de citokinas por estímulo del lipopolisacárido bacteriano,expresión de moléculas de adhesión y angiogénesis.4 Además, la heparina puede inhibir ciertas funciones específicas de los neutrófilos como la quimiotaxis y la generación de aniones superóxidos y puede reducir la migración de eosinófilos y la permeabilidad vascular.4
Las HBPM han mostrado ser tan eficientes y seguras como la HNF para profilaxis y tratamiento de la ETEV y tratamiento de enfermedades cardiovasculares agudas.7 Se ha observado que presentan menos riesgo de sangrado y mejores resultados en la profilaxis de pacientes sometidos a cirugía ortopédica y pacientes no quirúrgicos.7,8 Tienen una biodisponibilidad del 85% tras inyección subcutánea (mientras que la HNF presenta una biodisponibilidad entre el 15 y el 40% con variabilidad interindividual)8, una vida media más larga y una farmacocinética de eliminación lineal, lo que proporciona una farmacodinámica predecible, sin necesidad de monitorización continua mediante pruebas de coagulación para prever su eficacia y seguridad.9
2.3 Situaciones que incrementan la complejidad a la hora de indicar la terapia anticoagulante: insuficiencia renal
En determinadas situaciones como la insuficiencia renal, el infra o sobrepeso, el embarazo y la infancia, la farmacocinética de las HBPM es menos conocida y predecible. Su depuración se produce fundamentalmente por excreción renal mediante mecanismos no saturables, lo cual dificulta poder establecer una dosis segura a administrar tanto en profilaxis como en tratamiento en pacientes con insuficiencia renal. 10
Una de las complicaciones de los tratamientos anticoagulantes, más notoria en el caso de la sepsis, es el sangrado. Este riesgo se encuentra incrementado en los pacientes con función renal dañada, independientemente del anticoagulante empleado. Las causas de sangrado en pacientes con insuficiencia renal son multifactoriales y no del todo conocidas.11 En la mayoría de los ensayos clínicos se excluyen a los pacientes con insuficiencia renal severa (con un aclaramiento de creatinina inferior a 30 ml/min), por lo que se dispone de pocos datos acerca de su farmacodinamia, dosificación más adecuada y balance riesgo-beneficios de la anticoagulación en estos pacientes.
Existe controversia acerca de la necesidad de reducir sistemáticamente la dosis de HBPM o monitorizar la actividad anticoagulante mediante la determinación de los niveles de anti-Xa.
Reducir dicha dosis puede disminuir el riesgo de sangrado, pero al mismo tiempo puede hacer perder eficacia terapéutica.
La determinación de la actividad anti-Xa de cualquier HBPM es una medida farmacodinámica empleada como un parámetro farmacocinético.12 Dicha determinación puede no correlacionarse adecuadamente con las propiedades antitrombóticas de la HBPM que se esté estudiando ni con el riesgo de sangrado del paciente, ya que las heparinas poseen otros efectos al implicarse en la función plaquetaria y el mecanismo de inhibición de liberación de factor tisular por parte del endotelio.2,13
Sin embargo, al no poder emplear las pruebas de anticoagulación estándares como el TTPA para la monitorización de las HBPM, la determinación de anti- Xa es, tal vez, la más adecuada dentro de las disponibles en la actualidad.2
2.4 Estratificación del riesgo de complicaciones tromboembólicas y tromboprofilaxis
En la bibliografía consultada encontramos que la ETEV es la tercera enfermedad vascular más común, con una incidencia de 1/1000 en la edad media que se incrementa anualmente hasta representar un 1% en nonagerianos.14 Aproximadamente el 50% de todas las ETEV suelen darse en pacientes ingresados por una patología médica aguda o necesidad de cirugía. La ETEV adquirida en el hospital es prevenible y para ello contamos con diversas intervenciones, entre las que se incluyen medidas físicas y farmacológicas con anticoagulantes. 14
Tanto en la 9ª edición de la guía de la ACCP para la terapia antitrombótica y prevención de trombosis14 como en la Guía de la American Society of Hematology de 201815 se aconseja valorar el riesgo de sufrir complicaciones tromboembólicas usando la escala de Padua en pacientes clínicos ingresados, así como el riesgo de sufrir sangrado durante el ingreso recibiendo tratamiento anticoagulante.
La escala de Padua se emplea con pacientes médicos hospitalizados y, tal como se puede ver en la tabla 1, consta de 11 ítems con puntuaciones que van de 1 a 3 según el peso que tienen en el incremento de riesgo de trombosis. Una puntuación de 4 o más se considera de alto riesgo, con un incremento de hasta 30 veces de sufrir complicaciones tromboembólicas frente a los pacientes que han tenido un total de menos de 4 puntos.16
Tabla 1. Extraída y modificada de Barbar S, Noventa D, Rosetto V, Ferrari A, Brandolin B, Perlati M, De Bon E, Tormene D, Pagnan A, Prandoni A. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost.2010; 8: 2450-2457. ESCALA DE PADUA. El alto riego de ETV viene definida por una puntuación acumulada de 4 o más puntos.
A: Pacientes con metástasis y/o tratamiento quimioterápico o radioterápico en los 6 meses previos.
B: Descanso en la cama, levantándose únicamente para ir al baño, durante al menos 3 días.
C: Mutación de gen de la antitrombina, proteína C o S, factor V Leiden, gen G20210A, síndrome antifosfolípido.
2.5. Estratificación del riesgo de sangrado durante el ingreso hospitalario
En las guías clínicas y los artículos consultados para la presente revisión 5,7,9,14,15,16 se aconseja evaluar no sólo el riesgo de ETV a la hora de optar o no por tromboprofilaxis, sino realizar un balance de riesgos/beneficio de la posibilidad de sangrado del paciente en función de sus comorbilidades. En algunos estudios se menciona la escasez de profilaxis aun teniendo el paciente un alto riesgo de ETV por miedo al sangrado del paciente tras revisar sus patologías de base.16 En 2007 se llevó a cabo el estudio IMPROVE (International Medical Prevention Registry on Venous Thromboembolism), un estudio observacional multinacional en el que se revisaron las prácticas de tromboprofilaxis llevadas a cabo; se concluyó que el nivel de profilaxis era subóptimo y era preciso revisar las guías hospitalarias con nuevos datos basados en la evidencia para corregir esta situación. 17
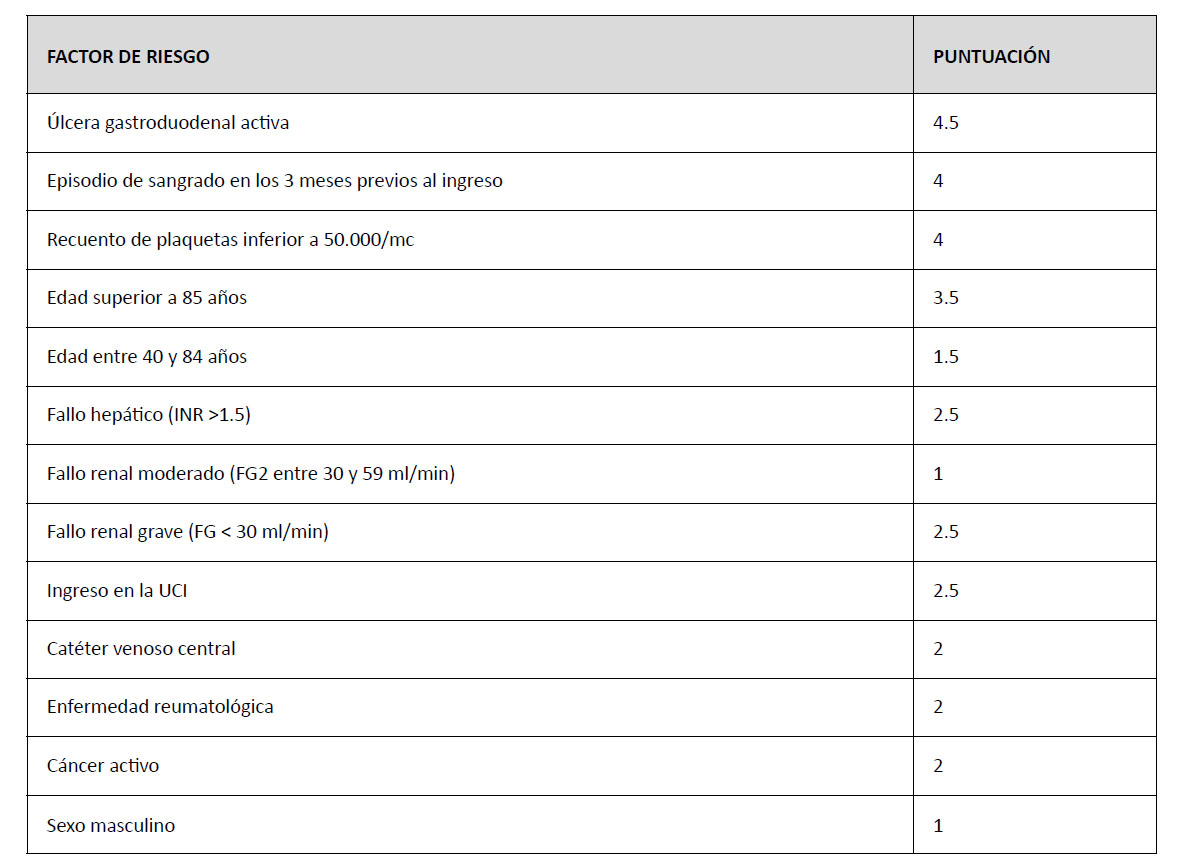
En un estudio realizado en 2011 a partir de los datos registrados en el IMPROVE se reseñaron una serie de factores de riesgo de sangrado en pacientes hospitalizados. Se observó que los factores de riesgo más potentes fueron la úlcera gastroduodenal activa, haber sangrado 3 meses antes del ingreso y un recuento de plaquetas inferior a 50.000/mc, seguido por una edad superior a 85 años, fallo hepático, fallo renal grave o estar ingresado en UCI.18 Estos factores mostraron ser buenos predictores independientes del riesgo de sangrado durante el ingreso y en la guía de la ACCP se aconsejó evaluar el riesgo de sangrado previamente a la administración de tromboprofilaxis de ETV. Se sugirió una escala, la Bleeding Risk Score (BRS) que fue validada externamente por primera vez en 2016.19
En la tabla 2 se pueden observar los ítems a tener en cuenta para valorar el riesgo de sangrado de los pacientes hospitalizados en el momento de ingreso. Cada ítem tiene una puntuación diferente en función de la influencia que se considera que tiene en la provocación de complicaciones hemorrágicas. Los autores del BRS indicaron que más de la mitad de los episodios de sangrado mayor en estos pacientes ingresados se daba en el 10% de los pacientes con 7 puntos o más.19
Tabla 2. Extraída y modificada de Hostler DC et al. Validation of the International Medical Prevention Registry on Venous Thromboembolism Bleeding Risk Score. Chest. 2016;149 (2). 372-379. BLEEDING RISK SCORE realizado a partir de los datos del IMPROVE: El alto riego de sangrado viene definido por una puntuación igual o superior a 7.
2.6 Influencia del proceso infeccioso-inflamatorio y la inmovilización en los mecanismos procoagulantes
Diversos autores han debatido la importancia de la inflamación asociada a la infección como factor independiente que incremente el riesgo de ETEV o la presencia de la inmovilización del paciente, secundaria a ese proceso infeccioso-inflamatorio como factor de confusión.
Algunos autores sostienen que la infección se correlaciona con un incremento transitorio del riesgo de ETEV, lo que les sugiere que podría desencadenar las complicaciones trombóticas por afectación directa del endotelio, activación de leucocitos o deshidratación. Ese incremento de riesgo podría ser genérico, sin estar ligado a ningún tipo concreto de infección ni al reposo en cama.20
Otros, sin embargo, sostienen que la infección podría contribuir a la patogénesis de la ETEV al favorecer el reposo en cama del paciente, sobre todo en caso de sepsis.21 El estasis venoso o las alteraciones en el flujo sanguíneo, según el modelo celular de la coagulación propuesto por Hoffman Maureane en 2003, inician la activación de las células endoteliales y, junto con plaquetas, neutrófilos y monocitos, favorece la propagación del trombo.22,23
Respecto a esta cuestión, en 2015 se realizó un análisis de 1635 pacientes del registro RIETE para intentar dilucidar la influencia de la infección como factor independiente o ligado a la inmovilización para ETEV. Se compararon pacientes aquejados de una infección con otros inmovilizados a causa de una demencia. Los autores observaron que los eventos trombóticos se daban con mayor frecuencia tras un corto periodo de inmovilización cuando se debían a una infección en comparación con pacientes cuya causa de encamamiento eran otras (por ejemplo, demencia). Los pacientes inmovilizados por infecciones respiratorias presentaban con mayor frecuencia embolismo pulmonar en comparación con otros pacientes con ETEV y otros tipos de infecciones recientes.21 Sin embargo, los autores de ese estudio advierten que por las características del registro RIETE, en el que todos los pacientes incluidos tienen ETEV documentada y la infección no está considerada como un factor de riesgo predefinido que se registre automáticamente, no pueden establecer con certeza que la infección se asocie de forma independiente a ETEV y, por tanto, sea posible apoyar los hallazgos que describen una relación patogenética entre infección y ETEV.
En el artículo anteriormente reseñado21 sus autores sostenían que, si la respuesta inflamatoria es severa y mantenida, se produce un depósito excesivo de fibrina y una activación incrementada de la cascada de coagulación que puede favorecer la formación de trombos de forma sistémica o localizada. Según ellos, se podrían considerar los procesos infecciosos-inflamatorios como un factor de riesgo independiente para el desarrollo de ETEV.
En otros artículos se incide en que los pacientes con daño pulmonar agudo o síndrome de distress respiratorio agudo podrían sufrir un aumento de la actividad procoagulante tras haber observado en el lavado broncoalveolar (BAL) niveles aumentados de factor tisular y del inhibidor del activador del plasminógeno 1 (PAI-1), contribuyendo así a la formación acelerada de más fibrina en los alveolos pulmonares y los vasos sanguíneos. Sin embargo, concluyen que esa acumulación de fibrina podría influir en la inflamación pulmonar y los mecanismos procoagulantes o, simplemente, ser un resultado del estado proinflamatorio que acompaña al daño pulmonar agudo, sin tener mayor relevancia. 24
Si se revisa la escala de Padua, se puede observar que padecer una infección aguda se incluye como factor de riesgo, pero con una baja puntuación, con lo que la indicación de tromboprofilaxis irá ligada a factores de riesgo adicionales. Del mismo modo, la inmovilización por sí sola es reconocida como un factor relevante, aunque no suficiente para iniciar un tratamiento preventivo de ETV.25
2.7. Cribado de tvp mediante ecodoppler y tromboprofilaxis
Las primeras dudas que surgen tras realizar una estratificación del riesgo de trombosis y de sangrado en un paciente son la conveniencia de realizar un cribado de casos de ETV mediante ecografía en el momento de ingreso, qué tipo de profilaxis aplicar, durante cuánto tiempo y cómo ajustar ésta a las características basales del paciente en el momento de la hospitalización.
En la 9ª edición de la guía de la ACCP (Prevention of VTE in nonsurgical patients)15 se indica que el cribado mediante ecografía en pacientes clínicos no ha sido estudiado de forma sistemática. La evidencia indirecta que se dispone de pacientes del área de Traumatología o con daño medular sugiere que el cribado rutinario no resulta beneficioso a la hora de reducir el número de ETEV sintomática, corriéndose el riesgo de muchos falsos positivos y tratamiento innecesario de esos mismos pacientes.26
Ateniéndonos a la guía mencionada,15 la recomendación es que los pacientes ingresados con alto riesgo de trombosis según la escala de Padua reciban tromboprofilaxis farmacológica con HNF, HBPM o fondaparinux. La elección de un tipo u otro de anticoagulante dependerá de las características del paciente y facilidad de administración. Actualmente se suele optar por HBPM por su comodidad de aplicación y su coste-efectividad (grado de evidencia 1B). 15
Cuando el aclaramiento de creatinina desciende por debajo de 30 ml/min, entrando en insuficiencia renal severa, surgen las controversias acerca de la mejor manera de ajustar la profilaxis a este perfil de pacientes, la necesidad o no de cambiar de tipo de HBPM y si es útil monitorizar la actividad antitrombótica del tratamiento elegido. En los pacientes tratados con dosis repetidas de enoxaparina se observa una alta correlación entre el filtrado glomerular que presentan y la actividad anti – Xa, detectándose niveles muy elevados de actividad en aquéllos cuyo filtrado sea inferior a 30 ml/min. Respecto a las dosis profilácticas repetidas, también se aprecia un incremento de exposición al fármaco (en torno a un 35%) en pacientes con insuficiencia renal severa, siendo su farmacocinética menos conocida en esta situación. Esto mismo se comprueba en pacientes tratados con nadroparina o dalteparina e insuficiencia renal importante, no así con tinzaparina, que es la HBPM que muestra menor acúmulo de dosis en este subgrupo de pacientes por su menor peso molecular medio, demostrándose que no precisa ajuste de dosis en caso de filtrados glomerulares superiores a 20 ml/min. 10,27
En pacientes hospitalizados con bajo riesgo de trombosis según la escala de Padua, en la guía de la ACCP no se recomienda tromboprofilaxis farmacológica o mecánica (grado de evidencia 1B). En pacientes con sangrado activo o con alto riesgo de sangrado según el Bleeding Risk Score, se recomienda no utilizar tromboprofilaxis farmacológica (grado de evidencia 1B). En situaciones de alto riesgo de trombosis y sangrado o de sangrado mayor se sugiere el uso de tromboprofilaxis mecánica (grado de evidencia 2C) antes que no realizar profilaxis. No obstante, ésta suele ser mal tolerada por los pacientes y dar problemas cutáneos, sobre todo en ancianos con capilares frágiles o púrpura senil.
Cuando el riesgo de sangrado disminuya y si el alto riesgo de ETV persiste, se sugiere mantener la tromboprofilaxis mecánica frente a la farmacológica (grado de evidencia 2C)25. Si revisamos otras guías, como la de la American Society of Hematology (ASH), las recomendaciones son similares, además de no aconsejarse el uso combinado de profilaxis farmacológica y mecánica por no tener una relación riesgo/beneficio favorable para el paciente28.
No se recomienda mantener la profilaxis más allá del periodo de inmovilización en el hospital. 26,28
3. CONCLUSIONES
Tras la presente revisión, concluimos que:
- El estado proinflamatorio de las infecciones agudas, especialmente las sepsis, incide en el estado protrombótico del paciente, junto con el encamamiento forzoso durante los primeros días de ingreso por la propia enfermedad.
- Existe consenso en estratificar el riesgo de sufrir ETEV y sangrado en los pacientes clínicos ingresados con las escalas propuestas por las guías clínicas. La escala de Padua y el Bleeding Risk Score son escalas validadas en pacientes clínicos ingresados, ayudando a tomar mejores decisiones clínicas en función del resultado.
- La tromboprofilaxis se debe adaptar al perfil de cada paciente. Los autores de la bibliografía consultada coinciden en aconsejar el empleo de HBPM frente a otras medidas profilácticas tanto por posología como por vía de administración y su perfil de seguridad.
- Existe controversia sobre el uso de tromboprofilaxis mecánica, con grado de evidencia 2C. En situaciones de alto riesgo de trombosis y sangrado o de sangrado mayor se sugiere su uso antes que no realizar profilaxis
- La realización de niveles de anti-Xa es controvertida. Esta medida farmacodinámica no es representativa de las propiedades antitrombóticas de la HBPM estudiada. Las heparinas poseen otros efectos al implicarse en la función plaquetaria y el mecanismo de inhibición de liberación de factor tisular. Tampoco es representativa del riesgo de sangrado del paciente. Al no poder realizarse otras pruebas estándares de coagulación, es la más adecuada de las disponibles en el laboratorio.
REFERENCIAS BIBLIOGRÁFICAS
- ↑ Iba T, Gando S, Thachil J. Anticoagulant therapy for sepsis-associated disseminated intravascular coagulation: the view from Japan. J Thromb Haemost 2014; 12: 1010–9.
- ↑ Bernardo A. Pruebas básicas de coagulación. En Soto I, Álvarez MT. Hemostasia y Trombosis en la práctica clínica (1ª edición). Ergon, Majadahonda, Madrid, España.2018.
- ↑ Kyrle, PA; Eichinger, S. Deep vein thrombosis. Lancet.2005; 365: 1163-74.
- ↑ Li, X. Ma X. The role of heparin in sepsis: mucho more than just an anticoagulant. Br J Haematol. 2017; 179: 389-98.
- ↑ Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017; 7 Supl 9: e017046.
- ↑ Semeraro N; Ammollo CT; Semeraro F; Colucci M. Sepsis, thrombosis and organ dysfunction. Thrombosis Research. 2017; 129: 290-5.
- ↑ Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM, Lassen MR. Prevention of Venous Thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest.2008; 133: 381S-453S.
- ↑ Frydman A. Low-molecular-weight heparins: an overview of their pharmacodynamics, pharmacokinetics and metabolism in humans. Haemostasis. 1996; 26 Supl 2: 24-38.
- ↑ Boneu B, de Moerloose P. How and when to monitor a patient treated with low molecular weight heparin. Semin Thromb Hemost. 2001; 27: 519-22.
- ↑ Smichd P, Fischer AG, Wuillemin WA. Low-molecular-weight heparins in patients with renal insufficiency. Swiss Med Wkly. 2009; 139 :438–52
- ↑ Sohal AS, Gangji AS, Crowther MA, Treleaven D. Uremic bleeding: pathophysiology and clinical risk factors. Thromb Res.2006; 118: 417-22.
- ↑ Brophy DF, Carr ME, Martin EJ, Venitz J, Gehr TW. The pharmacokinetics of enoxaparin do not correlate with its pharmacodynamics effect in patients receiving dialysis therapies. J Clin Pharmacol. 2006; 46: 887-94.
- ↑ Olie R, Meertens N, Henskens Y, Cate H. Empirically reduced dosages of tinzaparin in patients with moderate-to-severe renal insufficiency lead to inadequate anti-Xa levels. Nephron. 2017; 137: 113-23.
- ↑ Holger J, Cushman M, Burnett AE, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and non hospitalized medical patients. Blood Adv. 2018; 22:3198-3225.
- ↑ Kahn SR, Lim W, Dunn AS, et al. Prevention of VTE in nonsurgical patients. Chest.2012; 141 Supl 2: e195s-226s.
- ↑ Barbar S, Noventa F, Rossetto V, et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost.2010: 8: 2450-57.
- ↑ Tapson VF, Decousus H, Pini M, et al. Venous thromboembolism prophylaxis in acutely ill hospitalized medical patients: findings from the International Medical Prevention Registry on Venous Thromboembolism. Chest. 2007; 132 Supl 3:936-45.
- ↑ Decousus H, Tapson VF, Bergmann JF, et al. Factors at admission associated with bleeding risk in medical patients: findings from the IMPROVE investigators. Chest. 2011; 101 Supl 1: 139-44.
- ↑ Hostler DC, Marx ES, Moores LK, et al. Validation of the International Medical Prevention Registry on Venous Thromboembolism Bleeding Risk Score. Chest. 2016; 149 Supl 2: 372-79.
- ↑ Smeeth L, Cook C, Thomas S, Hall AJ, Hubbard R, Vallance P. Risk of Deep vein thrombosis and pulmonary embolism after acute infection in a community setting. Lancet. 2006; 367: 1075- 79.
- ↑ Chen Y, Lin T, Huang W, Lin C, Dai M, Kao C. Association between pneumococcal pneumonia and venous thromboembolism in hospitalized patients: a nationwide population-based study. Respirology. 2015; 20: 799-804.
- ↑ Hoffman M. Remodeling the blood coagulation cascade. J Thromb Thrombolysis. 2003;16 (1-2):17-20.
- ↑ Mukhopadhyay S, Johnson TA, Duru N, et al. Fibrinolysis and Inflammation in Venous Thrombus Resolution. Front Immunol. 2019; 10:1348.
- ↑ Abraham E. Coagulation abnormalities in acute lung injury and sepsis. Am J Respire Cell Mol Biol. 2000; 22: 401-4.
- ↑Frasson S, Gussoni G, Di Micco P, et al. Infections as cause of immobility and occurrence of venous thromboembolism: anaylisis of 1635 medical cases from the RIETE registry. J Thromb Trombolysis.2015; 41 Supl 3: 404-12.
- ↑Kahn SR, Lim W, Dunn AS, et al. Prevention of VTE in nonsurgical patients. Antithrombotic therapy and prevention of trombosis. 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012; 141 Supl 2: 195S-226S.
- ↑ Nagge Jm, Crowter M, Hirsh J. Is impaired renal function a contraindication to the use of low-molecular-weight heparin? Arch Intern Med. 2002; 162: 2605- 09.
- ↑ Schünemann HJ, Cushman M, Burnett AE, et al.American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood. 2018; 2: 3198-3225.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: María Teresa Fábregas Ruano. Hospital Universitario Puerta del Mar. Servicio de Medicina Interna. Av. Ana de Viya, 21 · 11009 Cádiz. E-mail: mteresafabregasruano@gmail.com