Revisión
Endotelio corneal humano derivado de células madre mesenquimales. Revisión de la literatura
Mesenchymal stem cells differenciate to human corneal endothelium. A literature review of published data
Actual Med. 2021; 106(814): 280-290 DOI: 10.15568/am.2021.814.rev02
Recibido: 16/02/2021
Revisado: 26/02/2021
Aceptado: 08/04/2021
RESUMEN
Antecedentes y Objetivo: En la presente revisión se expondrán las principales fuentes de células madre mesenquimales utilizadas para la generación de endotelio corneal humano artificial o en sus usos como terapia regenerativa. Así mismo, los distintos modelos de diferenciación sugeridos por los autores a lo largo de la historia; los marcadores celulares o fisiológicos de los que se han servido para caracterizar las células diferenciadas y se describirá la potencialidad traslacional de dichas células a patologías del endotelio corneal mediante las técnicas de las que se han servido para su implantación o trasplante.
Material y métodos: Revisión narrativa de publicaciones de diferenciación de células madre mesenquimales a endotelio corneal humano o de otras aplicaciones de estas células como terapia regenerativa en modelos de daño endotelial corneal.
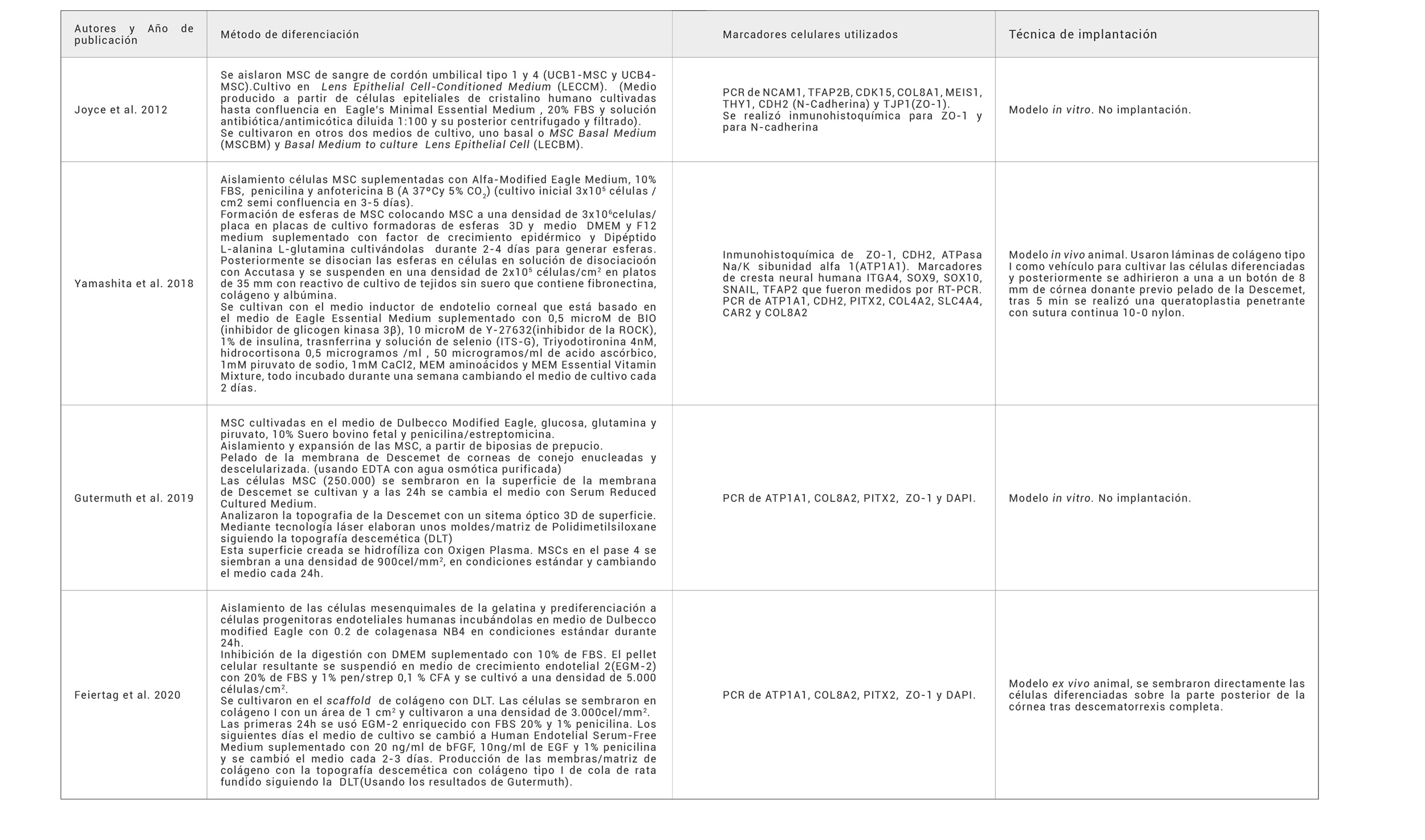
Resultados: Un total de seis trabajos utilizaron células madre mesenquimales en diferenciación o regeneración de endotelio corneal, de los cuales cuatro utilizaron células provenientes de cordón umbilical. En cuatro de estos estudios se diseñó un protocolo de diferenciación distinto. Los autores coincidieron en los marcadores de diferenciación ATP1A1, COL8A2, PITX2 y ZO-1.
Conclusiones: Si bien son pocos los ensayos clínicos publicados en materia de endotelio corneal humano que utilizan dichas células; el potencial de regeneración y de diferenciación de las MSC junto con el desarrollo que ha experimentado la Ingeniería Tisular, hace que se postulen como el futuro de la terapia sustitutiva.
Palabras clave: Células madre mesenquimales humanas; Endotelio corneal humano; Diferenciación; Ingeniería Tisular; Trasplante endotelial.
ABSTRACT
Background and purpose: The main sources of mesenchymal stem cells used for the creation of artificial corneal endothelium or their uses such as regenerative therapy will be exposed in this review. Moreover, the different models of differentiation suggested by authors throughout the history just as cellular or physiological markers which have been used to typify defined cells will be described. Finally, it will also be described the translational potential of these cells to corneal endothelium diseases through the techniques which have been used to its implantation or transplant.
Material and methods: Narrative review of publications on the differentiation of mesenchymal stem cells to human corneal endothelium or other applications of these cells as regenerative therapy in models of corneal endothelial damage.
Results: A total of six studies used mesenchymal stem cells in differentiation or regeneration of corneal endothelium, of which four used cells from the umbilical cord. In four of these studies a different differentiation protocol was designed. The authors agreed on the differentiation markers ATP1A1, COL8A2, PITX2 and ZO-1.
Conclusions: Although there are few published clinical trials on human corneal endothelium that use these cells; The regeneration and differentiation potential of MSCs and the development that Tissue Engineering has undergone, makes them postulate as the future of replacement therapy.
Keywords: Mesenchymal Stem Cells; Human Corneal endothelium; differentiation; Tissue Engineering; Endothelial trasplant.
Leer Artículo Completo
INTRODUCCIÓN
Las células madre mesenquimales (MSC) son un grupo de células madre multipotentes de origen mesenquimal. La multipotencialidad de estas células fue demostrada por Friedenstein en 1979 a partir del uso de células provenientes de la médula ósea (1). Además de los primeros hallazgos de Friedenstein con células de la medula ósea, numerosos estudios han demostrado la multipotencialidad de las MSC. Hasta la fecha han sido aisladas de diversos tejidos, incluyendo el hueso trabecular, tejido adiposo, medula ósea, tejido sinovial, dermis, ligamento periodontal, pulpa dental y el cordón umbilical (2, 3, 4). Debido a su gran capacidad de diferenciación y a la gran variedad de marcadores de superficie presentes en las MSC, múltiples discrepancias fueron inicialmente elucidadas por diferentes grupos de investigación en el uso de MSC entre ellos el grupo de Tropel et al. o el grupo de Baksh et al (5,6). Por tanto, en 2016 la Sociedad Internacional de Terapia Celular sugirió una serie de criterios mínimos para la utilización de MSC. Dentro de esos criterios mínimos, se incluyó la capacidad de adherirse a la superficie de cultivo, la presencia de un perfil de marcadores celulares determinado y la capacidad de diferenciarse en tres estirpes; adipocitos, osteocitos y condrocitos in vitro (7).
Los nuevos avances en Ingeniería Tisular han hecho posible su traslación a la medicina experimental y en concreto a la oftalmología y a la patología corneal. La córnea humana es el órgano más trasplantado en el mundo, con indicaciones de trasplante para patologías muy diversas y que varían dependiendo en qué lugar del mundo nos hallemos; siendo en los países desarrollados la indicación más frecuente en las enfermedades que afectan al endotelio corneal (8,9).
El endotelio corneal consiste en una monocapa de células poligonales con un espesor aproximado de 4µm. En el adulto presenta una densidad aproximada de 3.000 células/mm2 y un 75% de células hexagonales, estas cifras varían desde el nacimiento con una pérdida de densidad de 0,6% por año (1). Para preservar la transparencia corneal se necesita una densidad celular por encima de 400-500 células/mm2, aunque densidades en torno a 1.000 celulas/mm2 como en la Distrofia de Fuch, ya producen alteración en su función (2). Las células endoteliales están unidas por uniones gap y estrechas, mientras que se unen a la membrana de Descemet por hemidesmosomas. Una característica importante de las células endoteliales es su inhabilidad de regeneración in vivo, que las hace incapaces de remplazar células dañadas o muertas. Esto se debe a que permanecen en fase G1 del ciclo celular, reaccionando ante el daño endotelial mediante cambios celulares morfológicos (pleomorfismo) y aumento del tamaño (polimegatismo), alterando la función del endotelio (3,4).
Las patologías más comunes que implican al endotelio corneal son la Distrofia de Fuch y la queratopatía bullosa, normalmente derivada de una intervenciónn de cataratas (Queratopatía bullosa Pseudofáquica). Actualmente, la queratoplastia es el principal tratamiento de enfermedades corneales que afectan al endotelio (9,10). Los progresivos avances en el campo tecnológico junto con la búsqueda del mejor resultado refractivo han permitido el desarrollo de nuevas técnicas de trasplante cornea de espesor incompleto o lamelares. Entre ellas una de los procedimientos más utilizados en la actualidad la queratoplastia endotelial automatizada con pelado de membrana de Descemet (DSAEK) (11). La queratoplastia endotelial de membrana de Descemet (DMEK) representa por su parte la modalidad de trasplante más novedosa y la técnica de elección en países desarrollados ante una alteración endotelial corneal. A pesar de los prometedores resultados; este procedimiento tiene grandes dificultades técnicas además de la complejidad quirúrgica, como son la tasa de desprendimiento del injerto (menor en la técnica DSAEK), la pérdida progresiva de células o el factor cirujano dependiente (12, 13, 14). Es aquí donde la Ingeniería Tisular intenta encontrar su nicho mediante diferentes técnicas de aislamiento, cultivo o diferenciación de MSC a células endoteliales y su posterior traslación clínica como una alternativa a la queratoplastia (15).
El objetivo de la presente revisión bibliográfica es identificar las principales fuentes de MSC utilizadas para la generación de endotelio corneal humano artificial, sus características, sistemas de diferenciación y potencialidad traslacional en patologías del endotelio corneal.
SÍNTESIS DE LA REVISIÓN
Material y métodos
Para esta revisión, se realizó una búsqueda bibliográfica en las principales bases de datos y plataformas: MEDLINE, Embase, Dimensions, Web of Science, SciELO, Research Gate y Google Scholar.
Se utilizaron los siguientes términos en inglés para ampliar los potenciales resultados: «corneal endothelium», «corneal endothelial», «human mesenchymal stem cells», «differentiation», «regeneration» y «Tissue Engineering»; y se usaron los operadores booleanos «OR» y «AND», de forma que la principal estrategia de búsqueda fue la siguiente «(corneal endothelium OR corneal endothelial) AND (human mesenchymal stem cells) AND(differentiation OR regeneration OR Tissue Engineering)».
De los estudios encontrados se obtuvieron los siguientes datos, siempre que estos eran susceptibles de ser extraídos: El tipo de célula madre mesenquimal dependiendo de la fuente de obtención; el método o protocolo de diferenciación hacia endotelio corneal humano; marcadores celulares o fisiológicos de diferenciación a endotelio utilizados en su análisis; y finalmente las técnicas de implantación o trasplante de las células si se utilizara un modelo in vivo o in vitro.
MSC utilizadas para la generación de endotelio corneal humano
La primera evidencia de uso de MSC en endotelio corneal se llevó a cabo en 2007 por Liu y colaboradores, usando MSC autólogas provenientes de médula ósea en un modelo in vivo en conejos (20). Pasarían unos años hasta que en 2012 el grupo de Joyce realizó el primer experimento con MSC humanas en un modelo ex vivo, en este caso provenientes de sangre de cordón umbilical tipo 1 y 4 (Según la clasificación fenotípica de MSC derivadas de sangre de cordón umbilical que estableció Markov y colaboradores años antes (21)). La utilización de células del cordón umbilical tal y como propone Joyce, muestra numerosas ventajas, principalmente en términos de aislamiento con respecto a la obtención de otras fuentes celulares de MSC. Una de las mayores ventajas es la ausencia de limitaciones éticas con respecto al uso de células madre embrionarias. Además, destaca su gran potencial de diferenciación con respecto a otras fuentes celulares, como por ejemplo, las MSC provenientes de médula ósea (22).
Estudios de Shao y colaboradores en 2015 retomaron la idea de utilizar MSC humanas procedentes de sangre del cordón umbilical, pero en este caso con progenitores endoteliales en un ensayo in vitro e in vivo en modelo animal. En este estudio realizaron un denudado de la membrana de Descemet (Descetmarorrexis) de conejos y consecutivamente inyectaron en la cámara anterior las MSC con nanoparticulas inmunomagnéticas CD34(23). Posteriormente el grupo de Yamashita utilizó de nuevo en 2018 MSC derivadas del estroma del cordón umbilical, en un estudio con un protocolo de diferenciación a endotelio corneal (24). Más recientemente, experimentos publicados en 2020 de Feiertag y colaboradores se decantan por las MSC derivadas de la gelatina de Wharton de cordón umbilical también en un experimento de diferenciación a endotelio corneal in vitro (25).
Por otra parte, el grupo de Gutermuth utilizó MSC humanas derivadas de biopsias de prepucio en 2019, publicando un experimento de diferenciación a endotelio corneal humano usando un nuevo modelo de diferenciación, que será utilizado por otros investigadores como Feiertag posteriormente (26) (Tabla1).
Tabla 1. Tipos de MSC usadas en endotelio corneal.
Técnicas de diferenciación de MSC a endotelio corneal humano
El endotelio corneal humano es un tejido que, aunque posee una estructura simple sus características anatomofisiológicas han hecho de él un reto de Ingeniería Tisular. Muchos son los estudios que se han desarrollado en materia de cultivo y expansión de endotelio corneal, tanto en técnicas de aislamiento como diferentes factores de cultivo como el medio de cultivo basal, aditivos y métodos de modulación (27,28,29,30).
La mayor parte de la evidencia que existe en diferenciación de células madre a endotelio corneal se ha realizado con células madre embrionarias (ES) y células madre pluripotentes inducidas (iPS). Si bien los experimentos realizados difieren entre sí por la pluralidad y falta de uniformidad en los materiales y métodos; sí que tienen una vía común que intenta imitar el desarrollo embrionario del endotelio. Para ello se realiza una primera derivación a células de la cresta neural y de este punto de partida se derivaría a endotelio corneal (31).
Del mismo modo, la mayoría de los experimentos publicados sobre regeneración o diferenciación de MSC a tejido corneal se han centrado en las capas del epitelio y estroma corneal y sus patologías asociadas; siendo minoritario el trabajo en materia de endotelio corneal (32).
No es hasta 2012, con los hallazgos de Joyce e investigadores, que se demostró la capacidad de las MSC humanas de ser diferenciadas hacia endotelio corneal. En este caso, utilizaron MSC de sangre de cordón umbilical tipo 1 y 4 (UCB1-MSC y UCB4- MSC), las cuales fueron cultivadas en el llamado Lens Epithelial Cell-Conditioned Medium (LECCM), (Medio producido a partir de células epiteliales de cristalino humano cultivadas en Eagle’s Minimal Essential Medium y FBS y su posterior filtrado). Así intentaban mimetizar la posible influencia del cristalino durante el desarrollo embrionario del endotelio corneal. Igualmente, se cultivaron en otros dos medios de cultivo, uno basal o MSC Basal Medium (MSCBM) y Basal Medium to culture Lens Epithelial Cell (LECBM). En primer lugar, se observó la morfología que adquirían en los diferentes medios de cultivo y se realizó un análisis de marcadores “específicos” de endotelio, como las uniones estrechas Zonula Occludens-1 (ZO-1) y un análisis microarray de 250 genes para comparar los cultivos de los dos medios con el medio basal. Por último, realizaron un modelo de daño endotelial ex vivo para ver la capacidad de reparación de estas células mesenquimales. En concreto, se observó que la distribución de marcadores endoteliales se situaba en el citoplasma en el medio de cultivo basal, mientras que los cultivos en medios influenciados por el cristalino, las expresaban en la periferia, como las células endoteliales corneales humanas. Así mismo, la morfología de las MSC se alteró consistentemente en la presencia de LECCM y se obtuvo un perfil genético más próximo al endotelio corneal. Además, en el modelo ex vivo las células presentaron una alta afinidad para adherirse a las zonas de daño endotelial y adquirieron una apariencia de monocapa. Sin embargo, no tenían la morfología propia del endotelio, sino formas elongadas y parecidas a fibroblastos en algunos casos y con superposición (22).
Es con Yamashita e investigadores cuando se crea un protocolo centrado en la diferenciación de MSC a endotelio corneal utilizando MSC derivadas del estroma del cordón umbilical. Este protocolo dista totalmente de las técnicas previamente descritas por Joyce. Para ello, utilizan como principal método diferenciador un medio con inhibidor de la isoforma β de la Glycogen Syntethase Kinase (GSK) 3. Comienzan con formación de esferas de MSC colocando MSC a una densidad de 3×106 células/placa en placas de cultivo formadoras de esferas 3D usando el medio de DMEM y F12 medium suplementado con factor de crecimiento epidérmico y Dipéptido L-alanina L-glutamina cultivándolas durante 2-4 días para generar esferas. Posteriormente se disocian las esferas en células en solución de disociacioón con Accutasa y después se suspenden en una densidad de 2×105 células/cm2 en platos de 35 mm con reactivo de cultivo de tejidos sin suero que contiene fibronectina, colágeno y albúmina. Estas células se cultivan con el medio inductor de endotelio corneal que está basado en el medio de Eagle Essential Medium suplementado con 0,5 microM de BIO (inhibidor de glicogen kinasa 3β) 10 microM de Y-27632(inhibidor de la ROCK), 1% de insulina, trasnferrina y solución de selenio (ITS-G), triyodotironina 4nM, hidrocortisona 0,5 microgramos /ml, 50 microgramos/ml de acido ascórbico, 1mM piruvato de sodio, 1mM CaCl2, MEM aminoácidos y MEM Essential Vitamin Mixture, todo incubado durante una semana cambiando el medio de cultivo cada 2 días. Se observó que el perfil de marcadores celulares de endotelio humano era muy similar al encontrado en las células diferenciadas de MSC; en especial para la ATPasa Na/K, ZO-1 y PITX2 (Marcadores de función endotelial) al mismo tiempo de adquirir una morfología poligonal más próxima al aspecto endotelial. El análisis del proceso de diferenciación reveló que el perfil de marcadores celulares de endotelio humano era muy similar al encontrado en las células diferenciadas de MSC; en especial para la ATPasa Na/K, ZO-1 y PITX2, importantes marcadores de función endotelial, al mismo tiempo adquirieron una morfología poligonal más próxima al aspecto endotelial. De otro lado, el análisis in vitro de la función de bomba de la ATPasa de las nuevas células derivadas, mostró una mayor función en las células derivadas que en las propia estirpe de endotelio corneal humano. Por último, en un modelo de queratopatía bullosa animal in vivo¸ las células endoteliales derivadas de MSC consiguieron mantener el espesor y transparencia corneal (24).
Por otra parte, los experimentos más recientes de diferenciación a endotelio se centran en los factores microambientales conocidos y desconocidos que actúan sobre el endotelio. En concreto, el protocolo de Gutermuth y colaboradores se centra en la influencia de la membrana de Descemet y en su microtopografía (DLT). Para ello, aislaron y expandieron las MSC, a partir de biopsias humanas de prepucio y realizaron un denudado de la membrana de Descemet de corneas de conejo explantadas y descelularizadas usando EDTA con agua osmótica purificada. Una vez denudada la membrana de Descemet, 250.000 MSC se cultivaron en la superficie de la membrana de Descemet y a las 24h cambiaron a un medio con Serum Reduced Cultured Medium. Tras analizar la topografía de la membrana de Descemet con un sistema óptico 3D de superficie mediante tecnología láser elaboraron unos moldes/matriz de Polidimetilsiloxane(PDMS) siguiendo la topografía descemética (a grandes rasgos una matriz hexagonal). Esta superficie es previamente tratada con el objetivo de incluir hidrofílicidad y facilitar el crecimiento de MSC en condiciones de cultivo estándar. Una vez llevados a cabo los experimentos utilizando PDM y MSCS se evaluó la morfología celular y se realizó un análisis genético por PCR de los principales genes de endotelio corneal humano además del análisis inmunohistoquímico para demostrar su expresión proteica. Vislumbrando que, además de adquirir la morfología poligonal celular y en monocapa, presentaban mayor cantidad de uniones estrechas, lo que las hace más parecidas al endotelio corneal humano nativo (26).
Investigadores del mismo grupo, liderados en este caso por Feiertag y basándose en el protocolo del estudio anterior diferenciaron MSC de la gelatina de Wharton del cordón umbilical humano. Para ello, aislaron las células mesenquimales de la gelatina y prediferenciaron dichas células hacia progenitoras endoteliales incubándolas en medio de Dulbecco Modified Eagle (DMEM) con 0,2 mg/ml de colagenasa NB4 en condiciones estándar durante 24h. El pellet celular resultante se suspendió en Medio de Crecimiento Endotelial 2 (EGM-2) con 20% de FBS y 1% penicilina/estreptomicina 0,1% CFA y se cultivó a una densidad de 5.000 células/cm2. Las células previamente diferenciadas se cultivaron en membranas de colágeno con la microtopografía de membrana de Descemet (DLT) en un área de 1 cm2 y cultivaron a una densidad de 3.000 células/mm2. Las primeras 24h se usó EGM-2 enriquecido con FBS 20% y 1% penicilina. Posteriormente, el medio de cultivo se cambió a Human Endotelial Serum-Free Medium suplementado con 20 ng/ml de bFGF, 10ng/ ml de EGF y 1% penicilina, cambiándose cada 2-3 días. Para la producción de membranas de colágeno con la topografía descemética se utilizó colageno I de cola de rata fundido con la DLT. Seguidamente, se realizó inmunohistoquímica y PCR para detectar las principales proteínas y genes del endotelio corneal humana. Además, en este experimento al igual que en experimentos desarrollados por Yamashita, se evaluó la funcionalidad de las células endoteliales derivadas de MSC midiendo las diferencias de potencial relativo mediante un sistema de dos compartimentos y midiendo la transparencia corneal mediante un modelo ex vivo animal. Por tanto, se desarrolló una monocapa de endotelio corneal humano bien caracterizado y funcional mediante esta diferenciación mediada por mecanismos mecanotransductivos(25)(Tabla 2).
Tabla 2. Principales métodos de diferenciación de MSC a endotelio corneal humano y principales marcadores celulares utilizados.
Marcadores de diferenciación de MSC diferenciadas hacia endotelio corneal humano
Pese al gran desarrollo de la Ingeniería Tisular, a día de hoy no existe un marcador de superficie específico de endotelio corneal humano normofuncionante. Clásicamente, se han identificado como marcadores de “primera generación” la ATPasa Na/K y las uniones estrechas ZO-1, los cuales se expresan en multitud de tipos celulares. La disponibilidad de técnicas de secuenciación genética de nueva generación han permitido descubrir gran cantidad de nuevos genes que se postulan como selectivamente sobreexpresados en el endotelio corneal humano; algunos de estos son CLRN1, MRGPRX3, HTR1D, GRIP1, ZP4, SLC4A11, COL8A2 y CYYR1(27,33).
Del mismo modo se ha visto que los marcadores clásicos se expresan altamente en endotelio normomorfo y funcionante (Forma canónica), pero al suspenderse disminuyen drásticamente. Nuevos marcadores como el CD56 o Neural Cell Adhesion Molecule (NCAM), se expresan altamente en el endotelio corneal(34).
En los estudios de diferenciación de MSC, en concreto Joyce realizó PCR a las MSC del cordón umbilical derivadas a endotelio de NCAM1, TFAP2B, CDK15, COL8A1, MEIS1, THY1, CDH2 (N-Cadherina) y TJP1(ZO-1). Se cuantificó y comparó con las células endoteliales corneales humanas. Asimismo, se realizó inmunohistoquímica para ZO-1 y para N-cadherina para observar su distribución (22). Por otra parte, Yamashita y colaboradores añadieron al estudio inmunohistoquímica de ZO-1 y CDH2, el de la ATPasa Na/K sibunidad alfa 1(ATP1A1) como un marcador importante de la funcionalidad del endotelio. Realizando además una amplia cantidad de marcadores conocidos hasta la fecha como marcadores de cresta neural humana como ITGA4, SOX9, SOX10, SNAIL, TFAP2 que fueron medidos por RT-PCR; además de PCR de ATP1A1, CDH2, PITX2, COL4A2, SLC4A4, CAR2 y COL8A2(21).
Recientes hallazgos de Guthermuth y Feiertag realizan la detección clásica de ZO-1 y de la ATPasa mediante inmunohistoquímica, junto con estudios de PCR de una selección de genes coincidiendo con los estudios de Yamashita de los genes de ATP1A1, COL8A2, PITX2, ZO-1 y DAPI(25,26).
Técnicas quirúrgicas de implantación de MSC diferenciadas hacia endotelio corneal humano
La cornea humana es un tejido avascular y con unas características inmunológicas que teóricamente la hacen propicia para desarrollar técnicas de trasplante con una menor tasa de fallo de injerto o tasa de rechazo. A día de hoy las técnicas de injerto o trasplante de endotelio más utilizadas en humanos son las denominadas DSAEK y DMEK (35). Recientemente se han descrito casos de aclaramiento corneal en ojos intervenidos mediante DMEK con desprendimiento parcial (36,37) o total (38) del injerto, proponiéndose un nuevo procedimiento denominado transferencia endotelial de la membrana de Descemet (DMET). Una observación similar ha sido descrita por Zafirakis(39) et al. tras la DSAEK.
En este sentido, muchas de las aproximaciones propuestas de implantación de células de endotelio corneal incluyen la implantación de lámina monocapa de células, terapia con inyección celular (40) y sistemas de cell-carrying(27). Así mismo, el posicionamiento de las células endoteliales (depositadas en la cámara anterior) en la cara posterior de la córnea, ha sido testada junto con métodos con inducción ferromagnética (41,42) o usando la gravedad, con la postura de decúbito prono (43) o una combinación de ambas.
Al mismo tiempo, se han testado varios scaffolds o matrices de diferente composición como vehículos de células endoteliales en las técnicas de queratoplastia, materiales como la membrana de Descemet porcina(44,45), citosan(46), lente de hidrogel(47) o microesferas paramagnéticas(48).
Del mismo modo que la evidencia con MSC y endotelio es escasa, no ha habido gran cantidad de ensayos en materia de implantación de endotelio diferenciado a partir de MSC. En el primer experimento Liu y colaboradores usaron unas membranas de glutaraldehído y las pegaron con alfa cianocrilato alkyl a botones corneales de 7 mm de diametro de conejo cuyo endotelio había sido eliminado previamente de forma mecánica(20).
Por otra parte, Yamashita y colaboradores usaron láminas de colágeno tipo I como vehículo para cultivar las células diferenciadas y posteriormente se adhirieron a una a un botón de 8mm de córnea donante previo pelado de la Descemet, tras 5 min se realizó un queratoplastia penetrante con sutura continua 10-0 nylon (24).
Finalmente, Shao y colaboradores utilizaron progenitores endoteliales de sangre de cordón umbilical unidas a nanopartículas inmunomagneticas CD34 en la cámara anterior después de haber realizado una descematorrexis, posteriormente colocaron un imán en el párpado durante 12h, obteniendo resultados prometedores en las corneas trasplantadas(23).
CONCLUSIÓN
Las células madre mesenquimales se presentan como una alternativa en vías de desarrollo dentro la Ingeniería Tisular con prometedores resultados en la terapia regenerativa. Si bien son pocos los ensayos clínicos publicados en materia de endotelio corneal humano que utilizan dichas células; el potencial de regeneración y de diferenciación de las MSC junto con el desarrollo que ha experimentado la Ingeniería Tisular, hace que se postulen como el futuro de la terapia sustitutiva.
Son muchas las fuentes de obtención de MSC, aunque ha habido una clara tendencia de los autores por la utilización de MSC derivadas de cordón umbilical en los ensayos con endotelio corneal humano, entre otros motivos por el poder de diferenciación de las mismas sobre otras fuentes celulares como la médula ósea. Sin embargo, no existe evidencia que contraste que uno u otro tipo de fuente de MSC sea mejor para regenerar o diferenciar a endotelio corneal, puesto que no se han comparado específicamente bajo un mismo método de diferenciación o aplicación.
Aunque se ha demostrado la capacidad de diferenciación a endotelio humano a partir de MSC y estas tienen una serie de ventajas sobre otro tipo de células madre (como las procedentes de embriones); se requiere de una estandarización o diseño de un protocolo de diferenciación que aúne la evidencia publicada, así como mayor número de experimentos en un modelo animal más parecido al modelo humano, que permita en un siguiente escalón su aplicación al modelo humano, ya sea de forma paliativa o terapéutica.
Uno de los pasos clave en la diferenciación es la caracterización de las células derivadas, aquí tienen especial importancia los marcadores celulares. A día de hoy no disponemos de ningún marcador específico de endotelio corneal humano, sin embargo, los autores coinciden en una serie de marcadores, que sin ser específicos, son muy sugestivos de un endotelio corneal humano, estos son ATP1A1, COL8A2, PITX2 y ZO-1.
Estos avances en Ingeniería Tisular requieren de un desarrollo paralelo en las técnicas de trasplante o implantación endotelial. En este campo la técnica más aceptada por los autores por su menor complejidad y su reproductibilidad es la terapia celular con inyección en cámara anterior, vehiculizada o implementada con otras técnicas como el decúbito prono, previa realización de descematorrexis.
REFERENCIAS BIBLIOGRÁFICAS
- ↑Friedenstein AJ, Chailakhyan RK, Latsinik N V, Panasyuk AF, Keiliss-Borok I Stromal cells responsible for trans- ferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo. Transplantation. 1974 Apr;17(4):331–40. DOI: https://doi.org/10.1097/00007890-197404000-00001
- ↑Wang H-S, Hung S-C, Peng S-T, Huang C-C, Wei H-M, Guo Y-J, et Mesenchymal Stem Cells in the Wharton’s Jelly of the Human Umbilical Cord. Stem Cells. 2004 Dec;22(7):1330–7. DOI: https://doi.org/10.1634/stem-cells.2004-0013
- ↑Rodriguez A-M, Elabd C, Amri E-Z, Ailhaud G, Dani The human adipose tissue is a source of multipotent stem cells. Biochimie. 2005 Jan;87(1):125–8. DOI: https://doi.org/10.1016/j.biochi.2004.11.007
- ↑Nancarrow-Lei R, Mafi P, Mafi R, Khan A Systemic Review of Adult Mesenchymal Stem Cell Sources and their Multilineage Differentiation Potential Relevant to Musculoskeletal Tissue Repair and Regeneration. Curr Stem Cell Res Ther. 2017 Nov;12(8):601–10. DOI: https://doi.org/ 10.2174/1574888X12666170608124 303
- ↑Baksh D, Song L, Tuan Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy. J Cell Mol Med. 2004 Jul-Sep;8(3):301-16. DOI: https://doi.org/10.1111/j.1582-4934.2004.tb00320.x.
- ↑Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop Dj, Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Thera- py position statement. Cytotherapy. 2006 Jan;8(4):315-7. DOI: https://doi.org/10.1080/14653240600855905
- ↑Horwitz EM, Le Blanc K, Dominici M, Mueller I, Slaper-Cortenbach I, Marini FC, et Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 2005;7(5):393–5. DOI: https://doi.org/10.1080/14653240500319234
- ↑Peh GSL, Beuerman RW, Colman A, Tan DT, Mehta Human corneal endothelial cell expansion for corneal endothelium transplantation: an overview. Transplantation. 2011 Apr 27;91(8):811–9. DOI: https://doi.org/10.1097/tp.0b013e3182111f01
- ↑Gain P, Jullienne R, He Z, Aldossary M, Acquart S, Cognasse F, et Global Survey of Corneal Transplantation and Eye Banking. JAMA Ophthalmol. 2016 Feb;134(2):167–73. DOI: https://doi.org/10.1001/jamaophthalmol.2015.4776
- ↑Wörner CH, Olguín A, Ruíz-García JL, Garzón-Jiménez Cell pattern in adult human corneal en- dothelium. PLoS One. 2011 May;6(5):e19483. DOI:https://doi.org/10.1371/journal.pone.0019483
- ↑Bahar I, Kaiserman I, McAllum P, Slomovic A, Rootman D. Comparison of posterior lamellar keratoplasty techniques to penetrating keratoplasty. Ophthalmology. 2008 Sep;115(9):1525-33. DOI: https://doi.org/10.1016/j.ophtha.2008.02.010
- ↑Joyce Proliferative capacity of corneal endothelial cells. Exp Eye Res. 2012 Feb;95(1):16–23. DOI: https://doi.org/10.1016/j.exer.2011.08.014
- ↑Polse KA, Brand RJ, Cohen SR, Guillon Hypoxic effects on corneal morphology and function. Invest Ophthalmol Vis Sci. 1990 Aug;31(8):1542–54.
- ↑Eghrari AO, Gottsch Fuchs’ corneal dystrophy. Expert Rev Ophthalmol. 2010 Apr;5(2):147–59. DOI: https://doi.org/10.1586/eop.10.8
- ↑Duman F, Kosker M, Suri K, Reddy JC, Ma JF, Hammersmith KM, et Indications and outcomes of corneal transplantation in geriatric patients. Am J Ophthalmol. 2013 Sep;156(3):600-607.e2. DOI: https://doi.org/10.1016/j. ajo.2013.04.034
- Pricopie S, Istrate S, Voinea L, Leasu C, Paun V, Radu Pseudophakic bullous keratopathy. Rom J Ophthalmol. 2017 Apr-Jun;61(2):90-4. DOI: https://doi.org/10.22336/rjo.2017.17
- Chaurasia S, Price FW, Gunderson L, Price Desce- met’s membrane endothelial keratoplasty: clinical results of single versus triple procedures (combined with cataract surgery). Ophthalmology. 2014 Feb;121(2):454–8. DOI: https://doi.org/10.1016/j.ophtha.2013.09.032
- Baydoun L, Tong CM, Tse WW, Chi H, Parker J, Ham L, et Endothelial cell density after descemet membrane endothelial keratoplasty: 1 to 5-year follow-up. Am J Ophthalmol. 2012 Oct;154(4):762–3. DOI: https://doi.or-g/10.1016/j.ajo.2012.06.025
- Zavala J, López Jaime GR, Rodríguez Barrientos CA, Valdez-Garcia Corneal endothelium: developmental strategies for regeneration. Eye (Lond). 2013 May;27(5):579–88. DOI: https://doi.org/10.1038/eye.2013.15
- ↑Liu X-W, Zhao J-L. [Transplantation of autologous bone marrow mesenchymal stem cells for the treatment of corneal endothelium damages in rabbits]. Zhonghua Yan Ke Za 2007 Jun;43(6):540–5.
- ↑Markov V, Kusumi K, Tadesse MG, William DA, Hall DM, Lounev V, et Identification of Cord Blood-Derived Mesenchymal Stem/stromal Cell Populations with Distinct Growth Kinetics, Differentiation Potentials, and Gene Expression Profiles. Stem Cells Dev. 2007 Feb;16(1):53–74. DOI: https://doi.org/10.1089/scd.2006.0660
- ↑Joyce NC, Harris DL, Markov V, Zhang Z, Saitta Potential of human umbilical cord blood mesenchymal stem cells to heal damaged corneal endothelium. Mol Vis. 2012 Mar;18:547-64.
- ↑Shao C, Chen J, Chen P, Zhu M, Yao Q, Gu P, et Targeted transplantation of human umbilical cord blood endothelial progenitor cells with immunomagnetic nanoparticles to repair corneal endothelium defect. Stem Cells Dev. 2015 Mar 15;24(6):756–67. DOI: https://doi.org/10.1089/scd.2014.0255
- ↑Yamashita K, Inagaki E, Hatou S, Higa K, Ogawa A, Miyashita H, et Corneal Endothelial Regeneration Using Mesenchymal Stem Cells Derived from Human Umbilical Cord. Stem Cells Dev. 2018 Aug;27(16):1097–108. DOI: https://doi.org/10.1089/scd.2017.0297
- ↑Feiertag E, Maassen J, Mueller A, Harnisch E, Skazik-Voogt C, Engelmann K, et al. From Cord to Eye: Wharton Jelly-Derived Stem Cells Differentiate Into Corneal Endothelial-Like Cornea. 2020 Jul;39(7):877–85. DOI: https://doi.org/10.1097/ico.0000000000002319
- ↑Gutermuth A, Maassen J, Harnisch E, Kuhlen D, Sauer-Budge A, Skazik-Voogt C, et Descemet’s Membrane Biomimetic Microtopography Differentiates Human Mesenchymal Stem Cells Into Corneal Endothelial-Like Cells. Cornea. 2019 Jan;38(1):110–9. DOI: https://doi.org/10.1097/ico.0000000000001765
- ↑Soh YQ, Peh GSL, Mehta Translational issues for human corneal endothelial tissue engineering. J Tissue Eng Regen Med. 2017 Sep;11(9):2425–42. DOI: https://doi.org/10.1002/term.2131
- ↑Vianna LMM, Kallay L, Toyono T, Belfort R, Holiman JD, Jun Use of human serum for human corneal endothelial cell culture. Br J Ophthalmol. 2015 Feb;99(2):267–71. DOI: https://doi.org/10.1136/bjoph- thalmol-2014-306034
- ↑Sha X, Liu Z, Song L, Wang Z, Liang Human amniotic epithelial cell niche enhances the functional properties of human corneal endothelial cells via inhibiting P53-survivin-mitochondria axis. Exp Eye Res. 2013 Nov;116:36– 46. DOI: https://doi.org/10.1016/j.exer.2013.08.008
- ↑Van den Bogerd B, Zakaria N, Matthyssen S, Koppen C, Ní Dhubhghaill Exploring the Mesenchymal Stem Cell Secretome for Corneal Endothelial Proliferation. Stem Cells Int. 2020 Feb 5;2020:5891393. DOI: https://doi.org/10.1155/2020/5891393
- ↑Hatou S, Shimmura Review: corneal endothelial cell derivation methods from ES/iPS cells. Inflamm Regen. 2019 Oct 3;39:19. DOI: https://doi.org/10.1186/s41232-019-0108-y
- ↑Zhang L, Coulson-Thomas VJ, Ferreira TG, Kao Mesenchymal stem cells for treating ocular surface diseases. BMC Ophthalmol. 2015 Dec 17;15 Suppl 1:155. DOI: https://doi.org/10.1186/s12886-015-0138-4
- ↑Nagymihály R, Veréb Z, Albert R, Sidney L, Dua H, Hopkinson A, et Cultivation and characterisation of the surface markers and carbohydrate profile of human corneal endothelial cells. Clin Experiment Ophthalmol. 2017 Jul;45(5):509–19. DOI: https://doi.org/10.1111/ceo.12903
- ↑Bartakova A, Alvarez-Delfin K, Weisman AD, Salero E, Ra- ffa GA, Merkhofer RM, et Novel Identity and Functional Markers for Human Corneal Endothelial Cells. Invest Ophthalmol Vis Sci. 2016 May;57(6):2749–62. DOI: https://dx.doi.org/10.1167%2Fiovs.15-18826
- ↑Tourtas T, Laaser K, Bachmann BO, Cursiefen C, Kruse Descemet membrane endothelial keratoplasty versus descemet stripping automated endothelial keratoplasty. Am J Ophthalmol. 2012 Jun;153(6):1082-90.e2. DOI: https://doi.org/10.1016/j.ajo.2011.12.012
- ↑Balachandran C, Ham L, Verschoor CA, Ong TS, van der Wees J, Melles Spontaneous Corneal Clearance Despite Graft Detachment in Descemet Membrane Endothelial Keratoplasty. Am J Ophthalmol. 2009 Aug;148(2):227- 234.e1. DOI: https://doi.org/10.1016/j.ajo.2009.02.033
- ↑Dirisamer M, Dapena I, Ham L, van Dijk K, Oganes O, Frank LE, et Patterns of Corneal Endothelialization and Corneal Clearance After Descemet Membrane Endothelial Keratoplasty for Fuchs Endothelial Dystrophy. Am J Ophthalmol. 2011 Oct;152(4):543-555.e1. DOI: https://doi.org/10.1016/j.ajo.2011.03.031
- ↑Dirisamer M, Ham L, Dapena I, van Dijk K, Melles Descemet Membrane Endothelial Transfer: “Free-Floa- ting” Donor Descemet Implantation as a Potential Alter- native to “Keratoplasty.” Cornea. 2012 Feb;31(2):194–7. DOI: https://doi.org/10.1097/ico.0b013e31821c9afc
- ↑Zafirakis P, Kymionis GD, Grentzelos MA, Livir-Rallatos Corneal Graft Detachment Without Corneal Edema After Descemet Stripping Automated Endothelial Keratoplasty. 2010 Apr;29(4):456–8. DOI: https://doi.org/10.1097/ico.0b013e3181b46bc2
- ↑Kinoshita S, Koizumi N, Ueno M, Okumura N, Imai K, Tanaka H, et al. Injection of Cultured Cells with a ROCK Inhibitor for Bullous Keratopathy. N Engl J Med. 2018 Mar 15;378(11):995– 1003. DOI: https://doi.org/10.1056/nejmoa1712770
- ↑Mimura T, Shimomura N, Usui T, Noda Y, Kaji Y, Yamgami S, et Magnetic attraction of iron-endocytosed corneal endothelial cells to Descemet’s membrane. Exp Eye Res. 2003 Jun;76(6):745–51. DOI: https://doi.org/10.1016/s0014-4835(03)00057-5
- ↑Mimura T, Yamagami S, Usui T, Ishii Y, Ono K, Yokoo S, et Long-term outcome of iron-endocytosing cultured corneal endothelial cell transplantation with magnetic attraction. Exp Eye Res. 2005 Feb;80(2):149–57. DOI: https://doi.org/10.1016/j.exer.2004.08.021
- ↑Peh GSL, Toh K-P, Wu F-Y, Tan DT, Mehta Cultivation of human corneal endothelial cells isolated from paired donor corneas. PLoS One. 2011 Dec;6(12):e28310. DOI: https://doi.org/10.1371/journal.pone.0028310
- ↑Shao C, Fu Y, Lu W, Fan Bone marrow-derived endothelial progenitor cells: a promising therapeutic al- ternative for corneal endothelial dysfunction. Cells Tissues Organs. 2011 Mar;193(4):253–63. DOI: https://doi.org/10.1159/000319797
- ↑Schwartzkopff J, Bredow L, Mahlenbrey S, Boehringer D, Reinhard Regeneration of corneal endothelium following complete endothelial cell loss in rat keratoplasty. Mol Vis. 2010 Nov 11;16:2368–75.
- ↑Wang T-J, Wang I-J, Lu J-N, Young T-H. Novel chitosan-polycaprolactone blends as potential scaffold and carrier for corneal endothelial transplantation. Mol Vis. 2012 Jan;18:255–64.
- ↑Mohay J, Wood TO, McLaughlin Long-term evaluation of corneal endothelial cell transplantation. Trans Am Ophthalmol Soc. 1997 Jan;95:131–48; discussion 149-51. DOI: https://doi.org/10.1016/0042-6989(95)90357-7
- ↑Patel S V, Bachman LA, Hann CR, Bahler CK, Fautsch Human corneal endothelial cell transplantation in a human ex vivo model. Invest Ophthalmol Vis Sci. 2009 May;50(5):2123–31. DOI: https://doi.org/10.1167/iovs.08-2653
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Raúl Martínez Castillo. Departamento de Oftalmología. Hospital Universitario Clínico San Cecilio Av. Del conocimiento s/n · 18016 Granada. E-mail: raulmartinezcastillo@gmail.com