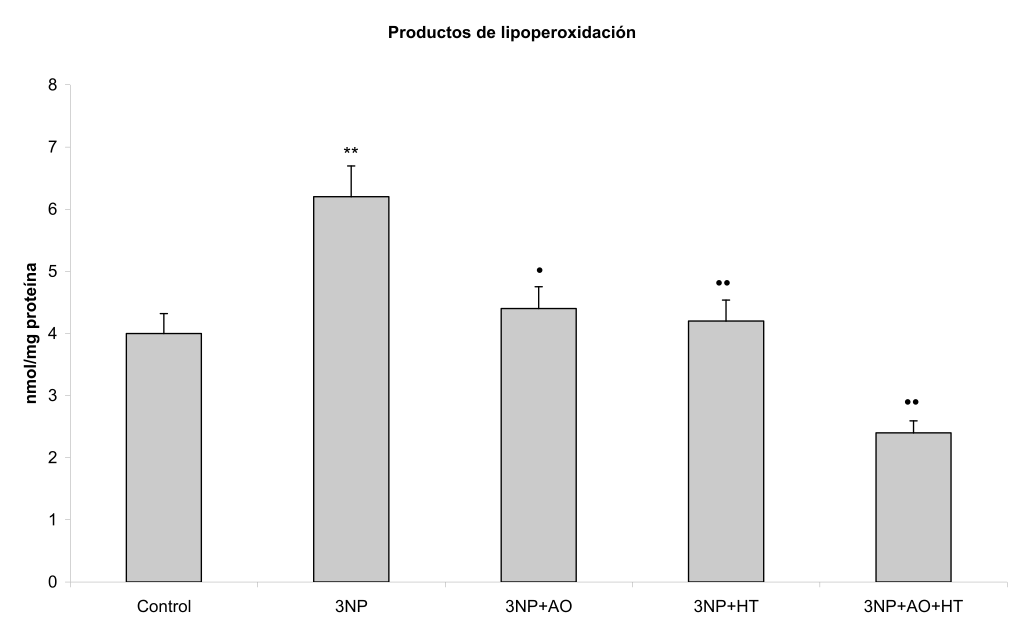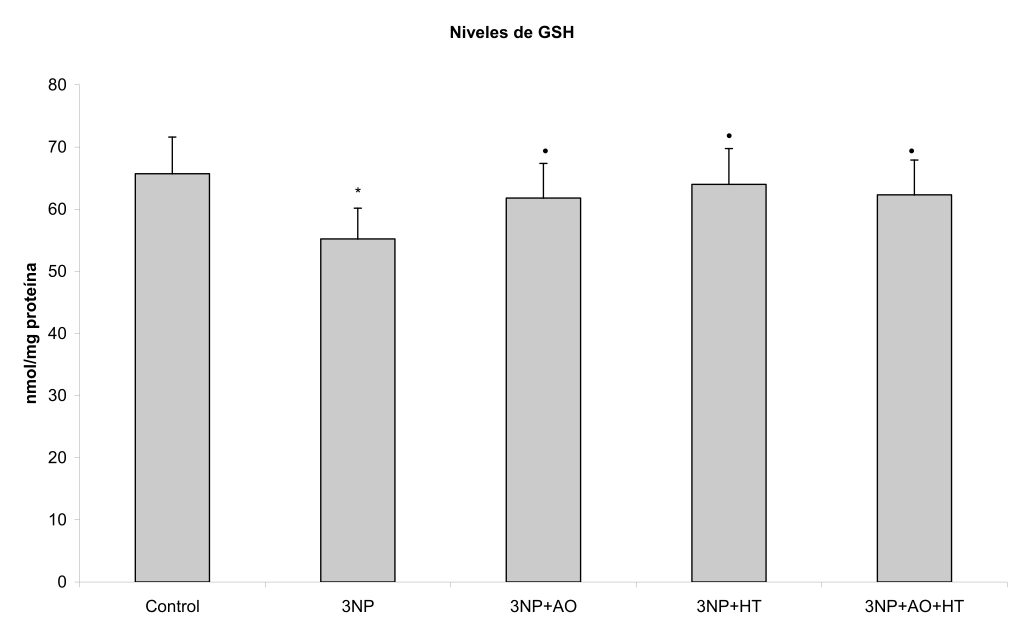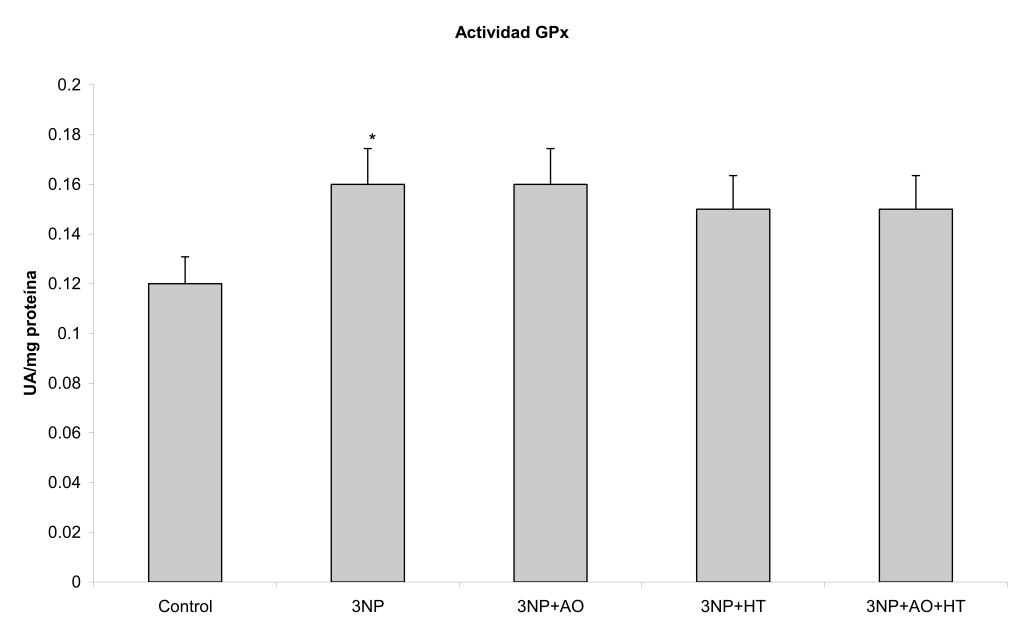Original
Efecto antioxidante del ácido oleico e hidroxitirosol en un modelo experimental similar a la enfermedad de Huntington
Antioxidant effect of oleic acid and hydroxytyrosol in an experimental model similar to Huntington's disease
Actual. Med. 2014; 99: (792): 60-64 DOI: 10.15568/am.2014.792.or01
Enviado 19-02-2013
Revisado 24-05-2013
Aceptado 29-05-2013
RESUMEN
Los radicales libres juegan un papel fundamental en la alteración neuronal que tiene lugar en enfermedades neurodegenerativas y en el envejecimiento cerebral. Se ha asociado la dieta Mediterránea con la reducción del riesgo de padecer enfermedades neurodegenerativas. Objetivos. Este estudio fue diseñado para probar si el ácido oleico y el hidroxitirosol, componentes del aceite de oliva virgen-extra, ejercen un efecto antioxidante protector en el cerebro ante el estrés oxidativo inducido por el ácido 3-nitropropiónico. Métodos. El ácido 3-nitropropiónico se administró intraperitonealmente a una dosis de 20 mg/kg de peso durante cuatro días consecutivos. El ácido oleico (con una dosis del 4% de calorías ingeridas diariamente por el animal) y el hidroxitirosol (2,5 mg/kg de peso en solución acuosa) se administraron durante 14 días a ratas Wistar. Resultados. El ácido 3-nitropropiónico causó un aumento de la peroxidación lipídica y de la actividad de la glutatión peroxidasa, y una reducción en la concentración de glutatión reducido. Los resultados obtenidos además demuestran que el ácido oleico y el hidroxitirosol reducen los niveles de los productos de peroxidación lipídica y bloquean el agotamiento del glutatión reducido en el cerebro tras la administración de ácido 3-nitropropiónico. Conclusión. Tanto el ácido oleico como el hidroxitirosol actúan como potentes antioxidantes frente al estrés oxidativo inducido por el ácido 3-nitropropiónico.
Palabras clave: Ácido3-nitropropiónico, ácido oleico, enfermedad de Huntington, estrés oxidativo, hidroxitirosol
ABSTRACT
Free radicals play an important role in neuronal alterations during the progression of neurodegenerative disorders and brain aging. Mediterranean-style diet has been associated to a reduction in the risk to develop neurodegenerative disorders. Objectives. This study was designed to test whether oleic acid and hydroxytyrosol, both components of extra-virgin olive oil, exert an antioxidant and protective effect in the brain subjected to oxidative stress induced by 3-nitropropionic acid. Methods. 3-Nitropropionic acid was administered intraperitoneally to animals at a dose of 20 mg/kg for 4 consecutive days. Oleic acid (given at a dose equivalent to 4% of the calories ingested every day per animal) and hydroxytyrosol (2,5 mg/kg, dissolved in aqueoussolution) were administered during 14 consecutive days to Wistar rats. Results. 3-Nitropropionic acid caused increased levels of lipid peroxidation and glutathione peroxidase activity, and a depletion in the concentration of reduced glutathione. Our findings also demonstrate that oleic acid and hydroxytyrosol reduce the levels of lipid peroxidation and prevent the depletion of reduced glutathione in the brain induced by the administration of 3-nitropropionic acid. Conclusion. Both oleic acid and hydroxytyrosol act as potent antioxidants against the oxidative damage induced by 3-nitropropionic acid.
Keywords: Huntington’s disease, hydroxytyrosol, 3-nitropropionic acid, oleic acid, oxidative stress
Leer Artículo Completo
Introducción
El cerebro es particularmente vulnerable al daño oxidativo debido principalmente a su gran c ontenido en ácidos grasos poliinsaturados, alto consumo de oxígeno y actividad mitocondrial, así como a su menor capacidad antioxidante en comparación con otros órganos y tejidos (1,2).
Las principales fuentes productoras de especies reactivas del oxígeno y del nitrógeno (ERO/ERN) son la fosforilación oxidativa, la cadena de transporte electrónico mitocondrial y la NADPH-oxidasa. El estrés oxidativo tiene lugar cuando la producción de ERO/ERN excede la capacidad de neutralización de los sistemas antioxidantes, responsables de mantener el equilibrio redox, provocando así una disminución de las funciones normales y la muerte celular (3). Esta situación se asocia a procesos neurodegenerativos como la enfermedad de Alzheimer, la enfermedad de Parkinson, la esclerosis múltiple y la enfermedad de Huntington, entre otras (4, 5).
La enfermedad de Huntington es una enfermedad neurodegenerativa de origen genético causada por la expansión del triplete CAG. Este gen codifica la huntingtina, una proteína cuya función no se conoce con exactitud. La proteína mutada se agrega en la célula, produciendo efectos a distintos niveles, aunque el mecanismo por el cual se produce la muerte neuronal progresiva no se conoce al completo (6). Diferentes son los mecanismos involucrados en la patogénesis y evolución de proceso, implicados en el daño tisular que lleva a la muerte neuronal. Entre ellos, es el daño oxidativo quién parece jugar un papel más preponderante en la muerte neuronal y la progresión de la enfermedad. Mecanismo, subyacente al desorden ocasionado por la presencia de la proteínas huntingtina mutada (7).
Los radicales libres, normalmente generados por la respiración mitocondrial, causan daño oxidativo y son considerados factores importantes en la aparición, evolución y morbilidad de la enfermedad (8). Diversos modelos experimentales han sido desarrollados para estudiar y clarificar los mecanismos implicados como la producción de ERO/ERN (9). Entre ellos destacan por su simplicidad y facilidad de manejo los inducidos químicamente, siendo actualmente uno de los más destacados el desencadenado por el ácido 3-nitropropiónico, una conocida micotoxina (10). En roedores, este ácido causa la aparición de cambios fenotípicos, bioquímico-moleculares y celulares similares a los encontrados en el paciente con la enfermedad de Huntington, aunque con la excepción de no presentar ni la expansión del triple CAG ni el depósito, por tanto, de la proteína huntingtina mutada. El efecto desencadenado por el ácido 3-nitropropiónico obedece a su acción inhibidora de la succinato deshidrogenasa, enzima presente en el complejo II de la cadena de transporte electrónico mitocondrial y en el ciclo de Krebs. La acción de este inhibidor suicida causa un descenso en la síntesis de ATP y un incremento en la producción de ERO, con la consecuente presencia de un intenso daño oxidativo y muerte neuronal (11-13).
El aceite de oliva virgen-extra, asociado a una reducción en el riesgo de padecer enfermedades cardiovasculares y neurodegenerativas, es un constituyente básico de la dieta Mediterránea (14). Estudios epidemiológicos encuentran que las personas que presentan adherencia a este tipo de dieta muestran un menor riesgo de enfermedades neurodegenerativas asociadas al envejecimiento, como acontece en países como España, Francia, Grecia e Italia (15). La propiedades beneficiosas atribuidas a la dieta Mediterránea son debidas en parte a su rico contenido en ácido oleico y polifenoles, siendo uno de sus principales proveedores el aceite de oliva (16,17).
Datos previos de nuestro grupo muestran que el incremento en los biomarcadores de daño oxidativo y la reducción en los sistemas antioxidantes acontecida en el tejido nervioso de animales expuestos a ácido 3-nitropropiónico fue revertido hacia la normalidad por la administración oral de aceite de oliva virgen-extra. Este mismo estudio puso de manifiesto como el hidroxitirosol, polifenol componente minoritario de este tipo de aceite, presentó una eficacia similar a la del aceite de oliva virgen-extra en este modelo de enfermedad de Huntington (18).
En base a estos antecedentes, el presente estudio se planteó estudiar el efecto antioxidante de hidroxitirosol y ácido oleico, principal componente del aceite de oliva virgen-extra, en un modelo de daño oxidativo cerebral en el modelo experimental similar a enfermedad de Huntington inducido por la administración del ácido 3-nitropropiónico.
Materiales y métodos
Animales
Se emplearon veinte ratas Wistar de peso promedio al inicio del estudio de 230 g y 3 meses de edad. Las ratas fueron distribuidas al azar en grupos de cinco animales. Las condiciones de temperatura (20-23º C) y ciclos de luz/oscuridad de 12h:12h (con encendido de luz a las 8:00 am) fueron constantes durante todo el estudio. Los animales tuvieron acceso libre al alimento (Purine, Barcelona, España) y al agua. El estudio fue aprobado por el Comité de Bioética de la Universidad de Córdoba, y se ajustó a la normativa vigente (Consejo Europeo del 24 de noviembre de 1986; 86/609/ECC y el Real Decreto 223/1988).
Reactivos químicos
Los siguientes productos fueron adquiridos de Sigma-Aldrich (St. Louis, MO, USA): ácido oleico (AO), hidroxitirosol (HT) y ácido 3-nitropropiónico (3NP).
Procedimientos
El ácido 3-nitropropiónico (en solución salina pH 7,4) se administró intraperitonealmente a una dosis de 20 mg/kg de peso durante 4 días consecutivos (19). El ácido oleico fue suministrado durante 14 días consecutivos mediante sonda gástrica en un volumen correspondiente al 4% del total de calorías ingeridas diariamente por el animal. Por su parte, el hidroxitirosol se administró durante 14 días consecutivos a la dosis de 2,5 mg/kg de peso en solución acuosa mediante sonda gástrica. Los animales sometidos al ácido oleico y al hidroxitirosol siguieron la pauta de administración recomendada por el Departamento de Fisiología de la Facultad de Veterinaria de Córdoba para evitar posibles interferencias de absorción; así, primero se suministró hidroxitirosol (acuoso), y 30 minutos después el ácido oleico.
Diariamente se pesó a los animales con el fin de ajustar las dosis de ácido oleico e hidroxitirosol. Por su parte, la sonda gástrica fue introducida previa ligera anestesia con éter dietílico.
Los grupos desarrollados en el presente estudio -y constituidos por cinco animales cada uno- fueron: i) control; ii) inyectado con ácido 3-nitropropiónico (3NP); iii) ácido 3-nitropropiónico más ácido oleico (3NP + AO); iv) ácido 3-nitropropiónico + hidroxitirosol (3NP + HT); y v) ácido 3-nitropropiónico más ácido oleico más hidroxitirosol (3NP + AO + HT).
Variables bioquímicas estudiadas
Al final de cada experimento, y tras 8 horas de ayuno, los animales se sacrificaron bajo anestesia con éter dietílico, procediéndose a la extracción del cerebro en condiciones de frío y su inmediata congelación y conservación a -80º C hasta el día de la realización de los estudios bioquímicos.
Niveles de productos de lipoperoxidación
Se evaluó el daño oxidativo mediante los productos de lipoperoxidación del cerebro (niveles de malondialdehído, MDA + 4-hydroxyalquenales, 4-HDA). Para ello se utilizó el kit comercial LPO-586 (Bioxytech, Oxis International, Portland, OR, USA). Este método usa un reactivo cromógeno que reacciona con los productos de peroxidación lipídica a 45 ± 1º C. Los niveles de peroxidación lipídica se expresaron como nanomoles de MDA + 4-HDA por miligramo de proteína (nmol/mg proteína), y la absorbancia se midió en un espectrofotómetro UV-1603 (Shimadzu) a 586 nm.
Contenido de glutatión reducido
El glutatión (GSH) es un importante antioxidante intracelular, con gran relevancia entre los sistemas antioxidantes. El contenido de GSH en el cerebro se midió usando reactivos de Oxis International (GSH-400 kits, Oxis International, Portland, OR, USA), expresado como nanomoles de GSH por miligramo de proteína (nmol/mg de proteína). La absorbancia se evaluó a 400 nm en un espectrofotómetro (UV-1603; Shimadzu).
Actividad de la glutatión peroxidasa
Para la determinación de la actividad glutatión peroxidasa se usó un volumen de 25 μL de muestra, y los siguientes reactivos: tampón fosfato 0,1 M hasta completar un volumen de 880 μL, 51 μL de glutatión reductasa, 133 μL de glutatión reducido (30,7 mg/10 mL tampón fosfato 0,1 M), y 100 μL de NADPH (12,5 mg/10 mL [10 mg bicarbonato/10 mL agua]). La mezcla se incubó durante 3 minutos a 37 ºC, y unos segundos antes de leer se añadió 100 μL de ter-Butyl hidroperóxido (15,5 μL/10 mL tampón fosfato 10 M). La absorbancia se evaluó a 340 nm a tiempo 0 y a los 5 minutos mediante espectrofotometría (UV-1603; Shimadzu). Los resultados se expresan como unidad de actividad (UA) por miligramo de proteína. El estándar usado fue glutatión peroxidasa (Sigma, G-4013, 1UN) (20).
Cuantificación de proteínas
La concentración de proteínas se midió mediante la reacción de Bradford, usando albúmina sérica bovina como estándar. La absorbancia se evaluó mediante espectrofotometría (espectrofotómetro UV-1603; Shimadzu).
Análisis estadísticos
El análisis estadístico de los resultados se realizó con el programa estadístico SPSS 12.0® (SPSS Iberica, Madrid, España). Para evaluar la significancia estadística se aplicó un análisis de varianza (ANOVA) de una vía, con la prueba de corrección HSD de Tukey. El nivel de significancia estadística fue establecido en P < 0,05. Todos los resultados son expresados como media ± desviación estándar (DE).
Resultados
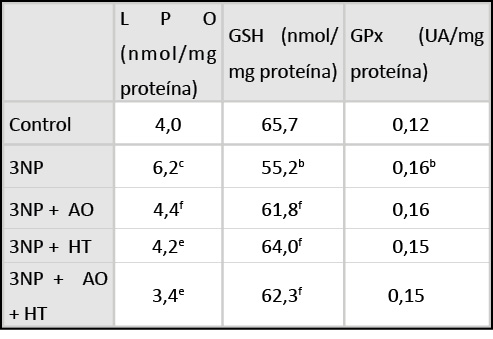
El 3NP causó un aumento en los productos de oxidación lipídica y de la actividad de la GPx en el cerebro (P<0,01 y P< 0,05 respectivamente), así como una disminución en los niveles de glutatión reducido (P<0,05) (Tabla 1, Figuras 1-3).
La administración del ácido oleico o hidroxitirosol tras la inyección con 3NP provocó la disminución en los niveles de productos de lipoperoxidación (P<0,01)(Tabla 1, Figura 1), y una recuperación en el contenido de GSH (P<0,05)(Tabla 1, Figura 2). Por su parte, ninguna de estos agentes desencadenó cambios significativos en los niveles de actividad de la GPx (Tabla 1, Figura 3).
Asimismo, la administración conjunta de ambas sustancias no intensificó su efecto protector respecto del tratamiento sencillo, aunque sí protegió en la misma intensidad que ambas moléculas de forma independiente.
Tabla 1 Cambios inducidos por el ácido 3-nitropropiónico (3NP), ácido oleico (AO) e hidroxitirosol (HT). Los datos representa las medias. bP < 0,01 vs control; cP < 0,05 vs control; eP<0.01 vs 3NP; fP<0.05 vs 3NP.
Figura 1. Efecto del hidroxitirosol (HT) y ácido oleico (AO) sobre los niveles de los productos de lipoperoxidación cerebrales en un modelo similar a enfermedad de Huntington inducido por ácido 3-nitropropiónico (3NP) en la rata Wistar. Las barras representan las medias ± DE. **P<0.01 vs control; ••P<0.01 vs 3NP; •P<0.05 vs 3NP.
Figura 2. Efecto del hidroxitirosol (HT) y ácido oleico (AO) sobre los niveles de glutatión reducido (GSH) cerebrales en un modelo similar a enfermedad de Huntington inducido por ácido 3-nitropropiónico (3NP) en la rata Wistar. Las barras representan las medias ± DE. *P<0.05 vs control; •P<0.05 vs 3NP.
Figura 3. Efecto del hidroxitirosol (HT) y ácido oleico (AO) sobre la actividad de la glutatión peroxidasa (GPx) cerebral en un modelo similar a enfermedad de Huntington inducido por ácido 3-nitropropiónico (3NP) en la rata Wistar. Las barras representan las medias ± DE. *P<0.05 vs control.
Discusión
Los resultados de este estudio muestran que el ácido oleico y el hidroxitirosol ejercen un potente efecto antioxidante en el modelo murino de enfermedad de Huntington desencadenado por el ácido 3-nitropropiónico. La administración del ácido oleico e hidroxitirosol restauró los niveles de productos de lipoperoxidación a la situación basal, la presentada por los animales a los que no se les suministró la micotoxina.
El consumo de aceite de oliva virgen-extra es asociado a un menor riesgo de padecer enfermedades crónicas, entre ellas las enfermedades cardiovasculares, el cáncer y enfermedades neurodegenerativas (18, 21, 22). Estas acciones son atribuibles en gran parte al ácido oleico y a los polifenoles, como el hidroxitirosol, que conforman el aceite de oliva virgen-extra, en los cuales hemos centrado nuestro estudio.
Se sabe que la administración intraperitoneal de ácido 3-nitropropiónico induce el estrés oxidativo en el tejido cerebral mediante la inhibición de la succinato deshidrogenasa, promoviendo así un descenso en la producción de ATP, un incremento de la producción de ERO y la consecuente disminución de los sistemas antioxidantes (4, 8, 10, 16). Hallazgos previos de nuestro grupo, y de otros investigadores, muestran que el ácido 3-nitropropiónico ejerce fundamentalmente su acción sobre el cuerpo estriado, aunque la corteza cerebral y el hipocampo también se ven afectados, pero en menor medida (18, 23-28).
Los resultados aquí obtenidos ponen de manifiesto las propiedades antioxidantes del ácido oleico y el hidroxitirosol en el tejido cerebral de rata. Como podemos comprobar en los resultados, la administración, mediante sonda gástrica, de ácido oleico e hidroxitirosol redujo la concentración de lipoperóxidos, y aumentó la concentración de glutatión reducido. Estos resultados apuntan a una reducción del daño oxidativo, que está en línea con otros trabajos que describen el efecto protector del aceite de oliva virgen-extra (18). Este efecto protector se ha demostrado en un gran espectro de enfermedades, pero sobre todo en las que conciernen al aparato cardiovascular (29, 30). A la acción antioxidante del ácido oleico, que en neurodegeneración y patología neurológica solo ha sido demostrada en estudios experimentales, se le suma su demostrada acción neurotrófica, caracterizada por: i) un aumento en los niveles de expresión de las proteínas marcadoras de diferenciación neuronal GAP-43 y MAP-2; ii) crecimiento axonal; y iii) agrupación neuronal. Esta última, daría lugar a la presentación de estructuras similares a la materia gris, con agrupación de somas neuronales, y prolongación de sus axones hasta conectar con neuronas adyacentes (31, 32).
Por su parte, el hidroxitirosol es uno de los más abundantes y representativos polifenoles que forman parte del aceite de oliva virgen-extra, y el más potente antioxidante natural (33). Éste se absorbe fácilmente, pero su biodisponibilidad (como la de la mayoría de los antioxidantes) es escasa debido al gran metabolismo de primer paso que sufre (34). Al objeto de tener una biodisponibilidad y efectos similares a los que pueden derivarse de su ingesta como componente del propio aceite de oliva, en nuestro estudio este agente se administró mediante sonda gástrica. Nuestros datos muestran como el hidroxitirosol recupera los niveles de GSH y reduce el daño oxidativo evaluado como productos de lipoperoxidación. Estos hallazgos acerca del hidroxitirosol están en concordancia con los resultados previos obtenidos en otros estudios experimentales acerca de los efectos de otros polifenoles, como el resveratrol y el licopeno, que tienen capacidad neuroprotectora, con la mejora de la viabilidad mitocondrial, cognición y funciones motoras (35, 36).
Conclusión
La administración de hidroxitirosol y ácido oleico actúa ejerciendo protección antioxidante frente al daño oxidativo inducido por 3NP en el tejido nervioso.
REFERENCIAS
- Adibhatla RM, Hatcher JF. Altered lipid metabolism in brain injury and disorders. Subcell Biochem. 2008; 49: 241-68.
- Dringen R. Metabolism and functions of glutathione in brain. Prog Neurobiol. 2000; 62: 649–71.
- Adibhatla RM, Hatcher JF. Lipid oxidation and peroxidation in CNS health and disease: from molecular mechanisms to therapeutic opportunities. Antioxid Redox Signal. 2010; 12: 125-69.
- Sabens Liedhegner EA, Gao XH, Mieyal JJ. Mechanisms of altered redox regulation in neurodegenerative diseases–focus on S–glutathionylation. Antioxid Redox Signal. 2012; 16: 543-66.
- Johnson WM, Wilson-Delfosse AL, Mieyal JJ. Dysregulation of glutathione homeostasis in neurodegenerative diseases. Nutrients. 2012; 4: 1399-440.
- Jones L, Hughes A. Pathogenic mechanisms in Huntington’s disease. 2011; 98: 373-418.
- Kumar P, Kalonia H, Kumar A. Huntington’s disease: pathogenesis to animal models. Pharmacol Rep. 2010; 62: 1-14.
- Trushina E, McMurray CT. Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases. Neuroscience. 2007; 145: 1233-4.
- Tasset I, Sánchez F, Túnez I. The molecular bases of Huntington’s disease: the role played by oxidative stress. Rev Neurol. 2009; 49: 424-9.
- Túnez I, Santamaría A. Modelo de enfermedad de Huntington inducido con ácido 3-nitropropiónico. Rev Neurol. 2009; 48: 430-34.
- Brouillet E, Jacquard C, Bizat N, Blum D. 3-Nitropropionic acid: a mitochondrial toxin to uncover physiopathological mechanisms underlying striatal degeneration in Huntington’s disease. J Neurochem. 2005; 95: 1521-40.
- Browne SE, Beal MF. Oxidative damage in Huntington’s disease pathogenesis. Antioxid Redox Signal. 2006; 8: 2061-73.
- Túnez I, Tasset I, Pérez-De La Cruz V, Santamaría A. 3-Nitropropionic acid as a tool to study the mechanisms involved in Huntington’s disease: past, present and future. Molecules. 2010; 15: 878-916.
- Cicerale S, Lucas LJ, Keast RS. Antimicrobial, antioxidant and anti-inflammatory phenolic activities in extra virgin olive oil. Curr Opin Biotechnol. 2012; 23: 129-35.
- Féart C, Samieri C, Rondeau V, et al. Adherence to a Mediterranean diet, cognitive decline, and risk of dementia. JAMA. 2009; 302: 638-48.
- Quiles JL, Ochoa JJ, Ramirez-Tortosa C. Dietary fat type (virgen olive vs. Sunflower oils) affects age-related changes in DNA double-strand-breaks, antioxidant capacity and blood lipids in rats. Exp Gerontol. 2004; 39: 1189-98.
- Geelings A, López-Huertas E, Morales JC, Boza J, Jiménez J, inventors. Natural products and derivatives thereof for protection against neurodegenerative diseases. US patent 0, 236, 202. 2003 Dec 25.
- Tasset I, Pontes AJ, Hinojosa AJ, de la Torre R, Túnez I. Olive oil reduces oxidative damage in a 3-nitropropionic acid-induced Huntington’s disease-like rat model. Nutr Neurosci. 2011; 14: 106-11.
- Brouillet E, Condé F, Beal MF, Hantraye P. Replicating Huntington’s disease phenotype in experimental animals. Prog Neurobiol. 1999; 9: 427-68.
- Flohé L, Gunzler WA. Assay of glutathione peroxidase. Methods Enzymol. 1984; 105: 114-121.
- Sofi F, Macchi C, Abbate R, Gensini GF, Casini A. Effectiveness of the Mediterranean diet: can it help dalay or prevent Alzheimer’s disease? J Alzheimer Dis. 2010; 20: 795-801.
- Alemany R. Navarro MA, Vögler O, Perona JS, Osada J, Ruiz-Gutiérrez V. Olive oils modulate fatty acid content and signalling protein expression in apolipoprotein E knockout mice brain. Lipids. 2010; 45: 53-61.
- Kumar P, Kalonia H, Kumar A. Nitric oxide mechanism in the protective effect of antidepressants against 3-nitropropionic acid-induced cognitive deficit, glutathine and mitochondrial alterations in animal model of Huntington’s disease. Behav Pharmacol. 2012; 21: 217-30.
- Kumar P, Kumar A. Protective role of sertralina against 3-nitropropionc acid-induced ognitive dysfunction and redox ratio in striatum, cortex and hippocampus of rat brain. Indian J Exp Biol 2009; 47:715-22.
- Silva RH, Abílio VC, Kameda SR, et al. Effects of 3-nitropropionic acid administration on memory and hippocampal lipid peroxidation in sleep-deprived mice. Prog Neuropsychopharmacol. Biol Psychiatry 2007; 31: 65-70.
- Túnez I, Montilla P, Del Carmen Muñoz M, Feijóo M, Salcedo M. Protective effect of melatonin on 3-nitropropionic acid-induced oxidative stress in synaptosomes in an animal model of Huntington’s disease. J Pineal Res. 2004; 37: 252-6.
- Borlongan CV, Koutouzis TK, Sanberg PR. 3-Nitropropionic acid animal model and Huntington’s disease. Neurosci Lett. 1998; 251: 173-6.
- Brouillet E, Condé F, Beal MF, Hantraye P. Replicating Huntington’s disease phenotype in experimental animals. Pror Neurobiol. 1999; 59: 427-68.
- de la Cruz JP, del Río S, Arrebola MM, López-Villodres JA, Jebrouni N, González-Correa JA. Effect of virgin olive oil plus acetylsalicylic acid on brain slices damage alter hypoxia-reoxygenation in rats with type 1-like diabetes mellitus. Neurosci Lett. 2010; 471: 89-93.
- Rietjens SJ, Bast A, de Vente J, Haenen GR. The olive oil antioxidant hydroxytyrosol efficiently protects against the oxidative stress-induced impairment of the NO response of isolated rat aorta. Am J Physiol Heart Circ Physiol. 2007; 292: 1931-36.
- Tabernero A, Lavado EM, Granda B, Velasco A, Medina JM. Neuronal differentiation is triggered by oleic acid synthesized and released by astrocytes. J Neurochem. 2001; 79: 606-16.
- Tello Hernández M de la V. Efectos del ácido oleico en la migración neuronal y en la formación de sinapsis [tesis doctoral]. Salamanca: Repositorio Documental Gredos, Universidad de Salamanca; 2008.
- Raederstorff D. Antioxidant activity of olive polyphenols in humans: a review. Int J Vitam Nutr Res. 2010; 79: 152-65.
- de la Torre R. Bioavailability of olive oil phenolic compounds in humans. Inflammopharmacology. 2008; 16: 245-7.
- Sandhir R, Mehrotra A, Kamboj SS. Lycopene prevents 3-nitropropionic mitochondrial oxidative stress and dysfunctions in nervous system. Neurochem Int. 2010; 57: 579-87.
- Kumar P, Paddi SS, Naidu PS, Kumar Al. Effect of resveratrol on 3-nitropropionic acid-induced biochemical and behavioural changes: neutro protection mechanisms. Behav Pharmacol. 2006; 17: 485-92.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Isaac Túnez. email: fm2tufii@uco.es