Aula de Oncología
Enfermedad tromboembólica venosa y cáncer: una asociación frecuente
Venous thromboembolic disease and cancer: a common association
Actual. Med. 2019; 104: (807): 128-130 DOI: 10.15568/am.2019.807.ao01
Enviado: 18-07-2019
Revisado: 22-07-2019
Aceptado: 24-08-2019
RESUMEN
La enfermedad tromboembólica venosa constituye una entidad clínica compleja y cuya aparición se encuentra incrementada en la población con el diagnóstico previo de un proceso oncológico. En este sentido, la propia actividad biológica del cáncer contribuye al desarrollo y la propagación del fenómeno trombótico dando lugar a un incremento de la morbimortalidad asociada al cáncer. El objetivo del presente trabajo consiste en analizar las bases fisiopatológicas, la epidemiología y los principales modelos de predicción de riesgo, así como ofrecer un enfoque práctico acerca de la profilaxis y el tratamiento de esta complicación. La realización de este trabajo puede contribuir a la mejora del manejo y del seguimiento de estos pacientes tanto a nivel hospitalario como en los Centros de Atención primaria.
Palabras clave: Enfermedad tromboembólica venosa; cáncer; modelo de Khorana; heparina de bajo peso molecular
ABSTRACT
Vein thromboembolic disease constitutes a complex clinical entity and its appearance is increased in the population with a previous diagnosis of cancer. In this sense, the own biological actvity of cancer contributes to the development and dissemination of the thrombotic phenomena and, thus, leading to an increase in cancer-associated morbimortality. The aim of this study is to analyze the physiopathological basis, epidemiology, risk prediction models and to show a practical approach to the prophylaxis and treatment of this cancer complication. In this regard, this paper can contribute to the improvement in therapeutics and follow-up of these patients at hospital and primary care levels.
Keywords: Thromboembolic vein disease; cancer; Khorana model; low molecular weight heparin.
Leer Artículo Completo
INTRODUCCIÓN
La asociación entre enfermedad tromboembólica venosa (ETEV) y cáncer fue descrita por vez primera por Jean-Baptiste Bouillaud en el año 1823 (1); más tarde, en el año 1865 Armand Trousseau describía esta asociación de una manera más detallada (2), dando nombre al síndrome de Trousseau como una entidad de carácter paraneoplásico consistente en la activación sistémica de la coagulación (3-4).
La ETEV es una complicación común en los pacientes con cáncer, siendo la segunda causa de mortalidad en estos (5) y en ocasiones, la primera manifestación de una neoplasia oculta subyacente (6). El 20% de los casos de ETEV ocurren en pacientes oncológicos (4) y el riesgo de aparición en este subgrupo está incrementado de cuatro a siete veces en comparación con la población general, así como la aparición de recurrencias que se ha estimado tres veces superior respecto a la ETEV no asociada al cáncer (3) (6).
Aunque las manifestaciones más frecuentes de la ETEV asociada al cáncer son la trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP), también es posible la afectación de otros territorios venosos como el esplácnico o el de los miembros superiores.
FISIOPATOLOGÍA
La fisiopatología de la trombosis venosa asociada al cáncer comporta, en la mayoría de los casos, la participación de los componentes de la triada de Virchow, es decir, estasis del flujo sanguíneo, alteraciones de la pared endotelial e hipercoagulabilidad (4).
Existe una relación bidireccional entre la progresión tumoral, la activación de la coagulación y la inflamación. En primer lugar, la inflamación estimula la activación de la coagulación y la trombosis debido a una expresión aumentada de moléculas de adhesión y procoagulantes en las células endoteliales y monocitos. Por otro lado, los factores de la coagulación activados VIIa, Xa y la trombina modulan la expresión génica a través de receptores de proteasa activados (vía de las PAR), con la consecuente producción de citocinas proinflamatorias (IL-6, IL-8 e IL-10) (4). Respecto a la progresión tumoral, el factor tisular (FT) desempeña un papel importante, su incremento en estos casos es secundario a la aparición de mutaciones en K-RAS y p53 en la célula tumoral que, como consecuencia, promueven la liberación de micropartículas cargadas del mismo. El incremento de FT estimula la angiogénesis y, por lo tanto, el crecimiento tumoral y su diseminación (6).
El incremento plaquetario común en los procesos oncológicos y su activación está implicado también en la trombosis, a través de los fosfolípidos de superficie plaquetaria que generan trombina, la interacción de la glicoproteína plaquetaria Ib (GPIb) con el factor von Willebrand y el incremento de P-selectina, contribuyendo esta última a la inflamación (6).
FACTORES DE RIESGO
La etiología de la ETEV en los pacientes con cáncer tiene un origen multifactorial. De manera tradicional, la clasificación de los factores de riesgo para su aparición se divide en función de los siguientes tres criterios:
Factores de riesgo dependientes del paciente, como la edad avanzada, que da lugar a una reducción de la actividad física y a un incremento de la inmovilidad, el sexo femenino, la obesidad, definida por un índice de masa corporal (IMC) >35 kg/m2, la raza negra, la presencia de comorbilidades (infección, enfermedad pulmonar obstructiva crónica, insuficiencia cardiaca o renal), así como los antecedentes de ETEV y/o trombofilia conocidas (5).
Factores de riesgo dependientes del tumor, como son la localización del mismo (páncreas, sistema nervioso central, estómago, riñón, pulmón y tumores hematológicos y ginecológicos), el estadio avanzado, el tiempo desde el diagnóstico (el riesgo de ETEV es mayor dentro de los tres primeros meses tras el diagnóstico), el subtipo histológico y la existencia de metástasis (4).
Factores de riesgo dependientes del tratamiento, como el empleo de regímenes de quimioterapia que, de manera global, ocasionan un incremento del riesgo de ETEV entre seis y siete veces superior respecto a la población general. Además, el uso de ciertos cistostáticos conlleva un riesgo trombótico mayor, este es el caso del cisplatino, la L-asparraginasa, la talidomida, la lenalidomida y el tamoxifeno, entre otros. Por otro lado, las intervenciones quirúrgicas, la inmovilidad que comportan los períodos de hospitalización, así como la inserción de catéteres centrales y el uso de agentes eritropoyéticos y/o antiangiogénicos también son factores de riesgo de ETEV asociados al tratamiento oncológico (5).
PROFILAXIS Y TRATAMIENTO
En el tratamiento de la ETEV asociada al cáncer se recomienda, en primer lugar, evaluar el riesgo de los pacientes que se encuentran en régimen ambulatorio con el fin de identificar aquellos que pudieran beneficiarse de la instauración de un tratamiento profiláctico.
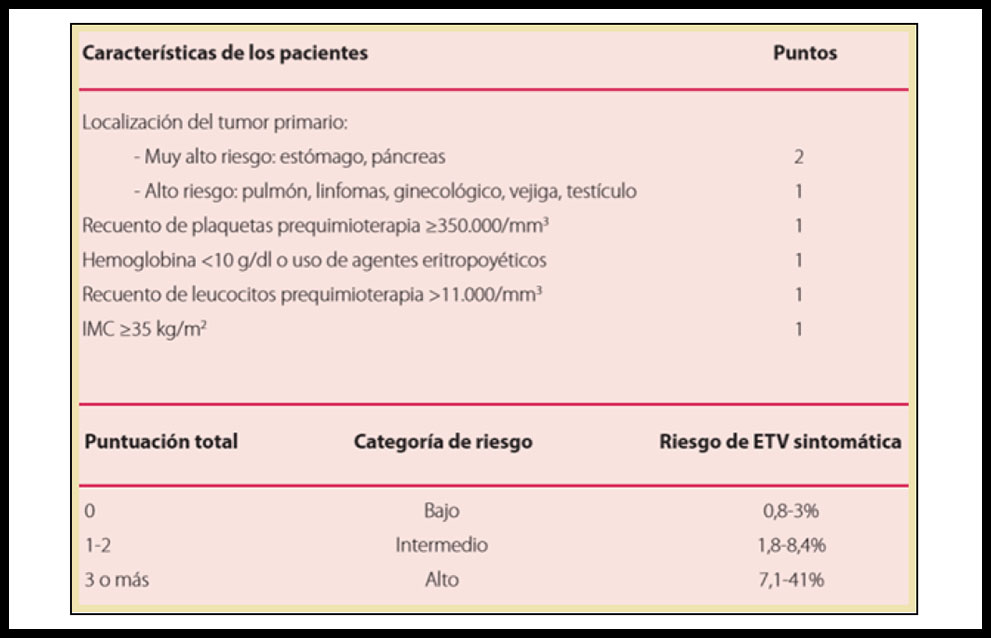
Para ello, el único modelo predictivo que se ha validado de manera extensa hasta el momento es el índice de Khorana (tabla 1) (7). Este modelo para la predicción de la aparición de ETEV en pacientes ambulatorios con tratamiento quimioterápico incluye cinco parámetros: la localización del tumor primario, el recuento de plaquetas previo al inicio de la quimioterapia, los niveles de hemoglobina o el uso de agentes eritropoyéticos, el recuento leucocitario y el IMC. De este modo, los pacientes se estratifican en subgrupos de riesgo bajo, intermedio y alto. El modelo predictivo de Khorana debe ser utilizado con precaución y valorar además de los parámetros anteriores, el riesgo hemorrágico que presentan estos pacientes, así como la utilidad de otros nuevos modelos aún no validados que incluyen biomarcadores como el dímero-D, perfiles génicos de riesgo para ETEV y características específicas del tumor (5).
Tabla 1. Modelo de predictivo de Khorana et al (7). Tomado del II Documento de Consenso de la Sociedad Española de Oncología Médica (SEOM) sobre la Enfermedad Tromboembólica en paciente con Cáncer (9).
En relación con el tratamiento anticoagulante en la fase aguda de la enfermedad, es decir, una vez se ha instaurado la trombosis venosa, la evidencia disponible hasta la el momento recomienda el empleo de heparina de bajo peso molecular (HBPM) por varias razones: su perfil farmacocinético más estable, su mayor eficacia, menores costes, así como por la facilidad para su manejo en comparación con la heparina no fraccionada (HNF). El empleo de HNF quedaría limitado a pacientes con insuficiencia renal severa, dado su metabolismo fundamentalmente a nivel hepático, su menor tiempo de vida media, así como la posibilidad de reversión con sulfato de protamina (8-9).
Por otro lado, el tratamiento a largo plazo de la ETEV asociada al cáncer se basa también en el empleo de HBPM. En este sentido, los antagonistas de la vitamina K (AVK) presentan múltiples limitaciones como la necesidad de monitorizar su efecto, una mayor vida media, la existencia de numerosas interacciones de carácter farmacológico y dietético, así como problemas relacionados con su ingesta y absorción, como consecuencia de los efectos secundarios que ocasiona el tratamiento oncológico (mucositis, náuseas y diarrea, entre otros). Por su parte, los anticoagulantes orales de acción directa (ACOD), no están recomendados, de manera general, en el tratamiento a largo plazo de la ETEV en este contexto, y en la actualidad son necesarios más estudios para definir con precisión su indicación (10).
Por último, el tratamiento anticoagulante debe mantenerse al menos durante seis meses desde la aparición del evento trombótico. De manera posterior, la actitud a seguir depende de varios factores, entre ellos, la situación en que se encuentra la enfermedad oncológica y el tipo de tratamiento empleado. Las recomendaciones acerca de la duración del tratamiento deben, por lo tanto, ser individualizadas y se recomienda extender el mismo en los pacientes con cáncer activo o con determinados tratamientos que incrementan el riesgo de recurrencias (4). Si pese al tratamiento establecido tiene lugar la recurrencia del evento trombótico, las recomendaciones contemplan escalar entre un 20%-25% la dosis en aquellos pacientes que recibieran HBPM y, en aquellos tratados con AVK, el cambio a HBPM a dosis completas (11-12).
CONCLUSIONES
La fisiopatología del cáncer y la trombosis venosa se encuentran asociadas. Existe una relación bidireccional entre la progresión tumoral, la activación de la coagulación y la inflamación.
Los factores de riesgo para la aparición de la trombosis asociada al cáncer se clasifican en factores dependientes del paciente, dependientes de las características del propio tumor y, por último, dependientes del tipo de tratamiento instaurado.
El único modelo predictivo para el riesgo del desarrollo de un evento trombótico en pacientes ambulatorios en tratamiento con quimioterapia es el modelo de Khorana.
En relación con la profilaxis y el tratamiento de la enfermedad tromboembólica venosa asociada al cáncer, las guías recomiendan el empleo de heparina de bajo peso molecular tanto en la fase aguda como a largo plazo.
En la actualidad, son necesarios más estudios para definir la indicación de los anticoagulantes orales de acción directa en el tratamiento de la trombosis venosa asociada al cáncer.
REFERENCIAS BIBLIOGRÁFICAS
- JB B, S. B. De l’Obliteration des veines et de son influence sur la formation des hydropisies partielles: consideration sur la hydropisies passive et general. Arch Gen Med. 1823;1:188–204.
- Trousseau A. Phlegmasia alba dolens. Clin Med Hotel Paris. 1865;3:654–712.
- Connolly GC, Francis CW. Cancer-associated thrombosis. Am Soc Hematol Educ Program [Internet]. 2013;2013(1):684–91. Available from: https://www.ncbi.nlm.nih.gov/pubmed/24319253
- González Porras, JR. – Páramo Fernández, J. A. – Mateo Arranz J. Hemostasia y trombosis. Manual práctico. [Internet]. ARÁN EDICIONES, editor. Sociedad Española de Hematología y Hemoterapia; 2018. Available from: https://www.seth.es/index.php/component/content/article/66-publicaciones/1330-hemostasia-y-trombosis-manual-practico.html
- Razak NBA, Jones G, Bhandari M, Berndt MC, Metharom P. Cancer-associated thrombosis: An overview of mechanisms, risk factors, and treatment. Cancers (Basel). 2018;10(10):1–21.
- Ortega Soto I, Román álvarez MT. Hemostasia y Trombosis en la práctica clínica [Internet]. ERGON, editor. Sociedad Española de Hematología y Hemoterapia; 2018. Available from: https://www.seth.es/index.php/seth/la-sociedad/actividades-auspiciadas/2018/1283-hemostasia-y-trombosis-en-la-practica-clinica.html
- Khorana AA, Kuderer NM, Culakova E, Lyman GH, Charles W. Francis. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood [Internet]. 2008;111(10):4902–8. Available from: http://www.bloodjournal.org/content/111/10/4902.long?sso-checked=true
- Pachón V, Trujillo-Santos J, Domènech P, Gallardo E, Font C, González-Porras JR, et al. Cancer-Associated Thrombosis: Beyond Clinical Practice Guidelines—A Multidisciplinary (SEMI–SEOM–SETH) Expert Consensus. TH Open. 2018;02(04):e373–86.
- SEOM. II Consenso sobre la Enfermedad Tromboembólica Venosa en pacientes con Cáncer [Internet]. 2014. 139 p. Available from: https://seom.org/seomcms/images/stories/recursos/II_Consenso_SEOM_enf_tromboembolica_cancer.pdf
- Lee AYY, Peterson EA. Treatment of cancer-associated thrombosis. Blood. 2013;122(14):2310–7.
- Lyman GH, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, Balaban EP, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2013;31(17):2189–204.
- Elyamany G, Alzahrani AM, Eman B. Cancer-Associated Thrombosis: An Overview. Clin Med Insights Oncol. 2014;8:129–37.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Julia Morán Sánchez. Servicio de Hematología y Hemoterapia. Hospital Universitario Puerta del Mar. Avda. Ana de Viya, 21 · 11009 Cádiz, España. E-mail: juliamorsan@gmail.com Tlf. :+34 958243515