Revisión
Técnicas quirúrgicas actuales en el cáncer de recto
Current surgical techniques in rectal cancer
Actual. Med. 2019; 104: (808): 175-181 DOI: 10.15568/am.2019.808.re01
Enviado: 21-03-2019
Revisado: 01-07-2019
Aceptado: 04-12-2019
RESUMEN
El cáncer de recto es actualmente una de las enfermedades que implican una mayor morbimortalidad en la sociedad, tanto para la persona que lo sufre como para la esfera que lo rodea. La evolución en este tipo de tumores permiten abandonar el concepto clásico de grandes incisiones y extensas resecciones, para acercarnos al abordaje mínimamente invasivo, y a realizar la resección que sea únicamente necesaria, buscando preservar la integridad esfintérica en el paciente, y tratando de evitar en la medida de lo posible la confección de ostomías.
La mayoría de las investigaciones que se realizan sobre el cáncer de recto, van encaminadas a la mejora en los tratamientos complementarios a la cirugía, como los tratamientos quimioterápicos neoadyuvantes, y los fármacos posteriores a la cirugía, es decir, la quimioterapia adyuvante. Únicamente un tercio de los estudios que se llevan a cabo son para mejorar la técnica quirúrgica. En este apartado, la aparición de la cirugía laparoscópica, el uso de dispositivos a través de orificios naturales para realizar cirugía local, la aparición de la cirugía combinada TaTME, y el auge de la cirugía robótica, parecen ser la antesala de lo que se desarrollará en un futuro respecto a las mejoras quirurgicas.
En esta revisión, queremos poner de manifiesto un resumen del tratamiento quirúrgico del cáncer de recto, haciendo especial hincapié en las nuevas técnicas y avances, con una breve reseña histórica y anatómica, sin olvidar la importancia y seguridad para el paciente, tanto en la misma cirugía, como en los resultados oncológicos posteriores.
Palabras clave: Revisión; Cancer de recto; Tratamiento; Cirugía; Actualización.
ABSTRACT
Rectal cancer is currently one of the diseases that imply greater morbidity and mortality in society, both for people suffering and for the people around. The evolution in this type of tumors allows us to leave the classic concept of large incisions and extensive resections towards the minimally invasive approach, and to perform the resection that is only necessary, seeking to preserve the sphincteric integrity in the patient, and trying to avoid as much as possible ostomies.
Most of rectal cancer research is aimed to improving complementary treatments to surgery, such as neoadjuvant chemotherapeutic treatments, and post-surgery drugs. Only one third of the studies carried out are focused on improvig the surgical technique. In this section, the appearance of laparoscopic surgery, the use of devices through natural holes to perform local surgery, the appearance of TaTME combined surgery, and the rise of robotic surgery, seem to be the prelude to what will be developed. in the future regarding surgical improvements.
In this review, we want to highlight a summary of the surgical treatment of rectal cancer, with special emphasis on new techniques and advances and also a brief historical and anatomical review, also including the importance and safety for the patient both in the surgery and subsequent cancer follow-up.
Keywords: Revision; Rectal cancer; Treatment; Surgery; Update.
Leer Artículo Completo
INTRODUCCIÓN
El cáncer constituye uno de los retos del siglo XXI, tratándose de la enfermedad que supone una mayor morbimortalidad en la sociedad, no solo a nivel orgánico, sino también por los estigmas sociales y funcionales estipulados en torno a él, donde se ven incluidos no solo la persona que lo sufre, sino la esfera social y familiar que lo acompaña.
En España el número total de casos nuevos de cáncer en 2015 fueron de 247.771 (148.827 en varones y 98,944 en mujeres), siendo el cáncer colorrectal el más diagnosticado (1)
El cáncer de recto constituye una entidad distinta, con menor incidencia que el cáncer de colon, pero con la problemática de establecer su incidencia real, ya que en muchas ocasiones se infraestima al ser agrupado dentro del volumen de cáncer colorrectal sin ninguna subdivisión. Respecto a datos del año 2014, hubo un total de 8.284 casos en varones y unos 4.384 casos en mujeres, con un aumento de incidencia respecto a 2003 del 12,9% en varones, y del 4,5% en mujeres (2).
Dada la problemática social que supone esta patología, con una incidencia cada vez mayor, y dentro de esta, la mejora que parece que se está presentando respecto al tratamiento quirúrgico, debemos tener en cuenta y actualizar el concepto clásico quirúrgico de grandes incisiones, además de considerar que al tratarse de una patología cada vez más prevalente, cualquier personal relacionado con el ámbito de la salud, puede llegar a tener que enfrentarse a esta entidad, por lo que el desarrollar y explicar las novedades y términos que se utilizan a día de hoy, así como los aspectos quirúrgicos en los que se basan, puede ser de un interés general y ser útil en el ejercicio profesional, de ahí nuestro interés en revisar las técnicas quirúrgicas actuales en el cáncer de recto.
SÍNTESIS DE LA REVISIÓN
2.1 Anatomía del Recto
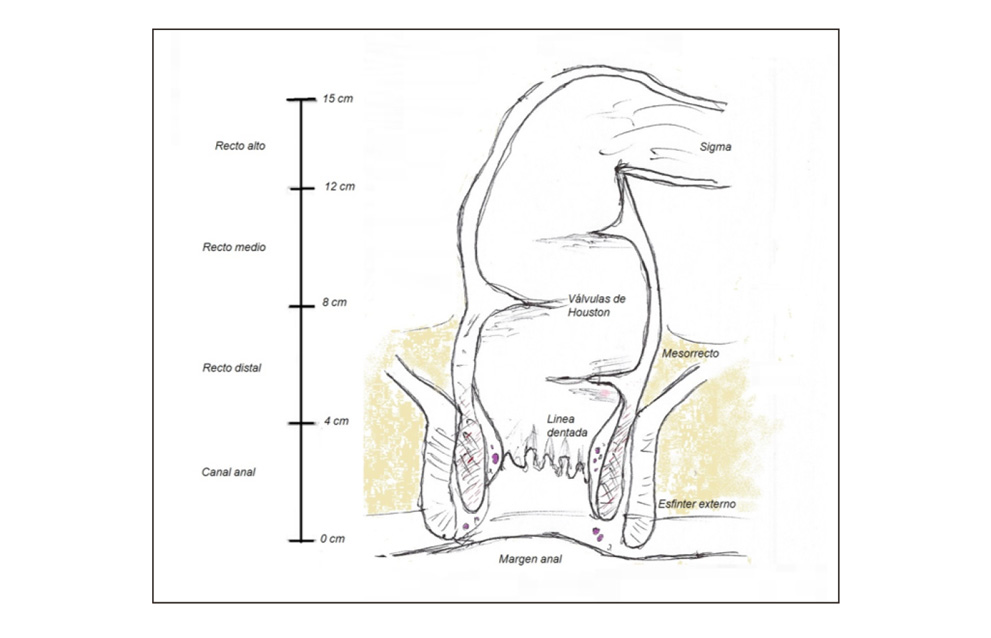
Anatómicamente el recto constituye el segmento terminal del tubo digestivo y está compuesto por el recto pélvico (ampolla rectal), con un tamaño de unos 12-15cm y el conducto anal, que mide unos 3-4 cm y corresponde a la región de los esfínteres anales. (3) (figura 1)
Figura 1.
- Localización. Se encuentra ubicado en la pelvis, constituyendo su pared posterior el hueso sacro y el cóccix. Sus relaciones anatómicas varían en función del sexo, ya que en el caso de los varones, su cara anterior se encuentra en contacto con la vejiga, vesículas seminales y próstata, y en el caso de las mujeres su cara anterior se encuentra en contacto con la pared vaginal posterior y el cérvix (3).
- Vascularización Arterial. La vascularización proviene de la arteria rectal superior, rama de la mesentérica inferior, que irriga la cara anterior del recto excepto el canal anal. En ocasiones esta región también presenta vascularización a través de la arteria sacra media, una rama terminal de la aorta. (4) La arteria hemorroidal inferior o rectal inferior es la encargada de la irrigación del canal anal.
- Vascularización venosa. Su drenaje venoso lo constituye fundamentalmente la vena hemorroidal superior, que desemboca en la mesentérica inferior (conformando posteriormente la porta), así como la vena hemorroidal media y la vena hemorroidal inferior, que drenan directamente a la vena cava inferior a través de las iliacas. (3)
- El peritoneo, es el tejido que recubre la cara anterior y lateral del recto hasta su mitad superior, denominándose esta porción, recto intraperitoneal. La mitad inferior, que se encuentra por debajo de un repliegue de peritoneo, constituye el recto infraperitoneal.
- Mesorrecto. El mesorrecto, comienza a aparecer en la literatura quirúrgica a partir de 1982 (5). Se trata de un tejido celulograso, que recubre al recto de forma lateral y posterior, hasta los 2-3 últimos centímetros de recto pélvico.
Esta estructura, es de gran importancia a día de hoy para el abordaje del cáncer, ya que los tumores rectales que atraviesan la pared, se suelen extender por el mesorrecto (6). Dicha extensión perirrectal radial, presenta una importancia respecto a la causa del número de recidivas locorregionales. (7). La vascularización sanguínea y linfática discurre a través del mesorrecto en dirección ascendente, aunque esta puede estar desestructurada en caso de existir tumoración.
2.2 Cirugía del cáncer de Recto
2.2.1 TNM
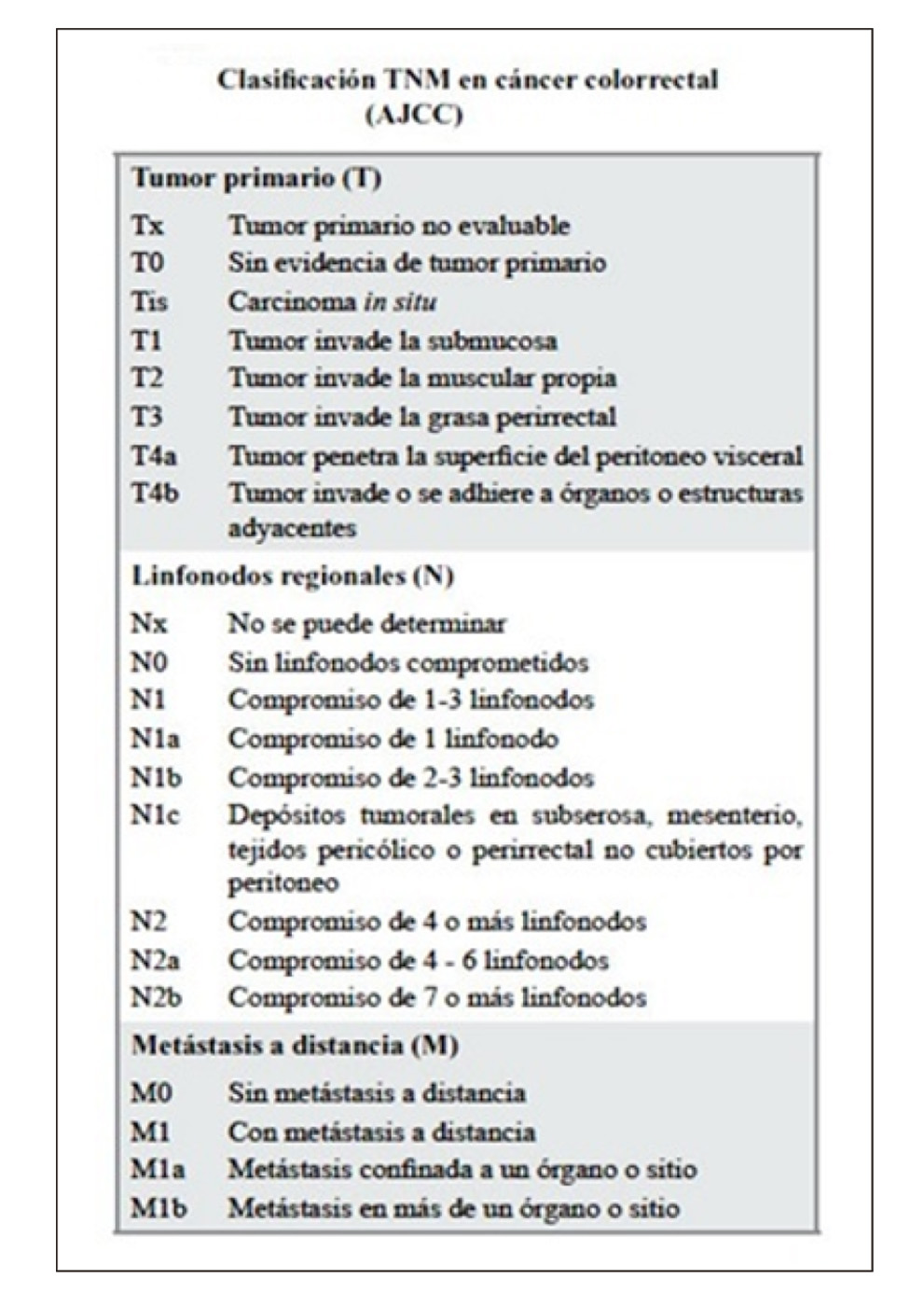
Los cánceres de recto se clasifican utilizando el TNM (figura 2) propuesto por la American Joint Committee of Cancer (8). Dentro de esta tenemos que diferenciar el cTNM, que es previo al tratamiento o cirugía, y el pTNM, que es la clasificación patológica una vez que se analiza el espécimen final tras la resección del mismo. Tras establecer una estadificación oncológica, se plantean los distintos tratamientos. La cirugía constituye el eje sobre el que se articula el tratamiento curativo del adenocarcinoma rectal (9), utilizándose como tratamiento único, o en combinación con quimioterapia o radioterapia en función del estadio tumoral.
Figura 2.
2.2.2. Principios para la resección tumoral
Cualquier modalidad quirúrgica implica la resección amplia del cáncer, con márgenes quirúrgicos libres o negativos para enfermedad tumoral a nivel proximal, distal y radial.
- Margen proximal. Se establece una distancia correcta de seguridad libre de enfermedad, con un margen proximal negativo mínimo de 5 cm. (10).
- Margen distal. La afectación postoperatoria del margen distal se asoció, inicialmente, a una tasa de recurrencia local del tumor muy elevada, así como con una disminución de la supervivencia a los 5 años, incluso a pesar de radioterapia adyuvante (11). El principal problema a la hora de obtener un margen distal amplio, negativo para enfermedad, es el intento de preservar del aparato esfinteriano. Por ejemplo, para los cánceres situados por encima del final del mesorrecto, se recomienda un margen distal mínimo de 2 cm (12), sin embargo, para los cánceres situados por debajo del mesorrecto, se puede considerar valido un margen distal mínimo de hasta de 1 cm. (12)
- Márgenes radiales. Los márgenes radiales o circunferenciales presentan la misma importancia que los márgenes distales. Se requiere un margen circunferencial histológico mayor de 1 mm libre de enfermedad (13). Un margen radial afecto es un predictor por sí mismo de recidivas locales y de disminución de la supervivencia (14). En la práctica clínica, un paciente en cuyo estudio preoperatorio el tumor se encuentre a nivel de la fascia mesorrectal, implica de forma directa una afectación de márgenes radiales, por lo que se debe barajar el tratamiento neodyuvante para reducir la afectación de dichos márgenes a la hora de la cirugía (15).
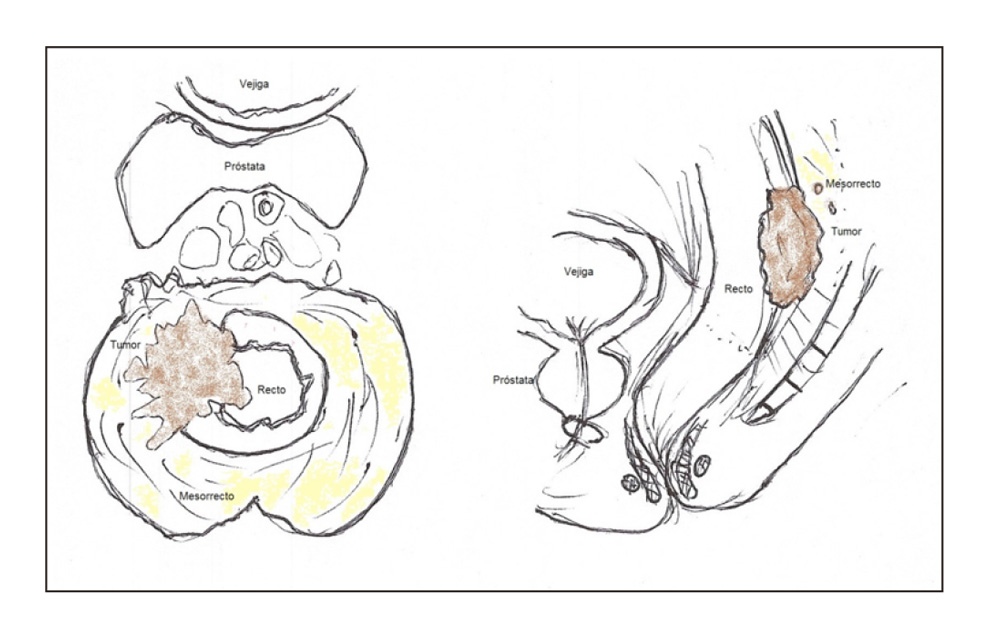
- Escisión total del mesorrecto. Consiste en la exéresis del tejido linfograso perirrectal incluyendo los márgenes laterales y circunferenciales (figura 3). Nos permite preservar los nervios autonómicos y reducir el riesgo de una hemorragia presacra. La extirpación del mesorrecto hacia el suelo pélvico solo es necesaria en cánceres del tercio medio al tercio inferior, ya que en los de recto superior solo se necesita extirpar unos 5 cm por debajo del tumor primario y no el mesorrecto en su totalidad (16).
Figura 3.
El principal beneficio, es que la escisión total del mesorrecto se asocia con un mejor control local de la enfermedad así como con una mayor supervivencia (17), además de disminuir la disfunción genitourinaria al respetar en mayor grado los nervios autonómicos (18). Esta mejoría en las tasas de recidiva local con escisión total del mesorrecto, es atribuible a una mayor retirada de depósitos tumorales microscópicos, así como, una menor diseminación tumoral durante la disección (19).
- Disección de ganglios linfáticos regionales. Se realiza con fines de estadificación, para control local o recidiva tumoral. El número de ganglios linfáticos requeridos para determinar con exactitud la estadificación del cáncer de recto no ha sido descrito aunque, según la Comprehensive Cancer Network (NCCN) el punto de referencia se establece en 12 ganglios como medida de calidad para la cirugía de cáncer colorrectal (20). Existen excepciones, como el caso en el que el paciente haya recibido tratamiento neoadyuvante previo, donde puede considerarse un número de ganglios menor. (21)
2.2.3 Técnicas quirúrgicas
La primera extirpación con éxito de cáncer del recto fue llevada a cabo por Lisfranc (1790-1847), cirujano de la Pitié en París(22) sentando las bases para el posterior desarrollo de la resección perineal de recto por Lockhart-Mummery (1875-1957) del St. Mark’s Hospital de Londres en 1907 y la resección anterior de recto con estoma abdominal permanente descrita por Hartman (1860-1952) en 1923. En las últimas décadas se han aportado nuevas técnicas quirúrgicas con preservación de esfínteres y cirugías como la extirpación total anal con anastomosis coloanal transanal de Parks, desarrollada en 1972, y las anastomosis mediante engrapadoras circulares, así como la introducción de la “extirpación total de mesorrecto” descrita por Helad en 1982 que han ocasionado una renovación en el tratamiento clásico del cáncer de recto. Si bien sus principios de resección tumoral, se siguen manteniendo, la forma de conseguirlos se ha actualizado. (22)
A continuación describiremos las distintas técnicas incorporadas en los últimos años así como sus avances y beneficios.
Escisión Local
La escisión o extirpación local, constituye una terapia óptima para los pacientes con diagnóstico tumoral en fases tempranas, sin características de alto riesgo, o bien para los pacientes con enfermedades avanzadas que no son aptos para cirugías radicales, o que rechazan cirugías abdominales. (23) Con ella se realiza la extirpación del tumor y del tejido rectal adyacente, sin fragmentación tumoral, pero no permite la evaluación óptima de los ganglios linfáticos mesorrectales.
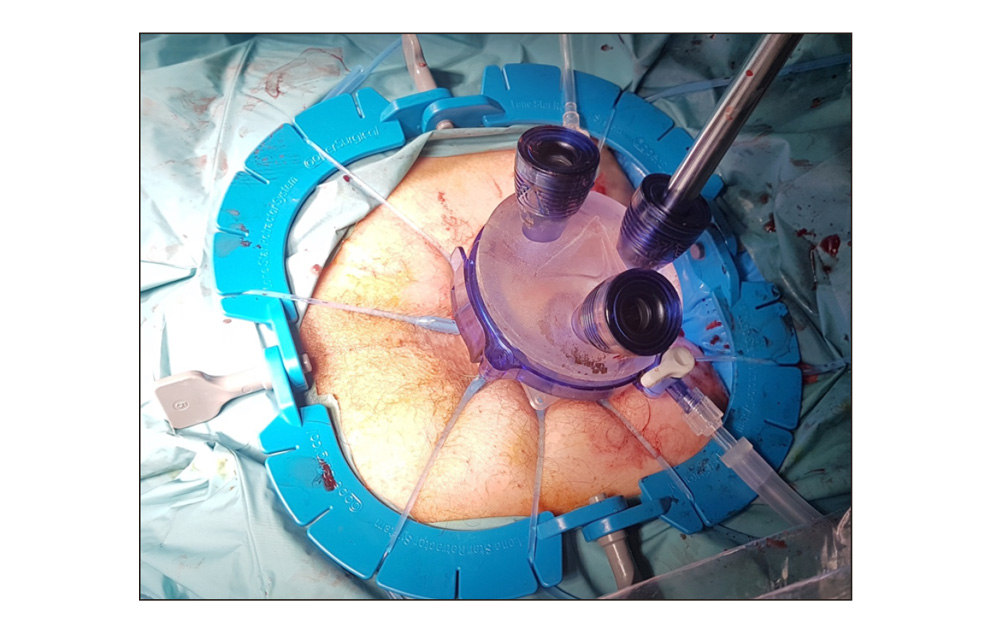
- Cirugía endoscópica transanal. Es una técnica que puede desarrollarse través de tres modalidades: Microcirugía Transanal Endoscópica (TEM), Operación endoscópica transanal (TEO) o bien Cirugía Mínimamente invasiva transanal (TAMIS). En comparación con la escisión transanal clásica, presenta una mejor visualización, exposición y acceso, lo que se traduce en menores tasas de fragmentación de muestras, márgenes positivos o recidivas. (24,25). De las tres modalidades, uno de los más usados es el TAMIS, desarrollada en 2009, que se define como un puerto multicanal introducido transanalmente (figura 4) que permite el uso del instrumental convencional para la laparoscopia con el propósito de realizar cirugía endoluminal, permitiendo la resección de la pared rectal completa y del mesorrecto adyacente
Figura 4.
Los resultados de la escisión local dependen de la etapa tumoral rectal. Para estadios T1 se asocia con baja recidiva (8%) y buena supervivencia a largo plazo (26). Para T2 también presenta una supervivencia óptima si los pacientes han recibido tratamiento neodyuvante previo (27).
Actualmente, en Estados Unidos y Europa, se recomienda la escisión local en paciente con T1N0 rectal, con independencia de neoadyuvancia y en pacientes T2N0 que no son aptos para Cirugía abdominal o como parte de ensayos clínicos, así como para cirugías paliativas (27).
Cirugía Abdominal no Laparoscópica
- Resección anterior baja de recto (RAR). Consiste en un procedimiento con preservación de esfínteres que implica la resección total o parcial del recto hasta un nivel en el que el borde distal está libre de cáncer, seguido de una anastomosis primaria entre el colon descendente y el recto (anastomosis colorrectal), o bien con el esfínter anal (anastomosis coloanal). Constituye la técnica más utilizada a día de hoy, siempre y cuando sea posible. (28) En ocasiones asocia un estoma de derivación temporal (ileostomía) si la anastomosis es baja (menor de 5 cm) o si el paciente ha sido sometido a tratamiento neoadyuvante con radioterapia, con el objetivo de disminuir las complicaciones en el caso de una fuga anastomótica (29). Cabe destacar aquí una de las complicaciones más temidas en la resección anterior de recto, que es la dehiscencia de anastomosis. Se trata de la falta de cohesión en la anastomosis realizada, es decir, el déficit de cicatrización de la unión rectal, que puede desembocar en el paso de contenido intestinal hacia la cavidad abdominal llegando a poder originar una peritonitis. Una de los avances incorporados recientemente, es el uso de la fluorescencia para la valoración de la vascularización intestinal en las anastomosis mediante el uso de verde de indocianina intravenosa. Otorga una información precisa sobre la perfusión tisular y aporte sanguineo de los extremos usados para la anastomosis. Se trataría así, de un método más objetivo y preciso que la mera visualización macroscópica de los cabos de sección y cuyo beneficio deriva en prevenir la fuga anastomótica (30)Por otro lado, otra de las complicaciones que pueden presentar los pacientes sometidos a anastomosis colorrectales es el síndrome de resección anterior de recto, un patrón errático de defecación, que incrementa el número de movimientos intestinales, asociando urgencia defecatoria, tenesmo, defecación obstructiva e incontinencia. (31).
- Amputación abdominoperineal. Fue tradicionalmente la cirugía de elección para los cánceres de recto. A día de hoy, está siendo reemplazada por procedimientos ahorradores de esfínteres gracias al uso de terapias neoadyuvantes o a mejoras técnicas como las endograpadoras o la laparoscopia.La decisión de una amputación abdominoperineal, suele estar relacionada con pacientes que presentan tumoraciones a pocos centímetros del margen anal o que infiltran musculatura esfintérica (28). También es un tratamiento de elección en pacientes con trastornos diarreicos previos, o con una mala continencia preoperatoria, donde un síndrome de resección anterior baja podría limitar aún más su calidad de vida.
Cirugía abdominal Laparoscópic
En España, los primeros procedimientos laparoscópicos relacionados con el cáncer colorrectal se realizaron a finales de 1991, donde el Dr. Rodero y el Dr. Cuesta, realizaron una resección de tumor apendicular y una sigmoidectomía simultánea por abordaje laparoscópico. (32)
En 1994 se produjo una ralentización, incluso suspensión, de los programas de abordaje laparoscópico para el cáncer colorrectal, debido a la publicación de un artículo en la revista Lancet donde se evidenciaba la aparición de metástasis en las incisiones de los trocares (port-site metastases) (33).
Finalmente en 2002, se publica nuevamente en Lancet el estudio Barcelona, que demostraba que el abordaje laparoscópico era seguro, con mayores ventajas respecto al abordaje abierto, incluso se apreciaba mayor supervivencia en tumores de estadio III respecto al abordaje abierto.(34)
La cirugía laparoscópica en el cáncer de recto es controvertida por su complejidad técnica, sus relaciones anatómicas, su continuidad con el aparato esfinteriano y por la necesidad de realizar una escisión total del mesorrecto con márgenes íntegros. Todo estos elementos, junto con la incidencia inicial de implantes tumorales en los orificios de los trocares (33), hicieron que hasta que no existieran estudios lo suficientemente controlados y seguros (34), no se consolidase como técnica a realizar.
Aparte de la dificultad técnica y anatómica, existen otras dificultades en el abordaje laparoscópico (figura 5, figura 6), como serían:
Figura 5.
Figura 6.
- La curva de aprendizaje es mucho mayor que la de procesos de abordaje abierto. Esto deriva en la demora de los cirujanos para utilizar este abordaje de forma rutinaria. Algunos estudios indicaban incluso, que la recidiva local de cáncer de recto era mayor durante el aprendizaje del cirujano (35).
- Dificultades anestésicas. Los abordajes laparoscópicos implican una duración mayor de la cirugía que los laparotómicos. El aumento de presión intraabdominal por la insuflación y difusión de C02, así como la posición de Trendelemburg del paciente para la laparoscopia, se traduce en una dificultad añadida para la ventilación mecánica del paciente durante la anestesia, así como una alteración en el retorno venoso del mismo (36).
- Coste. El proceso laparoscópico incrementa tanto el tiempo quirúrgico como el precio de la cirugía, ya que los requerimientos tecnológicos son más caros que en un proceso abierto. Este aumento en el gasto del sistema sanitario se iguala a largo plazo con el abordaje abierto, debido al acortamiento de la recuperación social del paciente y la menor estancia hospitalaria (37).
La controversia existente en la cirugía laparoscópica, viene acaecida por los beneficios que parece presentar respecto al abordaje abierto, con igualdad respecto a la escisión total de mesorrecto y la presencia de márgenes circunferenciales libres de enfermedad. Las ventajas que presentan son:
- Facilita la disección y mejora la visión en los pacientes obesos y en pacientes con pelvis estrechas. Así mismo, facilita la movilización del ángulo esplénico, necesaria en el caso de la realización de una anastomosis colorrectal sin tensión.
- Disminución del dolor postoperatorio. Puede tratarse de una de las mejoras más notables de la laparoscopia. Existe una diferencia sustancial respecto a la cicatriz y área de incisión de un abordaje respecto a otro, con una menor agresión tisular al acceder a la cavidad peritoneal en comparación con la cirugía abierta. (34,38)
- Íleo paralitico. Se denomina íleo paralitico a la disminución de movilidad del tubo digestivo, con un cese del peristaltismo, una dilatación de las asas del intestino, y una disminución de la evacuación de su contenido. En el abordaje laparoscópico parece existir un inicio de la actividad intestinal más rápido en comparación con el abordaje abierto, probablemente debido a que se produce una menor movilización de las asas de intestino por parte del cirujano, al igual que no se produce la exposición de las asas a la temperatura ambiente ni la desecación de las mismas, que justificaría una parálisis de su peristaltismo. (39)
- Disminución del sangrado operatorio. Otra mejora importante para el postoperatorio del paciente. Probablemente secundaria a la disección más meticulosa gracias a la amplificación de la imagen con el sistema óptico. (38)
- Disminución de la estancia hospitalaria. Uno de los factores que parece evidenciarse con el abordaje laparoscópico, es la disminución de la estancia hospitalaria en comparación con una cirugía abierta (40). La causa de esta estancia menor, posiblemente sea secundaria a una disminución del dolor y de las posibles complicaciones quirúrgicas. Está íntimamente relacionada con el coste total de la cirugía ya que si hay una menor estancia hospitalaria, el paciente se incorpora antes a la sociedad, compensando el que procedimiento laparoscópico sea más caro (37).
Se han realizado numerosos estudios que comparan la cirugía abierta y la cirugía laparoscópica, dada la controversia sobre si aporta beneficios y sobre la calidad oncológica de la resección, como son el estudio CLASSICS, COREAN Y COLOR II. Cabe señalar el estudio COLOR II, un ensayo multicéntrico europeo donde se asignaron aleatoriamente 1044 pacientes con un adenocarcinoma solitario de recto a 15 cm del margen anal (sin invasión de órganos ni metástasis) para someterse a una cirugía laparoscópica o abierta.
Los resultados publicados en 2013 demostraron tasas de resección completa (88 versus 92 por ciento) similares comparando los grupos laparoscópico y abierto. Además, la morbilidad a los 28 días (40 frente al 37 por ciento) y la mortalidad (1 frente al 2 por ciento) también fueron similares. A los tres años, la recidiva locorregional y la supervivencia no mostraron diferencias significativas entre los dos grupos. (41). En el cáncer de recto bajo, el estudio observo que la tasa de margen de resección circunferencial afectado fue inferior en el grupo de laparoscopia, probablemente por el hecho de la mejora en la visión a dicho nivel en relación a la cirugía abierta. Es de esta problemática de visualización donde nació otra de las nuevas técnicas quirúrgicas, la escisión total del mesorrecto por via transanal.
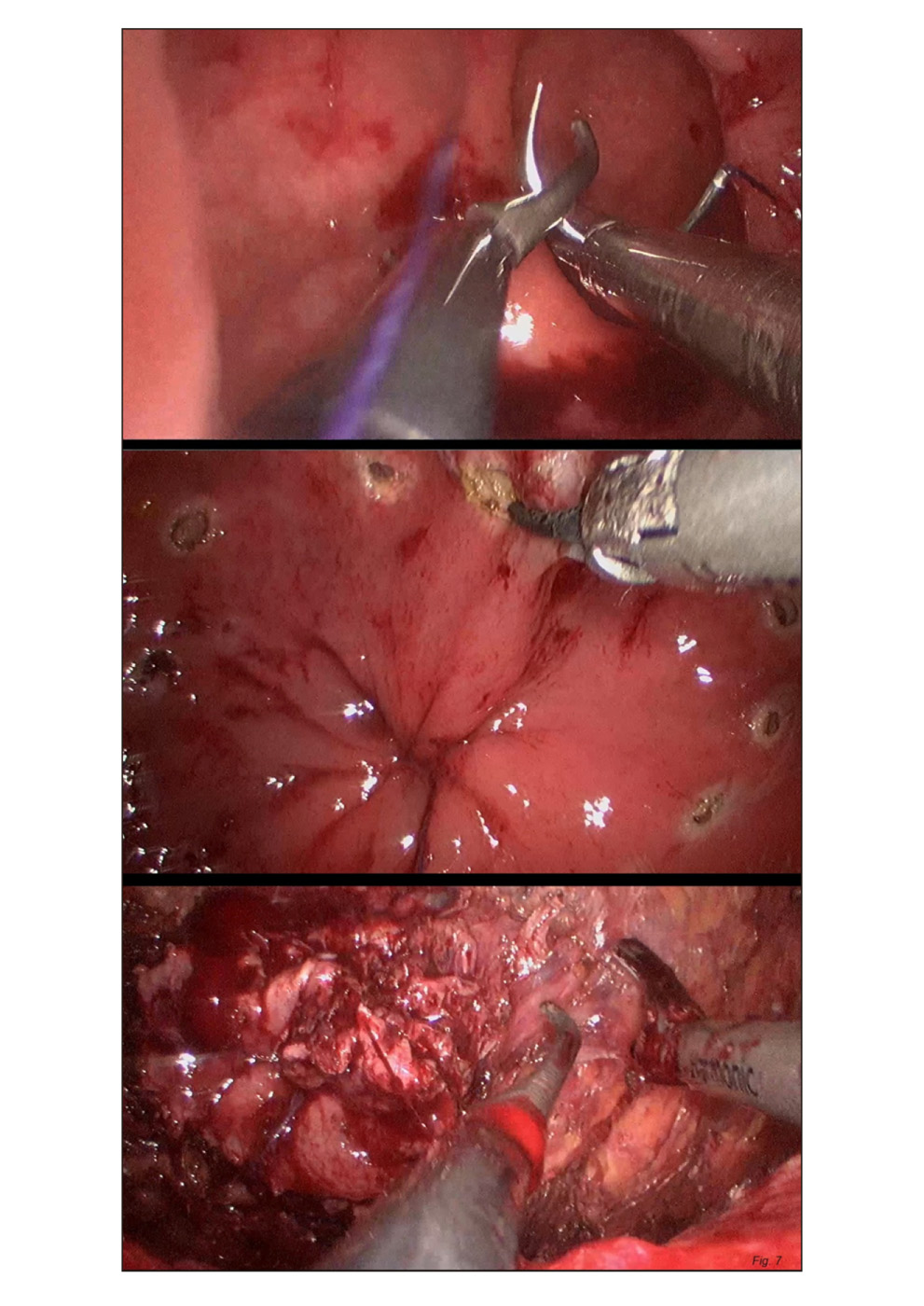
- Escisión total del mesorrecto vía transanal (TaTME). El caballo de batalla del abordaje laparoscópico es fundamentalmente la resección de tumores de recto inferior, sobre todo tumores voluminosos y en pelvis masculinas estrechas, donde existe un mayor índice de conversión a cirugía abierta. (42) Con la aparición del abordaje transanal y del gelpoint usado en el TAMIS, se comenzó a desarrollar la escisión total del mesorrecto por abordaje transanal, hasta llegar a combinar los dos abordajes, el abdominal y el transanal (figura 7), ofreciendo ventajas técnicas e incrementando la posibilidad de la preservación de esfínteres.
Figura 7.
Parece que para tumores de recto medio y bajo, la TaTME, presenta ciertos beneficios, como una mejor visualización y movilización del mesorrecto, así como una proporción de márgenes radiales afectos similar a la resección laparoscópica tradicional de recto (43). Actualmente, la mayor parte de las series solo pueden describir los resultados funcionales y oncológicos a corto plazo, pero parece tratarse de una técnica que va cobrando importancia, tanto es así, que el grupo de estudio del trabajo COLOR II (comparativa de abordaje abierto y laparoscópico en cáncer de recto), ha iniciado un estudio internacional, multicéntrico y randomizado denominado COLOR III (44) comparando el abordaje laparoscópico tradicional del cáncer de recto con la TaTME en tumores de recto medio y bajo. El punto principal de la comparativa es la existencia de márgenes radiales afectos o no, y como aspectos secundarios se valoran la morbimortalidad, calidad de vida y recurrencias locales de enfermedad oncológica. Este estudio se inició a principios de 2016, y aún no se encuentran disponibles los resultados, aunque muestra, por primera vez, la posibilidad de que el abordaje transanal pudiera estar por encima del laparoscópico clásico (45).
- Cirugía Robótica. Los procedimientos quirúrgicos asistidos mediante tecnología robótica combinan las ventajas del abordaje mínimamente invasivo (recuperación en menor tiempo, disminución del dolor…) con las ventajas que da el abordaje abierto, como sería la percepción de profundidad (46). Existen varias revisiones retrospectivas que evidencian que la extirpación total del mesorrecto asistida por cirugía robótica es igual de eficaz y segura que por abordaje abierto y laparoscópico, presentando también márgenes circunferenciales negativos (47). Sin embargo, el principal problema que impide su correcto desarrollo es el elevado coste que presenta y que se trata de un procedimiento quirúrgico que implica más tiempo que las técnicas convencionales. El uso de asistencia mediante cirugía robótica (por ejemplo, Da Vinci) parece una alternativa de futuro, sin embargo, dado su elevado coste y la existencia de este sofisticado aparataje tan solo en algunos hospitales, dificulta su implantación y desarrollo de forma más generalizada.Cabe destacar, que al igual que el abordaje laparoscópico presentó una evolución hacia la cirugía transanal mínimamente invasiva, la cirugía robótica también ha presentado un desarrollo hacia la cirugía transanal robótica, sin embargo son pocos los datos aportados en la literatura hasta el momento, aunque se prevé que la cirugía transanal robótica se establezca como un modelo factible para realizar cirugía rectal transanal avanzada.
CONCLUSIONES
Las nuevas técnicas quirúrgicas en el cáncer de recto se han acompañado de una disminución en las alteraciones fisiopatológicas del postoperatorio, un menor trauma tisular como resultado de la incisión, una menor manipulación de órganos y ausencia en la exposición al aire ambiental de los órganos, que conducen a un beneficio para el paciente, que a día de hoy no está completamente demostrado, pero que posiblemente se asuma como norma en un futuro.
La cirugía laparoscópica en el cáncer rectal parece estar asociada a beneficios a corto plazo como son una estancia más corta, la disminución del dolor postoperatorio y del número de transfusiones (48), y una menor tasa de complicaciones postoperatorias respecto al abordaje abierto, aunque también existen datos que informan de un mayor número de lesiones en la esfera sexual, tales como disfunción, en varones, respecto al abordaje abierto. (49)
De forma general, se podría decir que la investigación futura del cáncer de recto pasa por la mejora en los tratamientos quimioterápicos y radioterápicos neoadyuvantes, ya que de los actuales estudios puestos en marcha, casi dos tercios son acerca de mejoras oncológicas, y solo un tercio de aspectos quirúrgicos (50). Sin embargo no debemos olvidar que el pilar en el cual se articula el tratamiento del cáncer de recto es la cirugía, por lo que todas aquellas innovaciones que se produzcan en este campo, van a tener una influencia directa sobre la calidad de vida de los pacientes y sobre la supervivencia, y es ahí donde los abordajes mínimamente invasivos, como son la laparoscopia, robótica y abordaje TaTME, tienen cabida, llegando a ser considerados como los abordajes ideales en los quirófanos de hoy en día, en los que hace años todas estas innovaciones parecían relegadas a un futuro muy lejano y dónde una incisión grande, era sinónimo de curación.
REFERENCIAS BIBLIOGRÁFICAS
- Galceran J, Ameijide A, Carulla M, et al. REDECAN Working Group. Cancer incidence in Spain, 2015. Clin Transl Oncol. 2017; 19(7):799-825
- Galceran, J, Ameijide, A, Carulla, M et al. Estimaciones de la incidencia y la supervivencia del cáncer en España y su situación en Europa. Red Española de Registros de Cáncer (REDECAN), 2014.
- de Calan L, Gayet B, Bourlier P, Perniceni T. Cáncer de recto: anatomía quirúrgica, preoperatorio, preparación del paciente Enciclopedia Médico-Quirúrgica. 2004; 20(3): 1-13.
- Patricio J, Bernades A, Nuno D, Falcao F, Silveira L. Surgical anatomy of the arterial blood-supply of the human rectum. Surg Radiol Anat. 1988; 10: 71-75
- Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery. The clue to pelvic recurrence? Br J Surg. 1982; 69: 613-616
- de Haas-Kock DFM, Baeten CG, Jager JJ, Langendijk JA, Schouten LJ, Volovics A et al. Prognostic significance of radial margins of clearance in rectal cancer. Br J Surg. 1996; 83: 781-785
- Reynolds JV, Joyce WP, Dolan J, Sheahan K, Hyland JM.Pathological evidence in support of totalmesorectal excision in themanagementof rectal cancer. Br J Surg. 1996; 83: 1112-1115
- Van Cutsem E, Dicato M, Haustermans K, Arber N, Bosset JF, Cunningham D, et al. The diagnosis and management of rectal cancer: Expert discussion and recommendations derived from the 9th World Congress on Gastrointestinal Cancer, Barcelona, 2007. Ann Oncol. 2008;19 (Suppl 6):vi1–8.
- McCourt M, Armitage J, Monson JR. Rectal cancer. Surgeon. 2009; 7 (3):162-9.
- Bell S, Sasaki J, Sinclair G, et al. Understanding the anatomy of lymphatic drainage and the use of blue-dye mapping to determine the extent of lymphadenectomy in rectal cancer surgery: unresolved issues. Colorectal Dis. 2009; 11(5):443-9.
- Kim YW, Kim NK, Min BS, et al. Factors associated with anastomotic recurrence after total mesorectal excision in rectal cancer patients. J Surg Oncol. 2009; 99(1):58-64.
- Monson JR, Weiser MR, Buie WD, et al. Practice parameters for the management of rectal cancer (revised). Dis Colon Rectum. 2013; 56(5): 535-50.
- Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol. 2008; 26(2): 303-12.
- Rickles AS, Dietz DW, Chang GJ, et al. High Rate of Positive Circumferential Resection Margins Following Rectal Cancer Surgery: A Call to Action. Ann Surg. 2015; 262(6):891-8.
- Park JS, Huh JW, Park YA, et al. A circumferential resection margin of 1 mm is a negative prognostic factor in rectal cancer patients with and without neoadjuvant chemoradiotherapy. Dis Colon Rectum. 2014; 57(8):933-40.
- Nelson H, Petrelli N, Carlin A, et al. Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst. 2001; 93(8):583-96.
- Abel ME, Rosen L, Kodner IJ, Fleshman JW, Hicks T, Kennedy HL et al. Practice parameters for the treatment of rectal carcinoma. Dis Colon Rectum. 1993; 36(11): 989-1006
- Heald B. Autonomic nerve preservation in rectal cancer surgery –the forgotten part of the TME message a practical “workshop” description for surgeons. Acta Chir Iugosl. 2008; 55(3):11-6.
- Ronald Bleday, David Shibata. Rectal cancer: Surgical principles. 2019; UptoDate
- Rajput A, Romanus D, Weiser MR, et al. Meeting the 12 lymph node (LN) benchmark in colon cancer. J Surg Oncol. 2010; 102(1):3-9.
- Marks JH, Valsdottir EB, Rather AA, et al. Fewer than 12 lymph nodes can be expected in a surgical specimen after high-dose chemoradiation therapy for rectal cancer. Dis Colon Rectum. 2010; 53(7):1023-9.
- Manzanilla Sevilla, M. Historia del cáncer del recto y su tratamiento quirúrgico. Rev Mex Coloproctola. 2005; 11(2): 60-3.
- Chang AJ, Nahas CS, Araujo SE, et al. Early rectal cancer: local excision or radical surgery? J Surg Educ. 2008; 65(1):67-72.
- Stipa F, Lucandri G, Ferri M, et al. Local excision of rectal cancer with transanal endoscopic microsurgery (TEM). Anticancer Res. 2004; 24(2C):1167-72.
- Demartines N, von Flüe MO, Harder FH. Transanal endoscopic microsurgical excision of rectal tumors: indications and results. World J Surg., 2001; 25(7):870-5.
- Greenberg JA, Shibata D, Herndon JE 2nd, et al. Local excision of distal rectal cancer: an update of cancer and leukemia group B 8984. Dis Colon Rectum. 2008; 51(8):1185-91.
- Garcia-Aguilar J, Renfro LA, Chow OS, et al. Organ preservation for clinical T2N0 distal rectal cancer using neoadjuvant chemoradiotherapy and local excision (ACOSOG Z6041): results of an open-label, single-arm, multi-institutional, phase 2 trial. Lancet Oncol. 2015; 16(15):1537-1546.
- de Calan L, Gayet B, Bourlier T,. Perniceni T. Cirugía del cáncer de recto mediante laparotomía y laparoscopia. EMQ. 2004; 20(3): 1-33
- Hüser N, Michalski CW, Erkan M, et al. Systematic review and meta-analysis of the role of defunctioning stoma in low rectal cancer surgery. Ann Surg. 2008; 248(1):52-60.
- Mora López L; Serra Aracil X; Garcia-Nalda A; Navarro Soto S. Aplicación del verde de Indocianina en la determinación de la vascularización recto-sigmoidea en cirugía Notes-Hibrido. Cir Esp. 2015; 93. Especial congreso de XX Reunion Nacional de Cirugia.
- Carrillo A, Enríquez-Navascués JM, Rodríguez A, Placer C, Múgica JA, Saralegui Y, Timoteo A, Borda N. Incidencia y caracterización del síndrome de resección anterior de recto mediante la utilización de la escala LARS (low anterior resection score). Cir Esp. 2016; 94(3):137-143
- Cuesta Miguel A, Alonso-Poza A, Planells-Roig M, Garcia-Espinosa R, Rodero-Rodero D. Las primeras experiencias en Cirugia laparoscópica de Colon en España. Valencia, Noviembre de 1991. Cir esp. 2016; 94(4): 210-212
- Berends FJ, Kazemier G, Bonjer HJ, Lange JF. Subcutaneous metastases after laparoscopic colectomy. Lancet. 1994; 344(8914): 58.
- Lacy AM, García-Valdecasas JC, Delgado S, Castells A, Taura P, Pique´ JM. Laparoscopic-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: A randomized trial. Lancet. 2002; 359(9325): 2224-9.
- Park IJ, Choi GS, Lim KH, Kang BM, Jun SH. Multidimensional analysis of the learning curve for laparoscopic colorectal surgery: Lessons from 1,000 cases of laparoscopic colorectal surgery. Surg Endosc. 2009; 23(4):839-46.
- Delgado Gomis F, Blanes Masson F, Gómez Abril S, Richart Aznar J, Trullenque Juan R. Complicaciones de la cirugía laparoscópica. Cir Esp. 2001; 69(3): 330-6
- Janson M, Bjorcholt I, Carlsson P, Haglinch E, Henriksson M, Lindholm E et al. Randomized clinical trial of the costs of open and laparoscopic surgery for colonic cancer. Br J Surg. 2004; 91(4): 409-17.
- Lacy AM, Delgado S. Cirugía laparoscópica y cáncer colorrectal. En: Cirugía Endoscópica-Guías Clínicas de la Asociación Española de Cirujanos. 2003; pp 389-396.
- Chen HH, Wexner SD, Iroatulam AJ, Pikarsky AJ, Alabaz O, Nogueras JJ, Nessim A, Weiss EG. Laparoscopic colectomy compares favorably with colectomy by laparotomy for reduction of postoperative ileus. Dis Colon Rectum. 2000; 43(1):61-5.
- Delgado S, Momblán D, Salvador L, Bravo R, Castells A, Ibarzabal A, Piqué JM, Lacy AM. Laparoscopic-assisted approach in rectal cancer patients. Lessons learned from > 200 patients. Surg Endosc. 2004; 18(10):1457-62.
- van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, Hop WC, Bonjer HJ; COlorectal cancer Laparoscopic or Open Resection II (COLOR II) Study Group. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol. 2013; 14(3): 210-8.
- Bonjer HJ, Deijen CL, Abis GA, Cuesta MA, van der Pas MH, de Lange-de Klerk ES, Lacy AM, Bemelman WA, Andersson J, Angenete E, Rosenberg J, Fuerst A, Haglind E; COLOR II Study Group. A Randomized Trial of Laparoscopic versus Open Surgery for Rectal Cancer. N Engl J Med. 2015; 372(14): 1324-32
- Lacy AM, Rattner DW, Adelsdorfer C, Tasende MM, Fernández M, Delgado S, Sylla P, Martínez-Palli G. Transanal natural orifice transluminal endoscopic surgery (NOTES) rectal resection: “down-to-up” total mesorectal excision (TME)—short-term outcomes in the first 20 cases. Surg Endosc. 2013; 27(9): 3165–3172
- https://clinicaltrials.gov/ct2/show/NCT02736942
- Lacy AM, Tasende MM, Delgado S, Fernandez-Hevia M, Jimenez M, De Lacy B, Castells A, Bravo R, Wexner SD, Heald RJ. Transanal total mesorectal excision for rectal cancer: outcomes after 140 patients. J Am Coll Surg. 2015; 221(2): 415–423
- Collinson FJ, Jayne DG, Pigazzi A, Tsang C, Barrie JM, Edlin R, Garbett C, Guillou P, Holloway I, Howard H, Marshall H, McCabe C, Pavitt S, Quirke P, Rivers CS, Brown JM. An international, multicentre, prospective, randomised, controlled, unblinded, parallel-group trial of robotic-assisted versus standard laparoscopic surgery for the curative treatment of rectal cancer. Int J Colorectal Dis. 2012; 27(2): 233-41.
- De Souza AL, Prasad LM, Ricci J, Park JJ, Marecik SJ, Zimmern A, Blumetti J, Abcarian H. A comparison of open and robotic total mesorectal excision for rectal adenocarcinoma. Dis Colon Rectum. 2011; 54(3):275-82.
- Greenblatt DY, Rajamanickam V, Pugely AJ, Heise CP, Foley EF, Kennedy GD. Short-term outcomes after laparoscopic-assisted proctectomy for rectal cancer: results from the ACS NSQIP. J Am Coll Surg. 2011; 212(5):844-54.
- Quah HM, Jayne DG, Eu KW, Seow-Choen F. Bladder and sexual dysfunction following laparoscopically assisted and conventional open mesorectal resection for cancer. Br J Surg. 2002; 89(12): 1551-6.
- Reina Duarte A, Ferrer Márquez M, Rubio Gil F, Belda Lozano R, Álvarez García A, Blesa Sierra I, Fuentes Porcel O, Vidaña Márquez E, Rosado Cobian R. ¿Qué se investiga en cáncer de recto? Cir Esp. 2015; 93(6): 381-389
INFORMACIÓN SOBRE EL ARTÍCULO
Autor para la correspondencia: Javier Gómez Sánchez. Hospital Clínico San Cecilio, Avenida de la Ilustración s/n. 18016 Secretaria Cirugía General. E-mail: Javiergomezsanchez.jg@gmail.com