Caso Clínico
Tumor estromal esclerosante de ovario. Reto en el diagnóstico
Sclerosant ovary stromal tumor. Differential diagnostic challenge
Actual Med. 2020; 105(811): 222-225 DOI: 10.15568/am.2020.811.cc01
Recibido: 12/01/2019
Revisado: 02/02/2020
Aceptado: 19/04/2020
Resumen
Se presenta el caso de un tumor estromal esclerosante ovárico en una mujer de la tercera década de la vida. Estos tumores derivan del estroma-cordones sexuales del ovario, tienen una escasa incidencia y presentan un comportamiento benigno. Se revisa la literatura disponible hasta el momento, dada la importancia del adecuado diagnóstico diferencial.
Palabras clave: Ovario; Estromal; Neoplasia; Cordones sexuales.
Abstract
We present the case of a stromal ovarian sclerosing tumor in a woman of the third decade of life. These tumors derive from the stroma-sexual cords of the ovary, have a low incidence and exhibit a benign behavior. the available literature is reviewed to date, given the importance of proper differential diagnosis.
Keywords: Ovary; Stromal; Tumor; Sex cords.
Leer Artículo Completo
INTRODUCCIÓN
El tumor estromal esclerosante de ovario (TEEO) es una neoplasia benigna poco frecuente, derivada del estroma-cordones sexuales del ovario. Se presenta en mujeres entre la segunda y tercera décadas de la vida. Clínicamente, la mayoría de las pacientes presentan irregularidades menstruales, dolor abdominal y/o pélvico, a veces con actividad hormonal (anovulación, infertilidad, virilización) e incluso ascitis y síndrome de Meigs (1).
Macroscópicamente, suelen ser tumores sólidos con áreas de edema y pequeñas zonas quísticas, con un patrón histológico característico de células fusiformes mezcladas con otras luteinizadas, de citoplasma amplio, en un estroma mixoide hipocelular o densamente colagenizado, que se disponen en un patrón pseudolobular (2,3). En este caso, se describe un tumor estromal esclerosante de ovario donde la histopatología fue fundamental para el diagnóstico definitivo.
DESCRIPCIÓN DEL CASO
Se presenta un TEEO en una paciente de la tercera década de la vida que debutó como masa ovárica unilateral de 5 cm.
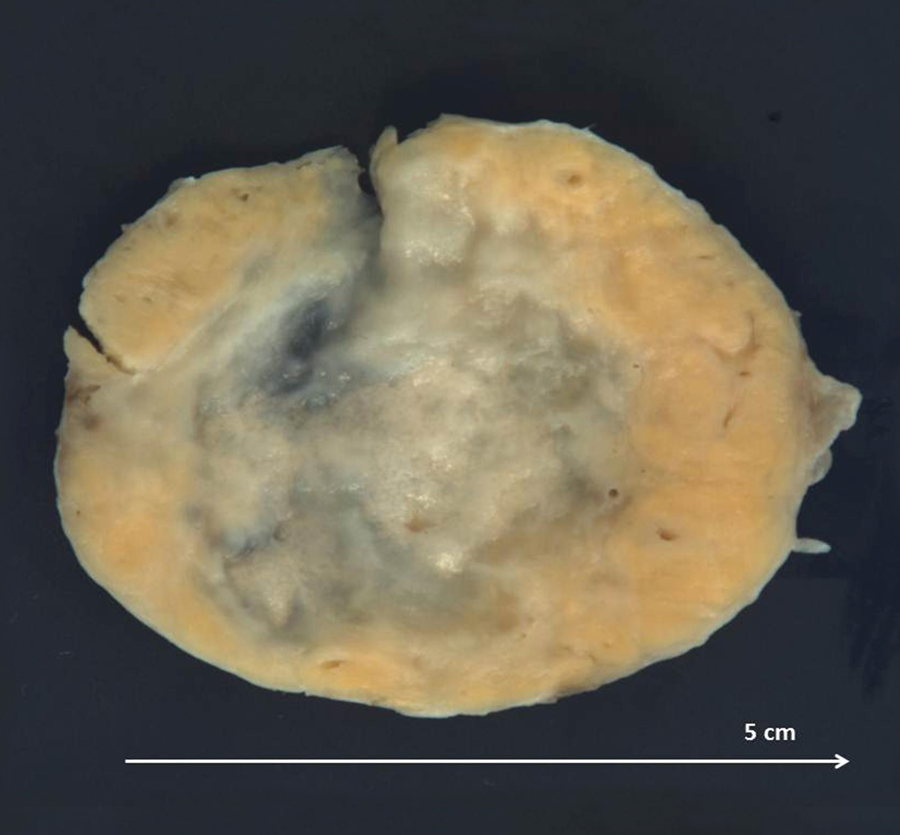
Macroscópicamente consistía en una lesión sólida, circunscrita, de superficie externa lisa, y, al corte, centro translúcido edematoso, y periferia amarillenta (figura 1). El estudio histopatológico mostró una tumoración heterogénea, de distribución irregular. Más celular en la periferia. La zona central mostraba aspecto pseudo-lobulado, con nidos celulares separados por un estroma edematoso o colagenizado.
Figura 1. Imagen macroscópica de la tumoración en corte transversal. Se corresponde con una lesión sólida, circunscrita, de superficie externa lisa, y un centro translúcido edematoso, y periferia amarillenta al corte.
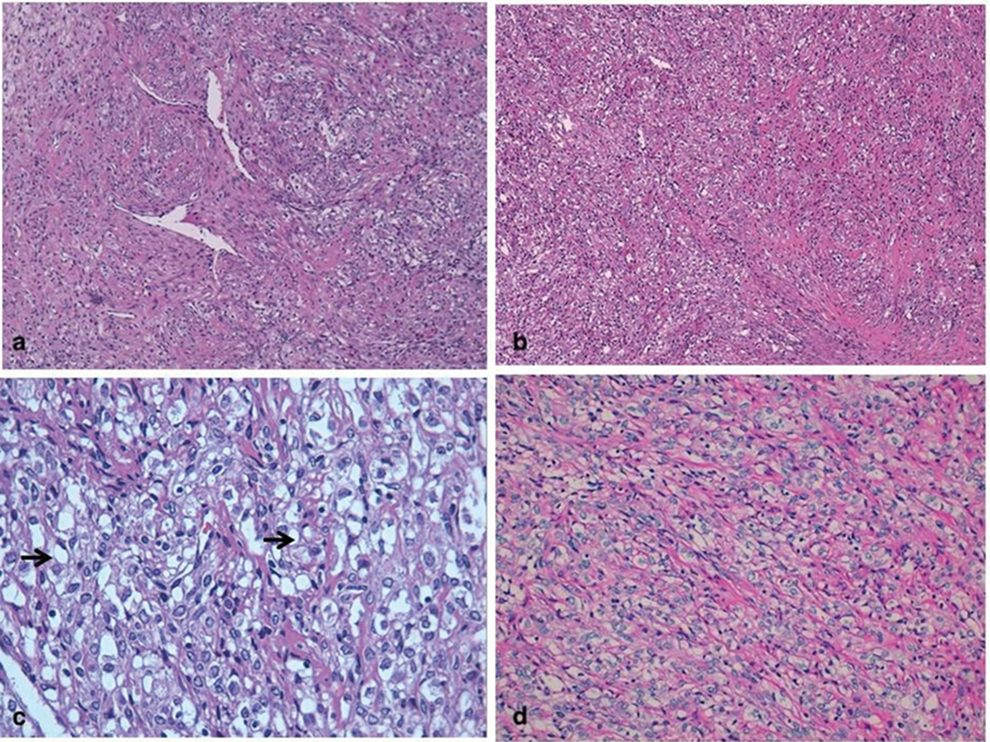
La trama vascular era prominente en toda la lesión, con vasos de paredes finas y luz irregular, de tipo hemangiopericitoide (figura 2 a). Estaba compuesto por dos tipos de células, unas fusiformes y otras luteinizadas, de citoplasma vacuolado (figura 2 b).
Figura 2. Imagen microscópica con H-E y PAS. A y B. Imagen a bajo aumento (4x) donde se evidencia trama vascular prominente en toda la lesión, con vasos de paredes finas y luz irregular (hemangiopericitoide). Destacan dos poblaciones celulares: fusiformes y luteinizadas (citoplasma vacuolizado). C. Imagen a mayor aumento (20x), donde se aprecian algunas células que adquieren morfología en anillo de sello que son PAS negativas (D).
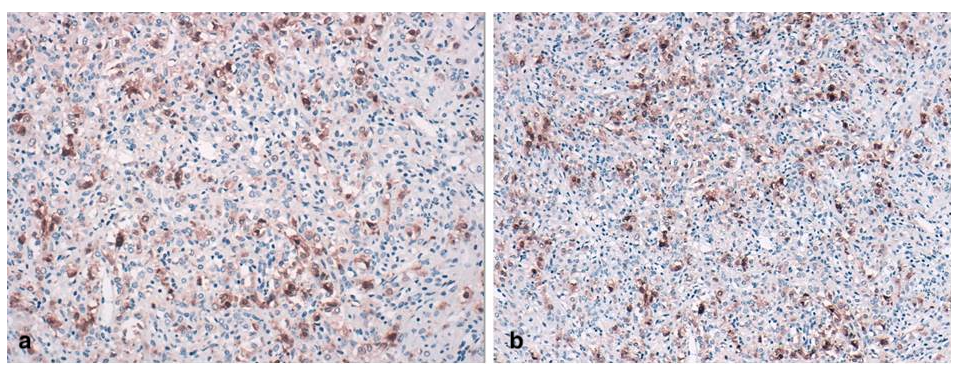
Algunas de estas últimas adquieren morfología de células en anillo de sello (figura 2 c), y son PAS negativas (figura 2 d). Las células neoplásicas mostraban expresión inmunohistoquímica de calretinina, inhibina (en las células luteinizadas) (figura 3 a y 3 b) y actina (en las células fusiformes).
Figura 3. Imagen inmunohistoquímica para calretinina e inhibina. Se observan células luteinizadas con expresión de calretinina e inhibina.
DISCUSIÓN
El TEEO se incluye en la última clasificación de la OMS (2014) en el grupo de tumores derivados del estroma-cordones sexuales como tumores estromales puros (2).
Llegan a suponer entre el 2-6% de los tumores estromales ováricos (4). La presentación habitual es en mujeres entre los 18-30 años. Habitualmente son unilaterales. La clínica es inespecífica, presentándose bien de forma incidental, o en ocasiones con alteraciones menstruales o disconfort abdominal por compromiso de espacio. De forma habitual, no son funcionantes, aunque hay casos publicados en la literatura que sí lo son, con producción androgénica o estrogénica (5). A nivel radiológico, el TEEO suele mostrar captación de contraste aumentada, mostrando una masa sólida homogénea de tamaño variable, pero según las series suele ser mayor de 7 cm, de ahí la clínica inespecífica más habitual.
El diagnóstico debe ser anatomopatológico. Se suele presentar como un tumor circunscrito, como nuestro caso, con un área central blanquecina laxa, que a veces condiciona un patrón quístico más o menos prominente, con una porción periférica de coloración amarillenta y consistencia gomosa (6). En otros casos el edema es muy importante, y el tumor es predominantemente quístico (7).
Respecto al estudio histológico, suele mostrar un patrón relativamente constante, estando la mayor variabilidad en relación con la presencia de células luteinizadas (8,9,10). Cuando estas son prominentes se plantea el diagnóstico diferencial con otros tumores estromales puros, que aunque tienen similitudes histológicas, sus características generales difieren. Así, con el tecoma. Este último se presenta de forma más frecuente en la menopausia y no suele mostrar patrón pseudolobular.
También hay que hacer diagnóstico diferencial con el fibroma ovárico, aunque puede ocurrir en mujeres jóvenes, la media de edad está en 50 años aproximadamente. Presenta de vasos y células luteinizadas pero carece de disposición heterogénea y patrón pseudolobular (11).
La morfología del TEEO cambia durante el embarazo, observándose aumento difuso de células luteinizadas que pueden ocultar el patrón vascular y pseudolobular del tumor estromal esclerosante y puede plantear problemas de diagnóstico diferencial con el tumor de células esteroideas (13).
La presencia de células en anillo de sello obliga a descartar un tumor metastásico, principalmente de origen gastrointestinal o mamario. Este suele ser bilateral y ocurre en pacientes de más edad. Es el diagnóstico diferencial de mayor relevancia clínica. Para ello se utilizan las siguientes técnicas: PAS, citoqueratina y EMA. Las células luteinizadas no muestran expresión inmunohistoquímica de citoqueratina ni EMA y el PAS es negativo, mientras que en el tumor metastásico ocurre lo contrario, por lo que son de gran ayuda en el diagnóstico definitivo (8,9).
El uso de las técnicas inmunohistoquímicas es muy limitado en relación con otros tumores estromales, por tanto, la morfología es fundamental para el diagnóstico (13).
Por otro lado, tal y como establece la literatura, el comportamiento clínico del TEEO es benigno, sin recidivas (10,11,12), como en nuestro caso, que la paciente se encuentra asintomática 4 años después del diagnóstico.
En conclusión, el TEEO requiere de una combinación precisa de clínica, radiología e histopatología, al implicar un diagnóstico diferencial entre entidades que pueden mimetizar diferentes tumores como el tecoma, el fibroma/fibrosarcoma, el de células esteroideas y el tumor de Krukenberg. Así mismo, un correcto diagnóstico asegura un buen pronóstico evitando comprometer la vida reproductiva de la paciente, y las comorbilidades asociadas a la cirugía de una masa tumoral de gran tamaño.
referencias bibliográficas
- ↑Khan S, Singh V, Khan ID, Panda S. Sclerosing stromal cell tumor of ovary. Med J Armed Forces India. 74:386-389. 2018. DOI: 10.1016/j.mjafi.2017.09.007
- ↑Kurman J, Carcangiu ML, Herrington CS, Young RJ. Who Classification of tumours of female reproductive organs. Lyon: International Agency for Research on Cancer. 2014.
- ↑Reichert RA. Diagnostic gynecologic and obstetric pathology. An atlas and text. Lippincott Williams and Wilkins. 2012.
- ↑Haroon S, Zia A, Idrees R, Memon A, Fatima S, Kayani N. Clinicopathological spectrum of ovarian sex cord-stromal tumors; 20 years retrospective study in a developing country. J Ovarian Res. 6(1):87. 2013. DOI: 10.1186/1757-2215-6-87
- ↑Özdemir Ö, Atalay C, Een E, Özhamam E. Stromal tumor of the sclerosing ovary in a postmenopausal woman who presents with virilization. J Exp Ther Oncol. 11(3):213-216. 2016. DOI: 10.1097/MD.0000000000018171
- ↑Zapardiel Gutiérrez I, Carretero Albiñana L, de la Fuente Valero J, Gallego Villaescusa I, Álvarez Álvarez P, Bajo Arenas JM. Tumor esclerosante estromal: una neoplasia ovárica excepcional. Prog Obstet Ginecol. 52(11):648-652. 2009. URL: https://www.medigraphic.com/pdfs/medicadelcentro/mec-2013/mec134j.pdf
- ↑Young RH. Ovarian tumors and tumors–like in the first decades. Semin Diagn Pathol. 31: 382-426. 2014. DOI: 10.1053/j.semdp.2014.08.001
- ↑Kaygusuz EI, Cesur S, Cetiner H, Yavuz H, Koc N. Sclerosing stromal tumours in young women: clinicopathologic and immunohistochemical spectrum. J Clin Diagn Res. 7(9): 1932-1935. 2013. DOI: 10.7860/JCDR/2013/6031.3373
- ↑Zekioglu O, Ozdemir N, Terek C, Ozsaran A, Dikmen Y. Clinicopathological and Inmunohistochemical analysis of sclerosing stromal tumours of the ovary. Arch Gynecol Obstet. 282: 671-676. 2010. DOI: 10.1007/s00404-010-1373-9
- ↑Qureshi A, Raza A, Kayani N. The morphologic and inmnunohistochemical spectrum of 16 cases of sclerosing stromal tumours of the ovary. Indian J Pathol Microbiol. 2010;53: 658-660. URL: https://www.ijpmonline.org/article.asp?issn=0377-4929;year=2010;volume=53;issue=4;spage=658;epage=660;aulast=Qureshi
- ↑El hafez AA. Sclerosing stomal tumor of the ovary: a rare entity with distinctive features. Case Reports in Clinical Pathology. 1:5–7. 2014. DOI: DOI: 10.5430/crcp.v1n1p5
- ↑Bairwa S, Satakar RN, Kalhan S, Garg S, Sangwaiya A, Singh P. Sclerosing stromal tumor: a rare ovarian neoplasm. Iran J Pathol. 12(4): 402–405. 2017. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5844687/
- ↑Young RH. Ovarian sex cord-stromal tumours and their mimics. Pathology. 50(1): 5-15. 2018. DOI: 10.1016/j.pathol.2017.09.007
INFORMACIÓN DEL ARTÍCULO
Conflicto de intereses: Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Autor para la correspondencia: Teresa Caro Cuenca. UGC de Anatomía Patológica. Hospital Universitario Reina Sofía. Avda. Menéndez Pidal, sn · 14004, Córdoba, España. E-mail: mariat.caro.sspa@juntadeandalucia.es