
75
Álvaro Sierra-Sánchez
Caracterización celular y estudio de expresión de HLA I y II en células mesenquimales troncales humanas diferenciadas in vitro
2.2. Diferenciación
in vitro
de las hCMTs a células de linaje
epitelial
Las hCMTs derivadas de TA y MO se mantienen en cultivo
con sus correspondientes pases hasta que se obtiene una canti-
dad mínima de 12 millones, que se siembran en dos factorías de 1
piso (9.524 hCMTs/cm
2
). En este momento, las hCMTs se incuban
con 100 mL/factoría de medio de diferenciación a queratinocitos
(MQT), el cual está constituido, además de por DMEM, suero bovi-
no fetal, glutamina y antibióticos (anfotericina B y gentamicina) que
son componentes habituales de los medios de cultivo, por factores
de crecimiento epidérmico y de queratinocitos (19) que estimulan
la proliferación, debido su capacidad mitogénica, y diferenciación
celular a estirpe epitelial al actuar sobre receptores específicos de
superficie celular que activan los procesos de morfogénesis del epi-
telio y reepitelización . Con este, se mantienen entre 3 y 4 sema-
nas hasta que adquieran una morfología esférica y formen colonias
típicas de queratinocitos, cambiando el medio cada 2-3 días.
2.2.1. Análisis histológico e inmunohistoquímico de las célu-
las diferenciadas
Tras la diferenciación, las células se recuperan, cuentan y de-
termina su viabilidad. Para realizar el estudio, se recogen en dos
eppendorfs con tapón de rosca, 1 millón de hCMTs/tubo que se
centrifugan 30-60 segundos a 8.000-14.000 rpm y se retira el so-
brenadante dejando sólo el pellet. Un tubo se envía al Servicio de
Anatomía Patología del Hospital Universitario de Granada, mien-
tras que el otro se conserva a 4ºC por si fuese necesario repetir el
experimento.
Para determinar la histología, se realiza una tinción de Hema-
toxilina y Eosina (
H&E
), mientras que para la inmunohistoquímica
se estudian las siguientes proteínas: CK Multi-Pan Clon MNF116
(CK5, 6, 8 17 y 19), CK14 y vimentina (10, 20, 21)
.
El pellet celular se fija con formol tamponado al 4%, durante
aproximadamente 12-24 horas, a continuación, con un papel
muy fino, se rescata el pellet y se introduce en un cassette en el
procesador de tejidos ON (el cassette pasa por formol, alcohol 100º,
xilol y parafina). Al día siguiente se realiza el bloque de parafina en
una estación de inclusión y se corta con un micrótomo a 2,5 micras.
Para la histología, se añade la tinción de
H&E
a los cristales y
se deja secar 24 horas a 37ºC o 1 hora a 60ºC.
Para la inmunohistoquímica, el pellet celular embebido en
parafina requiere un desenmascaramiento antigénico, que en el
caso de las CK-pan, la CK14 y la vimentina se realiza con EDTA (pH
8), 20 minutos a 95ºC dentro de un módulo PT Link.
Tras esto, se bloquea con peroxidasa durante 10 minutos, se
incuba otros 10 con el anticuerpo primario y lo mismo con el se-
cundario. A continuación, se incuba con un polímero durante 15
minutos y se revela con diaminobencidina (DAB), al cual durante 2
minutos se le añade un amplificador específico. Además, se realiza
una contratinción con Hematoxilina (Hx) durante 20 segundos.
Entre cada fase del proceso se lava con buffer y tras la Hx,
con agua para azulearla. Finalmente se deshidrata (con alcoholes
crecientes 96º-100º) y se aclara con xilol para su posterior montaje
y detección.
2.2.2. Análisis fenotípico y HLA por CMF de las células diferencia-
das
Se recuperan las células y la técnica y los marcadores utili-
zados en este caso son iguales a lo descrito anteriormente (véase
el
punto 2.1.6.
).
RESULTADOS
3.1. Control de calidad y caracterización de las hCMTs pro-
cedentes de TA y MO
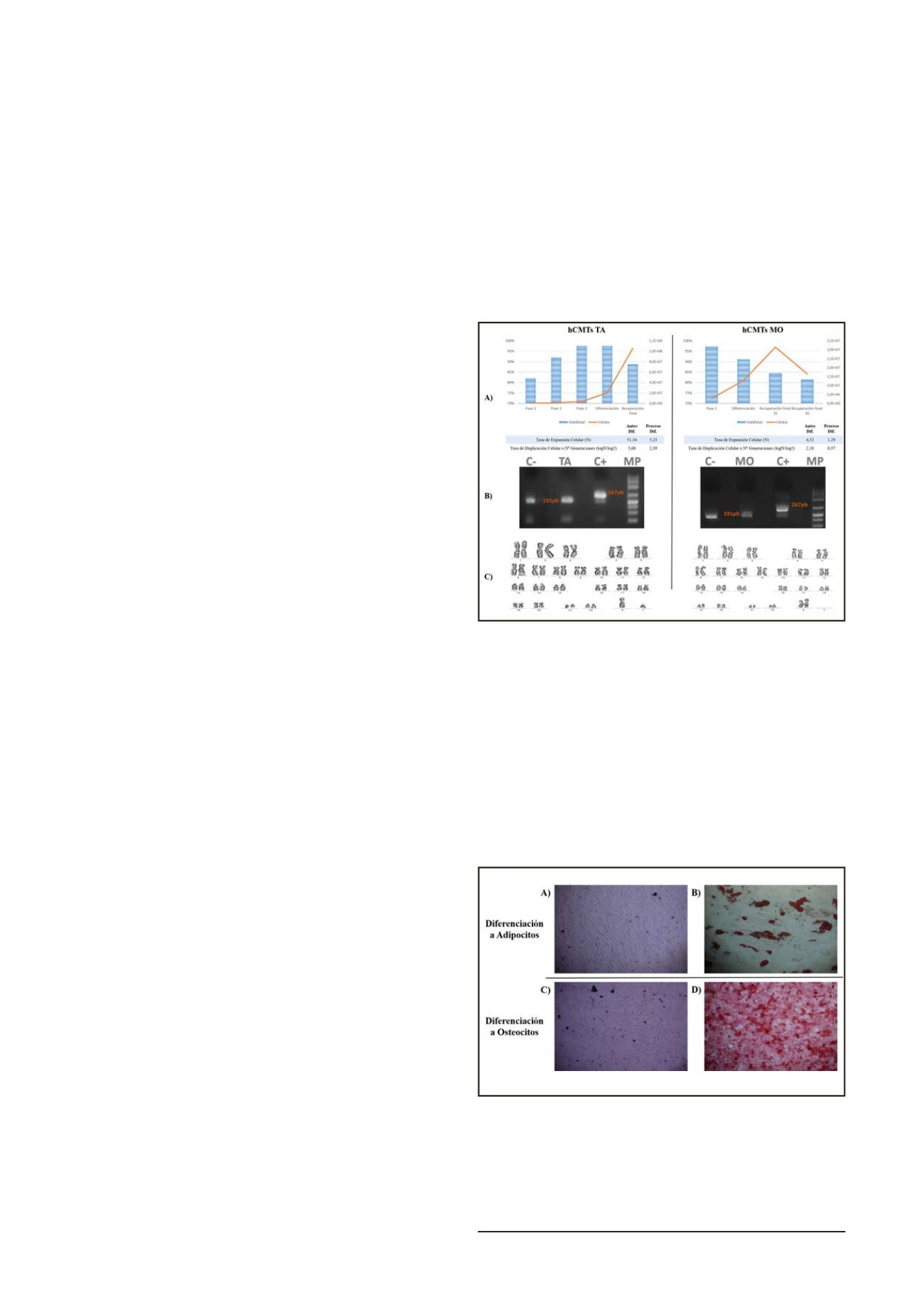
Se analizó la viabilidad de ambas líneas a lo largo de todo el pro-
ceso, que se mantuvo por encima del 80%, y en cuanto al número de
células, cabe destacar la mayor velocidad proliferativa de las proce-
dentes deMO durante la fase de expansión y una menor proliferación
que las de TA tras la inducción de la diferenciación. En la figura 1a se
indica además la tasa de expansión y duplicación celular. (
Figura 1a
).
En lo referente a la esterilidad, la prueba con el sistema BacT/ALERT
®
3D resultó negativa a los 7 días, igual que el análisis de micoplasmas,
debido a la ausencia de las bandas características de peso molecular
de micoplasmas (267 pb) (
Figura 1b
). Al realizar el cariotipo de ambas
líneas celulares de hCMTs, se descartó la presencia de alteraciones ge-
néticas a nivel cromosómico en ambas líneas (
Figura 1c
).
Para la caracterización de las hCMTs, ambas líneas celulares
se diferenciaron a adipocitos y a osteocitos. Tras mantenerlas tres
semanas con los medios de diferenciación correspondientes, se ti-
ñeron de manera específica, con Oil Red O los adipocitos y con Ali-
zarin Red S los osteocitos, observándose en ambos casos un color
rojo característico, correspondiente a los depósitos de lípidos y calcio
respectivamente, que no estaba presente en los controles (
Figura 2
).
Figura 1. Resultados de la prueba del control de calidad de las hCMTs.
A la izquierda las de Tejido Adiposo (TA) y a la derecha las de Médula
Ósea (MO). A) Gráficos de viabilidad y cuantificación celular a lo largo
de todo el proceso, con los valores de Tasa de Expansión y Duplicación
Celular, antes y durante el proceso de diferenciación, B) Resultados de
la PCR para la detección deMicoplasmas y C) Imagen del cariotipo.
Figura 2. Resultados de las pruebas de diferenciación de las hCMTs
a Adipoctios y Osteocitos. A) Control negativo de diferenciación
a Adipocitos, B) Prueba de diferenciación a Adipocitos, de color
rojo las gotas lipídicas teñidas de Oil Red O, C) Control negativo de
diferenciación a Osteocitos y D) Prueba de diferenciación a Osteocitos,
de color rojo los depósitos de calcio teñidos de Alizarin Red S.

















