134
Gutiérrez Soto M.
Etiologíamicrobiana y sensibilidad a los antibióticos de las infecciones urinarias
rios (66%), pudiendo explicarse este hecho por la mayor presión
antibiótica por el uso en aquel grupo de betalactámicos de amplio
espectro, ya que existe una correlación significativa entre el con-
sumo de estos fármacos y la resistencia a ampicilina. La resisten-
cias a amoxicilina/ácido clavulánico fueron bastante inferiores:
del 29% y 22%, respectivamente.
Cefalosporinas de tercera ge-
neración y amoxicilina/ácido clavulánico se mantienen con bajas
tasas de resistencia en las cepas comunitarias, e incluso en los
pacientes neurológicos.
Las resistencias de
E. coli
a cotrimoxazol son elevadas, aun-
que variables, y lo descartan en los tratamientos empíricos: en
nuestra serie son del 25% en los enfermos neurológicos y del 32%
en enfermos comunitarios. Estudios multicéntricos realizados en
Norteamérica evidencian también la resistencia de cepas ambu-
latorias en EE. UU. y Canadá (4). La resistencia a las quinolonas en
este estudio es de un 38% en las cepas comunitarias, cifra similar
a las descritas en series españolas, que oscilan entre un 18 y un
44%, y próxima a las resistencias de nuestras cepas hospitalarias,
donde el porcentaje es del 33%. Está demostrado que la
resis-
tencia a quinolonas está ligada claramente al factor geográfico
por el consumo excesivo
de estas. Normalmente, en las entero-
bacterias, es el resultado de la mutación cromosómica que causa
alteraciones en la diana enzimática y la posterior selección de las
cepas resistentes inducida por el abuso del fármaco. Por lo tanto,
la razón de este aumento progresivo de resistencia hay que bus-
carlo en el uso masivo de quinolonas, tanto en humanos como
en animales, con variaciones basadas en la edad (la resistencia
aumenta con la edad del paciente) y en la región geográfica (4).
Destacan en esta serie las bajas tasas de resistencia a fosfo-
micina. En nuestra serie la resistencia a la fosfomicina es de hasta
el 14% en las cepas de
E. coli
productoras de BLEE los enfermos
neurológicos, y hasta un 30% en las cepas de
Enterobacter
de los
enfermos procedentes de Atención Primaria, cifra que aun siendo
relativamente baja es superior a lo que reflejan las series multi-
céntricas. Su alta actividad intrínseca se explica por su especial
farmacocinética, por la adquisición por mutación cromosómica
de sus mecanismos de resistencia, y por su falta de uso en la
alimentación humana y animal. Esto la convierte en el fármaco
ideal para el tratamiento de cistitis no complicadas, siendo tam-
bién una ventaja la comodidad de su posología (en monodosis o
pauta de dos días de 3g). En los últimos años se están realizando
estudios sobre la actividad frente a las ITU por cepas productoras
de BLEE, siempre que sean cistitis no complicada, con resultados
favorables (17). Dichas cepas frecuentemente presentan resisten-
cia cruzada con cotrimoxazol y fluoroquinolonas, y puede obligar
a un tratamiento parenteral en enfermos de la comunidad. Por lo
tanto, llevan asociado un grave problema terapéutico en el trata-
miento de las infecciones urinarias. La eficacia de fosfomicina, de
confirmarse en un entorno clínico determinado, significaría una
respuesta importante en el tratamiento de las infecciones cau-
sadas por este tipo de cepas y evitaría la vía endovenosa para el
tratamiento (4). En nuestro nuestro caso resulta ser muy activa
frente a estas cepas, en ambos tipos de medios.
Todas las cepas de
P. aeruginosa
y
A. baumanii
aisladas
fueron sensibles a imipenem, y todos los enterococos aislados
eran sensibles a vancomicina. En los enfermos neurológicos hay
que tener en cuenta la amplia variedad de microorganismos que
pueden causar infección urinaria, lo que dificulta el tratamiento
empírico de las ITU, por su especial resistencia a los antibióticos.
De los 78 aislados de
E. coli
BLEE, 7 pertenecen a este grupo (9%),
así como todas las cepas de
S. aureus
fueron meticilín resistente.
Entre los grampositivos destacan los enterococos con un 26%. Las
altas resistencias a cotrimoxazol y quinolonas en el grupo de los
enfermos neurológicos no aconsejan su uso como tratamiento
empírico, salvo previa realización de pruebas de sensibilidad a los
antibióticos.
En resumen,
E. coli
es el microorganismo más frecuente-
mente aislado y fosfomicina parece, en nuestro medio, seguir
siendo una posibilidad terapéutica empirica, incluyendo las cepas
productoras de BLEE, aunque es aconsejable, siempre que sea
posible, realizar urocultivo y estudio de resistencias, lo que per-
mitirá establecer un tratamiento seguro. Las cefalosporinas de 3ª
Generación también constituyen una buena alternativa terapéu-
tica limitada al ámbito hospitalario, relegando a un segundo pla-
no a la amoxicilina/ácido clavulánico, cotrimoxazol y ciproflaxaci-
no por su significada tasa de resistencias.
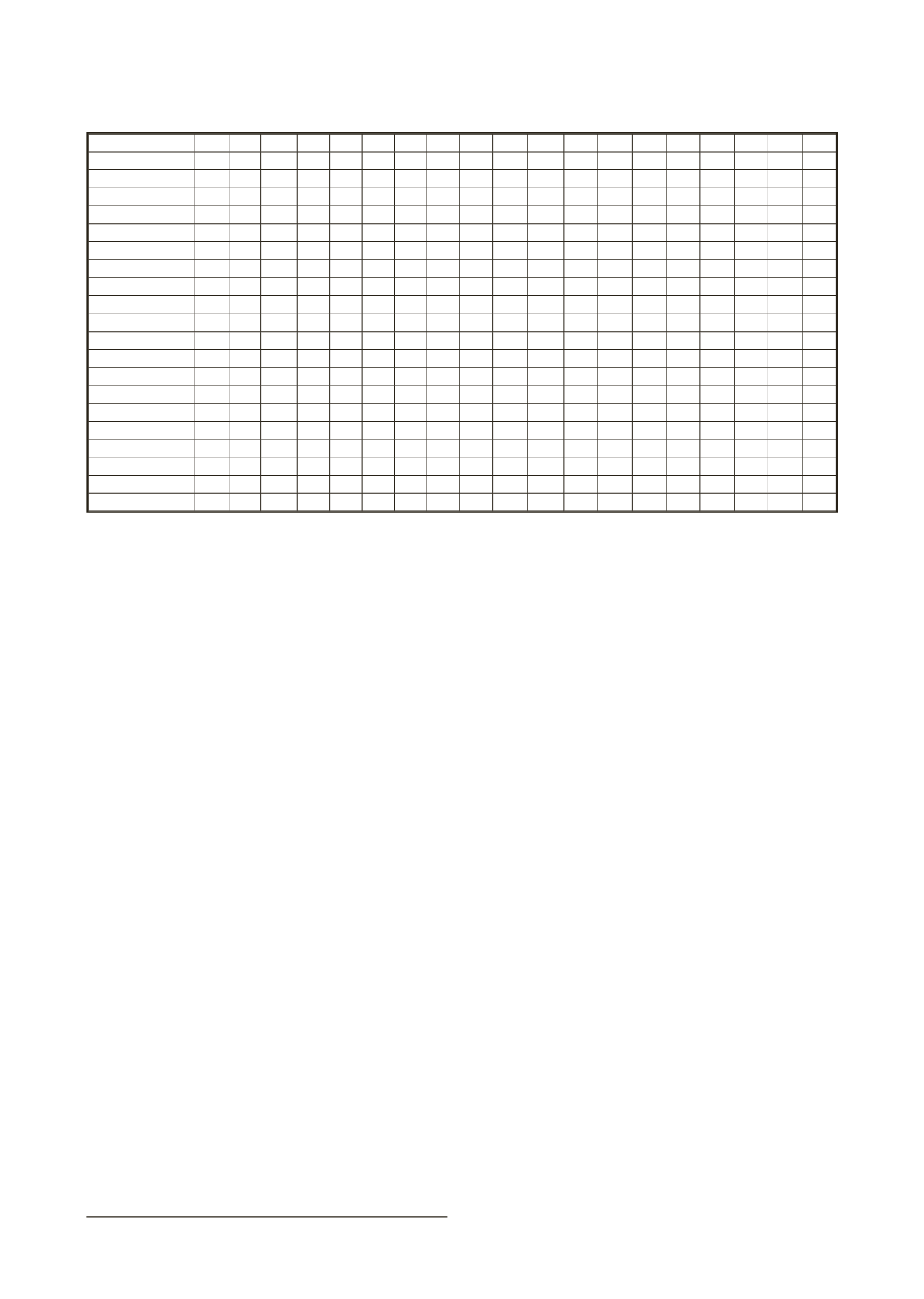
Etiología- nº de cepas
AK A-C AMP CEF CTX CAZ CFX CIP FOS CN MER IMP LEV NFT PT SXT TEI
TOB VAN
Rehabilitación
E. faecalis
- 18
100
100
28 94
94
100
E. coli
no BLEE- 24
71 29
96 96 100 92 67 100 86
100
100 100 75
92
E. coli
BLEE- 7
57 0
57 0
71 0
29 86 86
100
100 86 29
71
K. pneumoniae
- 20
85 0
100 100 95 95 85 95 95
95
65 85 85
95
P. aeruginosa
-8
100
100
88
62 0
50 100 100
100
100
S. aureus- 4
100 100
0
75
100 100
100
Comunidad
A. baumanii-
6
100
0
0
0
33 0
0
0
66
Citrobacter
spp.-23
91 0
96 91 96 96 96 100 100
100
91 100 100
100
Enterobacter
spp.-33
0
0
100 70 91 0
70 70 91
91
76 97 97
91
E. faecalis
-254
100
98
63 85
100
100
E. coli
no BLEE-1659
78 34
98 95 98 90 62 95 88
100
98 98 68
88
E. coli
BLEE – 71
55 0
38 7
55 0
24 93 67
100
88 90 55
62
K. pneumoniae-
237
89
100 97 97 92 92 73 97
100
57 92 89
95
Proteae -
139
95 49
100 95 95 95 64 79 82
51
0
100 56
90
P. aeruginosa
-34
88
88
100
62 6
73 100 100
100
91
S. aureus-
15
100 100
66 100
100 100
100
S. saprophyticcus
- 19
78 26
95
89 90
100 100
100
S. agalatiae
- 75
100
100
100
Tabla 2. Resultados obtenidos en los estudios de sensibilidad a los antibióticos en forma de porcentaje de cepas sensibles en el grupo de
los pacientes de la Unidad de Rehabilitación y Atención Primaria.
Ampicilina (AMP), Amoxicilina con ácido clavulánico (AC), Cefuroxima (CFX), Cefotaxima (CTX), Cefepime (CEF), Gentamicina (CN), To-
bramicina (TOB), Imipenem (IMP), Ciprofloxacina (CIP), Cotrimoxazol (SXT), Fosfomicina (FOS), Piperacilina-tazobactan (PT), Ceftazidima
(CAZ), Amikacina (AK), Meropenem (MER), Levofloxacina (LEV), Nitrofurantoína (NFT), Teicoplanina (TEI), Vancomicina (VAN).


