49
Otoneurología 2014:
comprendiendomejor los trastornos vestibulares
SUPLEMENTO
original
Actual.Med.
2014; 99: (791). Supl. 49-60
Tabla 1. Enfermedades autoinflamatorias y autoinmunes que
puedenasociarseconhipoacusianeurosensorial.
Es importantedestacarqueaunque sehandescritomuchos
autoanticuerpos frenteaantigenosdel oídoenpacientesconEAOI
(3), noexisteunmarcador biológicode laenfermedad (4) y la res-
puesta al tratamiento con corticosteroides no es un criterio diag-
nósticoen símismo, puesotros trastornoscomo laenfermedadde
Menierepueden responderal tratamientoconcorticoides.
Perfil clínico
Anteunahipoacusianeurosensorialuniobilateralderecien-
te comienzo en la edad adulta es necesario considerar su origen
inmunomediadoy laposibilidadde tratamiento conesteroides.
La EAOI puede comenzar comouna sordera súbita idiopáti-
ca y por estemotivo lahipoacusia súbitadeberia ser tratada con
esteroides de forma sistemática. Si presenta sintomas vestibu-
lares puede comportarse como una enfermedad de Meniere,
aunque su curso clínico suele sermás agresivo.
El perfil clínicode riesgopara laEAOI espocoespecífico: la
edadde comienzo se sitúa entre20-50 años, lahipoacusianeu-
rosensorial esbilateral y suele ser progresivaa lo largodevarias
semanas. Debe sospecharse si ya existe un diagnóstico de una
enfermedad autoinmune sistémica. Sin embargo, la hipoacusia
puede aparecer a cualquier edad y puede ser súbita, uni o bila-
teral, con sintomas progresivos ofluctuantes.
La presentación de síntomas vestibulares suele ser más
frecuentes en pacientes con enfermedad que afecta a un solo
oido. Los síntomas pueden ser variables desde inestabilidad
hasta una ataxia si presentan una afectación severa. La presen-
tación aislada de síntomas vestibulares sin hipoacusia es una
enfermedad rara, pero que puede cursar con una ausencia de
función vestibular bilateral.
Basesmolecularesde la EAOI
El saco endolinfático es un órgano con actividad inmunoló-
gica y se ha descrito la fagocitosis mediada por macrófagos y la
producción local de inmunoglobulinas.
Sehandesarrolladomodelosmurinosconun fenotiposuge-
rente de EAOI, mediante la inmunización con antígenos del oido
interno (5) y con colágeno tipo II (6) de otras especies . Las ca-
racterísticas histopatológicas de la cóclea de estos animales son
similares a los hallazgos encontrados en huesos temporales pro-
cedentes de pacientes con EAOI (lesiones en el órgano de Corti,
degeneración del ganglio espiral, hidrops endolinfático, distrofia
de la estria vascular, fibrosis del saco endolinfático e infiltración
linfociticaenel laberintomembranoso) (5, 7).
Por otra parte, se ha observadouna lesión autoimune a ni-
vel del nervio coclear en las celulas de Schwann (8). Además, en
un modelo animal de enfermedad desmielinizante como la en-
cefalomielitis alérgica experimental, se han descrito alteraciones
en el ganglio espiral, el nervio coclear, los nucleos cocleares, la
oliva superior, el lemnisco lateral y el coliculo inferior asociadas
a hipoacusia (9). La audición fue prevenidamediante la adminis-
tración de un anticuerpo dirigido frente al receptor Vb8 de los
linfocitos T (10). Sin embargo estos modelos no han permitido
identificar un anticuerpo u otromarcador biológico para el diag-
nóstico clínicode laEAOI.
En losúltimosaños, lascitoquinashancomenzadoa investigar-
seen laEAOI yexistendiversosestudiosquehandemostradoque la
familiade la IL-1βtieneunpapel central reguladoren laEAOI (11).
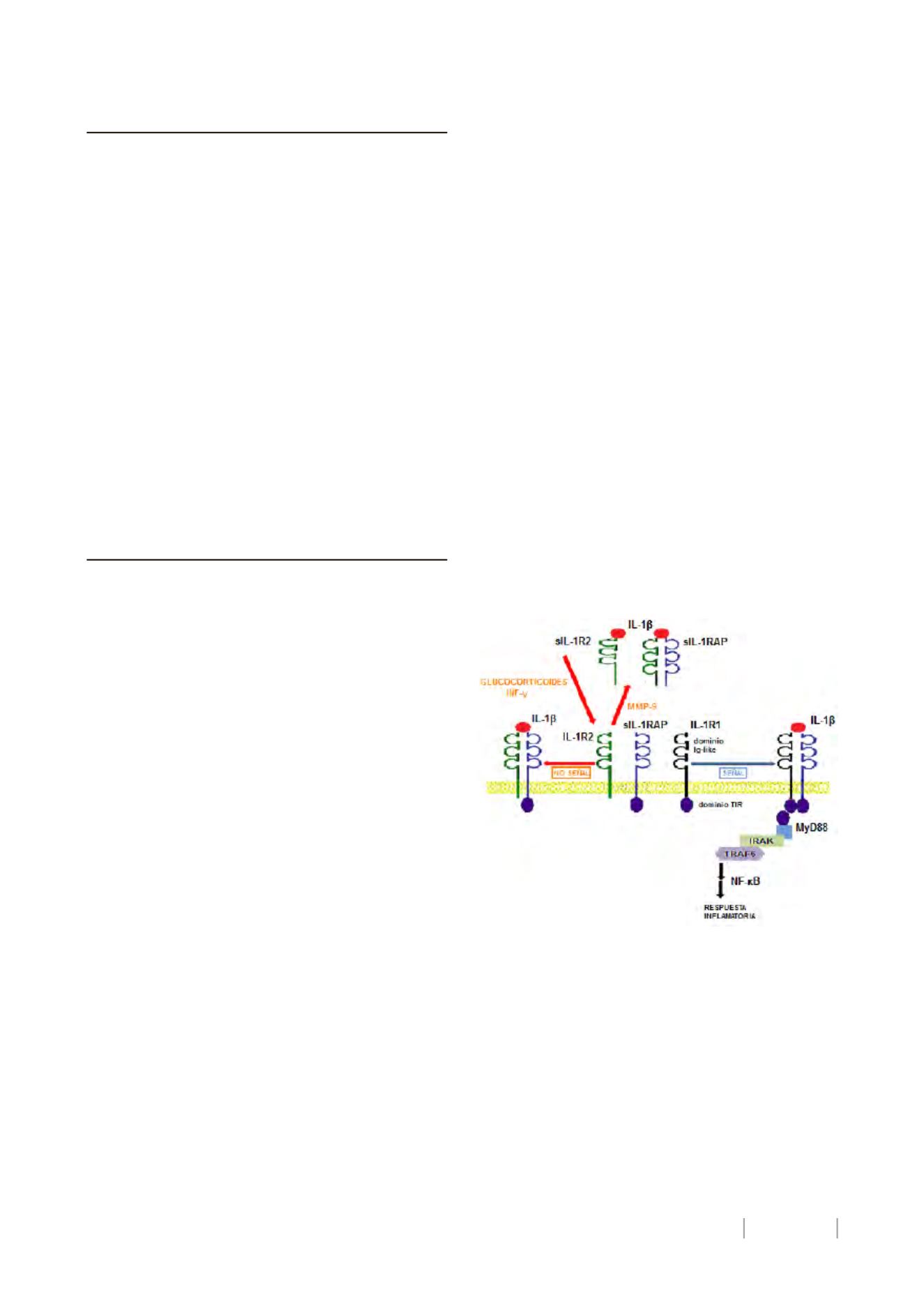
Existen2tiposde receptorespara la IL-1β. La señal de IL-1β
esmediada por el receptor tipo 1 de 80-kDa (IL-1R1), unmiem-
bro de la superfamilia
IL-1R/Toll-like
receptor que está formado
por un dominio citoplasmático Toll-IL-1R1 y otro dominio extra-
cellular
Ig-like.
Launiónde IL-1β a IL-1R1promueve launión a la
proteína accesoria de IL-1R1 (IL-1RAP) y forma un complejo de
alta afinidad que activa la señal intracelular donde interviene la
proteína adaptadoraMyD88 y una cascada proteica que incluye
IRAKyTRAF6entreotrasproteínas (Figura1).
Figura1. Rutamediadapor IL-1β. Existen2tiposde receptorespara
la IL-1β, el receptor tipo 1 (IL-1R1) y el receptor tipo 2 (IL-1R2). La
unionde IL-1βa IL-1R1promueve launiona laproteinaaccesoriade
IL-1R1(IL-1RAP), formandouncomplejodealtaafinidadqueactive la
señal intracellulardonde interviene laproteinaadaptadoraMyD88y
unacascadaproteicaque incluye IKAKyTRAF6entreotrasproteinas.
IL-1R2 es un receptor señuelo (no transmite señal), actuando como
inhibidorendógenode la IL-1β.Losglucocorticoidse INF-Υaumentan
la expression del IL-1R2, bloqueando IL-1β. Por otra parte, la IL-1β
induce la transcripción de metaloproteasa 9 (MMP-9), que tiene
capacidad para liberar la forma soluble de IL-1R2 (sIL-1R2), la cual
presentaunacapacidadmenorparabloquear IL-1β.
El receptortipo2de60-kDa (IL-1R2) esun receptor señuelo
(no transmite señal) porque su región citoplásmatica de 29 ami-
noácidos carece del dominio Toll-IL-1R (12). El IL-1R2 se expresa
Enfermedadesdel tejido conectivo
• Lupus eritematoso sistémico
• Artritis reumatoide
• Artritispsoriásica
• Esclerodermia
• Poliarteritisnodosa
• Arteritisde células gigantes
• GranulomatosisdeWegener
• Polimiositis ydermatomiositis
• Enfermedadmixtadel tejido conectivo
• SíndromedeSjogren
• SíndromedeCogan (queratitis autoinmune)
• Sarcoidosis
• Amiloidosis
• EnfermedaddeBehcet
• SíndromedeVogt-Koyanagi-Harada
• SíndromedeSusac
Enfermedadesorganoespecíficas
• Psoriasis
• Hipotiroidismoautoinmune
• EnfermedaddeGraves
• Glomerulonefritis, síndromedeGoodpasture
• Enfermedad inflamatoria intestinal (colitisulcerosay
enfermedaddeCrohn)
• Esclerosismúltipleyotrasneuropatías
desmielinizantes
• Miasteniagravis
• Gastritis atróficaautoinmune
• Uveitis


